CYP2C19*2和CYP2C19*17基因多态性与冠状动脉介入治疗后病人氯吡格雷反应性的关联分析
吴晓峰
目前推荐冠状动脉疾病(CAD)病人接受经皮冠状动脉介入(PCI)治疗后使用双联抗血小板药物,包括阿司匹林和噻吩并吡啶。目前的指导意见表明,在支架植入后仍持续该治疗至少1年[1-3]。当前广泛应用的噻吩并吡啶类抗血小板药物是氯吡格雷。然而,在使用双联药物治疗过程中,仍有病人出现复发性动脉粥样硬化血栓从而导致致命性支架血栓形成。出现这些结果可能是由于一些病人氯吡格雷的反应性低造成的,这种现象被许多科学家称为“氯吡格雷耐药性”[4-5]。平均25%的氯吡格雷治疗病人能观察到这种耐药性[6-8]。该反应的变异性机制仍不清楚。根据基因组关联研究,83%对氯吡格雷反应的个体间差异是由遗传多态性引起的[9]。之前有学者报道CYP2C19多态性是响应氯吡格雷的血小板反应性的主要决定因素[10]。为了探究CYP2C19基因上相关等位基因(*2和*17)与缺血性事件的发生及支架血栓形成的关系,现对347例经皮冠状动脉介入的支架植入病人分析结果如下。
1 资料与方法
1.1一般资料青海省心脑血管病专科医院心内科选择2014年3月至2017年3月期间招募了347例经皮冠状动脉介入的支架植入病人,其中男性206例,女性141例,年龄范围为54~70岁,年龄(62.5±3.7)岁。纳入标准:使用氯吡格雷75 mg/d和阿司匹林150~300 mg/d连续至少7 d。排除标准:慢性肝病,严重慢性肾功能衰竭,高达80岁的病人,使用氯吡格雷以外的抗血小板药,抗凝血剂或奥美拉唑作为质子泵抑制剂,血小板计数为低于150×109/L,血细胞比容值<33%或血清肌酐值>2.5 mg/dL。本研究符合《世界医学协会赫尔辛基宣言》相关要求,研究对象均在知情同意书上签字。
1.2研究方法
1.2.1基因组DNA提取 用枸橼酸钠抗凝管收集空腹静脉血5 mL,提取试剂盒(QIAamp DNA Blood MiniKit,购于QIAGEN)提取DNA。
1.2.2引物合成 CYP2C19*2与CYP2C19*17基因正向和反向的引物合成序列见表1,引物由北京华博生物技术有限公司合成。
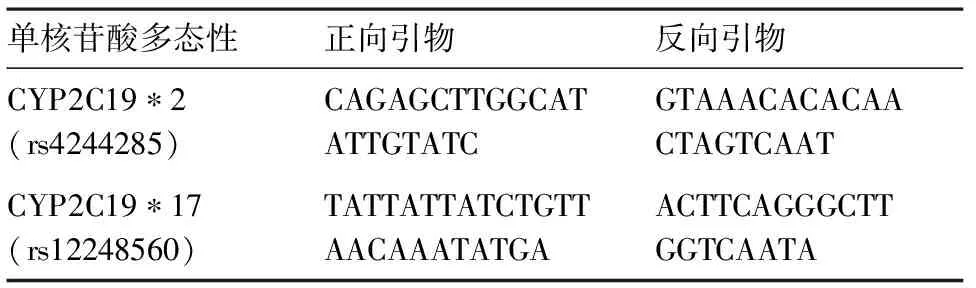
表1 CYP2C19*2与CYP2C19*17基因引物设计
1.2.3聚合酶链式反应(polymerase chain reaction,PCR)扩增 预变性95 °C 4 min、变性95 °C 30 s、退火56 °C 30 s,延伸72 °C 30 s,72 °C末延伸5 min;共35个循环;酶切体系及条件:10X FastDigest Gren Bufer 2μL,FastDigestenzyme 1μL(rs11615使用Eam1105I,rs13181使用AleI),双蒸水(ddH2O) 17 μL,PCR产物10 μL;水浴37 °C酶切10 min,然后取出立即置水浴65 °C灭活5 min;使用2%琼脂糖凝胶,电泳45 min,电压设置为145 V。
1.2.4血小板反应性的药效评价 为了测量血小板反应性,将每个样品收集到含有3.2%柠檬酸盐的1.8 mL采血管中。然后根据制造商的说明书使用VerifyNow P2Y12测定血小板反应性。当全血样本中的血小板被二磷酸腺苷(ADP)等激活剂激活后,血小板表达的糖蛋白Ⅱb/Ⅲa(GPⅡb/Ⅲa)受体与包被了纤维蛋白原的检测珠结合使血小板发生聚集,导致全血样本的透光率增加。聚集的程度与未能被抗血小板药物有效抑制的血小板受体数量呈正比,以此反映抗血小板药物的效果。报告形式:血小板反应单位(PRU)。尽管如此,血小板抑制水平以系统的百分比(%抑制)计算。根据对治疗血小板反应性定义的共识,PRU>208与PCI后缺血事件相关,心血管死亡风险增加。
1.2.5群体代表性检验 根据Hardy-Weinberg平衡定律,按以下公式计算各基因型理论频数:CC=np2,CT=2npq,TT=nq2,其中n为样本量,p、q分别为相应的等位基因频率,分别对胆囊癌病人组及正常人群组CYP2C19*2(rs4244285)与CYP2C19*17(rs12248560)基因型分布进行群体代表性检验。
1.3统计学方法使用SPSS 22.0统计软件进行分析。采用χ2检验分析Hardy-Weinberg遗传平衡定律和两组间基因型和等位基因频率分布的差异。氯吡格雷治疗的应答因素采用多变量logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1氯吡格雷的反应通过VerifyNow P2Y12测定法测量347名病人的血小板反应性(PRU)和抑制值(%)。PRU>208的104例(30%)病人被列为氯吡格雷治疗的无应答组,其余243例(70%)病人被列为氯吡格雷治疗的应答组。比较两组PRU和抑制率(%),应答组与非应答组的PRU值分别为(143.0±32.0)、(241.5±26.4);而应答组与非应答组的抑制率分别为(41.0±12.0)%、(13.0±7.0)%,两组间差异有统计学意义(均P<0.001)。
2.2基因分型结果在CYP2C19*2(rs4244285)中,氯吡格雷治疗无应答组GG型57例,GA型40例,AA型7例;氯吡格雷治疗应答组GG型196例,GA型42例,AA型5例。在CYP2C19*17(rs12248560)中,氯吡格雷治疗无应答组CC型78例,CT型24例,TT型2例;氯吡格雷治疗应答组CC型165例,CT型74例,TT型4例。
2.3氯吡格雷应答组与无应答组的CYP2C19基因型分布CYP2C19*2、CYP2C19*17基因多态性均存在3种基因型,对各基因的3种基因型分布经χ2检验发现CYP2C19*2(rs4244285)的基因型分布与其他基因型分布相比,差异有统计学意义(χ2=7.04,P<0.001)。结果见表2。CYP2C19*2(rs4244285),G、A等位基因在氯吡格雷应答组的分布频率分别为89.3%、10.7%;在氯吡格雷无应答组的分布频率分别为74.0%、26.0%,两组间差异有统计学意义(χ2=5.25,P<0.001)。CYP2C19*17(rs12248560),C、T等位基因在氯吡格雷应答组的分布频率分别为83.1%、16.9%;在氯吡格雷无应答组的分布频率分别为84.1%、13.1%,两组间差异无统计学意义(χ2=0.68,P=0.416)。结果见表3。
2.4CYP2C19*2、CYP2C19*17多态性与药效反应的关系分析CYP2C19*2、CYP2C19*17基因型与药效反应的关系时发现CYP2C19*2的A(突变型)等位基因与CYP2C19*2的G(野生型)等位基因比较,差异有统计学意义(χ2=6.30,P=0.003),而CYP2C19*2的A/A基因型与CYP2C19*2的G/G基因型比较,差异有统计学意义(χ2=5.81,P=0.031)。CYP2C19*17的C/T基因型与CYP2C19*17的C/C基因型比较,差异有统计学意义(χ2=5.30,P=0.024)。结果见表4。
2.5CYP2C19*2、CYP2C19*17多态性对氯吡格雷治疗有反应的多因素logistic回归分析在调整了其他因素对氯吡格雷应答的影响后,CYP2C19*2(rs4244285)位点基因多态性与氯吡格雷应答相关(P=0.013),其调整OR值为1.773。此外,CYP2C19*17(rs12248560)位点基因多态性也与氯吡格雷应答相关(P=0.047),其调整OR值为1.505。结果见表5。
3 讨论

表2 两组经皮冠状动脉介入病人CYP2C19*2和CYP2C19*17基因型频率分布/例(%)

表3 两组经皮冠状动脉介入病人CYP2C19*2和CYP2C19*17等位基因频率分布/例(%)
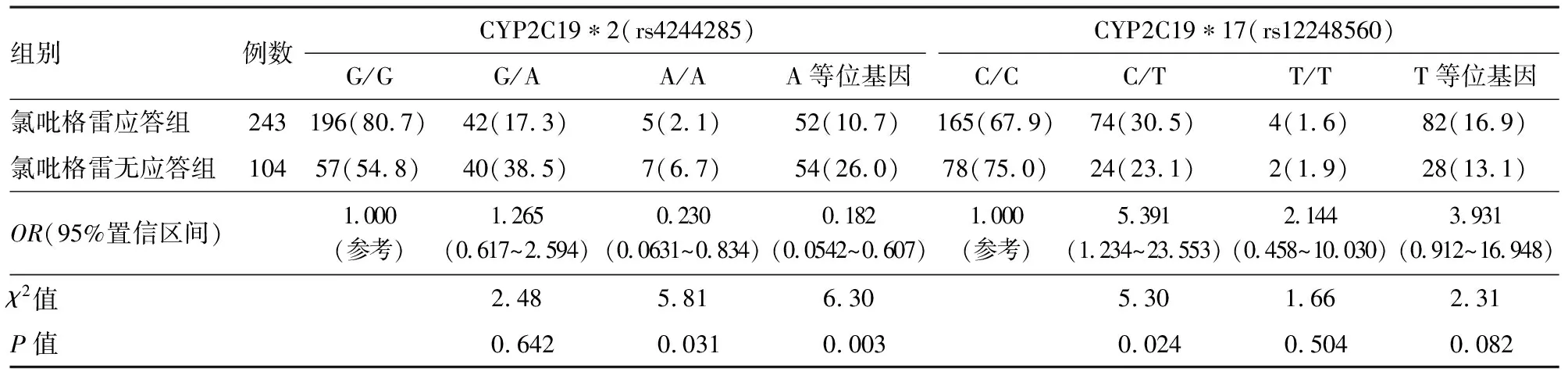
表4 两组经皮冠状动脉介入病人CYP2C19*2、CYP2C19*17多态性与药效反应的关系/例(%)
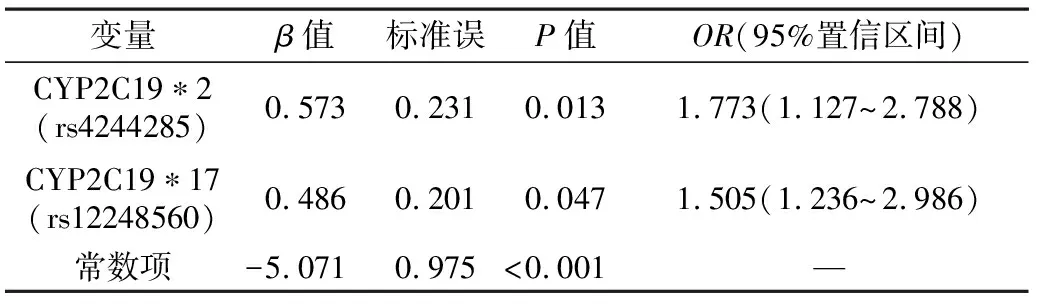
表5 经皮冠状动脉介入病人氯吡格雷治疗应答的多因素logistic回归分析
氯吡格雷是血小板膜上P2Y12受体的不可逆抑制剂,是一种需要代谢转化的口服前体药物。在通过ABCB1基因编码的外排泵肠吸收后,约90%的氯吡格雷通过羧甲酯酶1(CES1)水解成无活性的代谢物。少数人通过细胞色素P450(CYP)酶以两步法转化为活性代谢物。然后氯吡格雷的活性代谢物不可逆地与由P2Y12基因编码的腺苷二磷酸受体(ADP)结合,并抑制由涉及血小板聚集的ITGB3基因编码的糖蛋白Ⅱb/Ⅲa复合物的活化[11]。先前的研究指出了参与编码氯吡格雷生物活化途径的蛋白质的基因变异,特别是CYP酶由于其多态性而引起关注[12]。CYP2C19多态性是响应氯吡格雷的血小板反应性的主要决定因素。这个发现首先由Kim等发表[13],并由Holmes等[14]进一步完善。通过遗传和临床研究已经在CYP2C19基因上检测到其相关等位基因(如CYP2C19*2)的功能丧失与缺血事件和支架血栓形成风险增加有关[15]。相反,同一基因的不同等位基因(如CYP2C19*17)的增益功能变异与氯吡格雷活化增加有关[16]。
本次研究的结果显示,CYP2C19*2(rs4244285)基因型与等位基因频率分布差异有统计学意义,并且CYP2C19*2(rs4244285) A/A基因型和A等位基因与氯吡格雷的应答显著相关,此外CYP2C19*17(rs12248560)C/T基因型也与氯吡格雷的应答显著相关,说明了两个CYP2C19基因多态性是响应氯吡格雷的血小板反应性的主要决定因素。在后续研究中我们需进一步验证该结果。本次研究发现在CYP2C19*2(rs4244285)和CYP2C19*17(rs12248560)基因型与病人对氯吡格雷治疗反应之间的相关性,可能是由于多种蛋白质在抗血小板活性形成中的相互作用而造成的。
尽管以形成有效的抗血小板活性的新型抗血栓药(普拉格雷,替卡格雷)逐渐走在前列,但氯吡格雷在世界各地仍然普遍使用。由于新一代药物导致的出血风险增加和销售价格较高,氯吡格雷在抗血小板治疗中将保持其重要性。通过血小板聚集测定,我们证实了CYP2C19*2(rs4244285)和CYP2C19*17(rs12248560)基因型对氯吡格雷药效学的影响。

