基于标准菌株Vd076的棉花黄萎病抗性快速分子评价方法初报
赵丽红,冯自力,冯鸿杰,师勇强,周京龙,张冉,魏锋,朱荷琴
(国家棉花生物学重点实验室/ 中国农业科学院棉花研究所,河南安阳455000)
黄萎病(Verticillium wilt)严重影响棉花产量和品质,是比较难防治的维管束病害[1-2]。 该病发病时间长,化学防治和生物防治难度大[3-4]。目前,种植抗病品种是控制其危害的最经济有效的措施[5-6]。
棉花品种抗黄萎病性鉴定方法分为成株期鉴定和苗期鉴定法。 由于棉花黄萎病是成株期病害,发生危害期为棉花的现蕾初期到收获期,且不同品种对黄萎病的抗性与生育期相关,采用成株期鉴定更能真实检测棉花品种的抗黄萎病性。 目前,成株期鉴定一般采用重病田或人工病圃,重病田鉴定由于不能控制病原菌的数量、 发病不均匀等问题,只能用于育种材料的初筛,而人工病圃成株期鉴定是确定棉花黄萎病抗性的最可靠方法,并于2009年发布实施了国家标准GB/T 22101.5—2009。苗期鉴定主要是通过菌液浇根[7]、蘸根[8]、针刺[9]等方法接菌,与成株期鉴定相比,大大缩短了鉴定周期,且比较容易掌握、 重复性也较好,但也存在以下不足:(1)反映的是苗期的抗病性,且人为伤根,很难达到对品种抗病性综合评价的目的;(2) 需要严格的环境条件,且技术环节不易掌握,如:控制适宜的温湿度、抗病和感病对照、接种时期、接种浓度和接种量、调查时期等;(3)耗费人力和物力,鉴定周期偏长,如:需要对土壤或基质进行灭菌、制作营养钵、培养病原菌等,仍需40 d 左右的鉴定周期。 鉴于棉花黄萎病发病周期长,在成株期和苗期鉴定棉花黄萎病抗性耗时较长,受环境影响大,为了满足研究者的不同需求,有必要摸索棉花黄萎病抗性快速鉴定的新方法。 通过实时荧光定量聚合酶链式反应(Polymerase chain reaction,PCR) 技术鉴定植物抗病性已有诸多应用,如苜蓿[10]、甘蔗宿根矮化病菌[11]、普通菜豆[12]等,很多研究结果已经证明实时荧光定量PCR 技术能够有效地区分抗病性水平不同的寄主植物,并不用单纯通过植株外部病症严重程度进行评价[13-15]。因此,本研究采用实时荧光定量PCR 技术检测大丽轮枝菌 (Vd076) 在棉苗根部DNA的含量,然后分析其与寄主抗黄萎病性的关系,旨在建立一种更加快速的棉花黄萎病抗性鉴定方法。
1 材料与方法
1.1 供试棉花品种
选取28 个黄萎病抗性不同的陆地棉品种,分别为冀棉11、创0712、冀棉169、中棉所49、新植5号、中植棉2 号、新陆早41 号、新陆中47 号、鲁棉研28、中棉所50、冀棉958、瑞杂816、中棉所41、鲁棉研21、中棉所63、银瑞361、银科178、嘉兴5388、周棉9408、百棉1 号、H559、中棉所8 号、中棉所35、新陆早42 号、鄂杂棉29、湘杂棉7 号、新陆早7 号、铜杂411 F1。 其中,中植棉2 号为抗病对照,冀棉11 为感病对照。 供试品种均由本实验室保存。
1.2 供试菌株
供试菌株为人工病圃棉花黄萎病抗性评价采用的标准菌株Vd076(CGMCC No.5902)[16],由本实验室保存。 于2007年分离自河南省内黄县棉花黄萎病重病田,为致病力中等偏强、落叶型菌株。野生菌株经单孢纯化后,于—80 ℃冰箱中保存。 将保存菌株于PDA 平板上活化,25~28 ℃培养6~7 d备用。
1.3 供试品种的抗病性鉴定
采用成株期人工病圃法[16]。2015年4月将供试棉花品种及对照品种播种于本所黄萎病人工病圃,每品种4 次重复,每重复2 行,行长5 m,行距0.8 m,每行留苗20 株,随机排列,生长期间正常防治虫害,不使用任何杀菌剂,栽培管理按日常大田管理进行。 依据国家标准(GB/T 22101.5—2009)中所述的五级分类法评判发病级别,根据调查结果,计算出发病率、病情指数和相对病情指数(IR)。 以相对病情指数来划分各品种的抗病类型[17-18]。
1.4 实时定量PCR 快速鉴定方法的建立
1.4.1接菌方法。将各品种播种于灭菌的基质(蛭石与沙土体积比为6∶4)中,待2 片子叶长成时小心移栽到装有棉花霍格兰营养液[19]的长、宽、高分别为29.5 cm、18.5 cm、10 cm 的水培盆中,待1 片真叶平展时采用蘸根法接菌[20]。 将水培苗取出,放在装有孢子悬浮液(含量为1×107mL—1)的大烧杯内浸泡40 min,保证所有根系均在液面以下,将接完菌的棉苗重新放入植物营养液中,继续培养。
1.4.2取样方法。培养1、2、3、4、5、6、7 d 时分别取出棉苗,先后用流动的自来水将根冲洗干净,再用灭菌蒸馏水冲洗1 遍,用吸水纸充分吸干水分后剪成小段,再用锡箔纸包裹,经液氮速冻后,放入—80 ℃冰箱中用于DNA的提取。
1.4.3DNA提取及PCR 反应体系。采用CTAB法[21]提取供试菌株根部黄萎病菌(Vd076,下同)的DNA。 以棉花黄萎病菌的持家基因β 微管蛋白基因为模板,设计高特异引物,Vdβt-F:AACAACAGTCCGATGGATAATTC,Vdβt-R:GTACCGGGCTCGAGATC[19],不同棉花品种的根部黄萎病菌DNA的定量采用Bio-Rad iQ5 实时荧光定量PCR 仪进行。
实时荧光定量PCR 反应体系为:引物Vdβt-F/Vdβt-R (10 μmol·L—1) 各0.4 μL,2×Ultra SYBR Mixture(康为世纪生物科技有限公司,北京) 10.0 μL,ddH2O 8.8 μL,模板DNA0.4 μL;扩增条件为:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸40 s,40 个循环;融解曲线的程序为95 ℃15 s,60 ℃1 min,95 ℃15 s,60 ℃15 s。
1.4.4标准曲线的制作。测定黄萎病菌株和棉花根部黄萎病菌DNA含量,稀释成100 mg·L—1的母液,按照梯度稀释的原则分别用灭菌去离子水,将DNA稀释成102、101、100、10—1、10—2、10—3mg·L—1共6 个质量浓度[12]。 每个质量浓度DNA稀释液取2 μL 作为模板,用实时定量PCR 仪进行实时荧光定量PCR 扩增,每个浓度重复3 次,对照分别为灭菌去离子水和100 ng 棉花根部DNA。以Ct值为纵坐标,DNA样品浓度的对数值为横坐标作图,绘制DNA标准曲线并计算回归方程、 确定特异性检测引物的灵敏度及优化PCR 反应的扩增效率。
1.4.5最佳取样时间的确定。以冀棉11、中植棉2号、鲁棉研21 为供试品种,接种黄萎病菌后的1、2、3、4、5、6 和7 d 取棉苗根部。每个处理3 次重复。检测根部黄萎病菌的含量。
1.4.6实时定量PCR 方法检测供试棉花品种根部黄萎病菌DNA的含量。将28 个品种根部DNA样品均制备成100 mg·L—1,取2 μL 为模板,通过实时荧光定量PCR 测定DNA样品的Ct值,根据回归方程的公式计算出100 ng 根部黄萎病菌DNA的含量,反应体系和程序同1.4.3。 为了保证样品间的可比较性,28 个样品在一次实时荧光定量PCR 反应中全部完成。
1.5 数据统计与分析
数据分析采用Statistix 8.1 数据分析软件完成。 实时荧光定量qPCR (Real-time quantitative PCR detecting system,即实时荧光定量核酸扩增检测系统)数据采用iQ5 自带软件MyiQ2 Version 2.1(Bio-Rad Laboratories Co.,USA)生成扩增曲线、标准曲线和溶解曲线,回归分析采用Microsoft Office Excel 2003 进行。 数据采用SPSS 17.0 软件进行方差分析,采用最小显著差异法进行差异显著性检验(α=0.05)。
2 结果与分析
2.1 供试棉花品种在病圃中的发病情况
2015年棉花黄萎病重病田的发病较为均匀,28 个品种呈现出不同的抗病性,发病率在20%~80%,相对病情指数分布在9.0~50.0。其中,表现为高抗的品种1 个,为创0712;表现为抗病的有中棉所49、冀棉958、新植5 号、冀棉169、银瑞361、周棉9408、中植棉2 号共7 个;耐病品种有新陆早41号、鲁棉研28、新陆中47、中棉所50、瑞杂816、中棉所41、 鲁棉研21、 中棉所63、 银科178、 嘉兴5388、百棉1 号、H559、中棉所8 号、中棉所35 和铜杂411F1 共15 个;感病品种有冀棉11、新陆早7号、湘杂棉7 号、新陆早42 号和鄂杂棉29 共5 个(表1)。
2.2 标准曲线的绘制
以梯度稀释的黄萎病菌DNA(102、101、100、10—1、10—2、10—3mg·L—1)为模板,进行实时荧光定量PCR扩增,结果显示Ct值(y1)与对数转换(以2 为底)后的DNA质量浓度梯度(x1)呈现良好的线性关系,标准方程为:y1=—3.081 4x1+26.34,R2=0.986 4,扩增效率为90.8%,线性范围达到6 个数量级,Ct值范围为19.73~34.58,最低可检测到10—3mg·L—1(图1)。
同样地,以梯度稀释的棉花根部黄萎病菌DNA为模板,进行实时荧光定量PCR 扩增,结果显示Ct值 (y2) 与对数转换后的DNA浓度梯度(x2) 呈现良好的线性关系,标准方程为:y2=—2.648 9x2+25.834,R2=0.973 8(图1)。
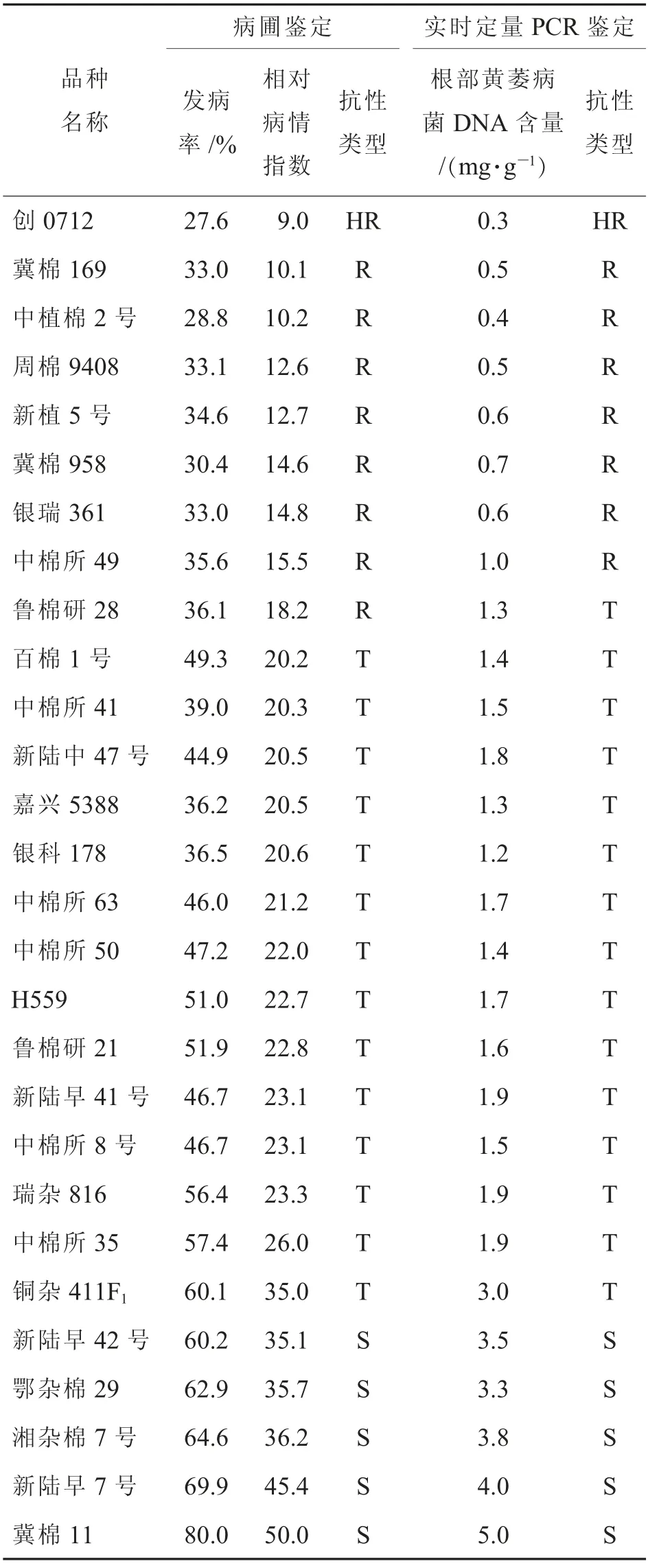
表1 28 个棉花品种的发病率、相对病情指数、抗性类型与接种后1 d 根部黄萎病菌DNA含量对照表
2.3 最佳取样时间的确定
在接菌后的不同时间,感病、耐病和抗病品种根部的黄萎病菌DNA含量呈现出一致的趋势,均表现为感病品种冀棉11 的最高,其次是耐病品种鲁棉研21,而中植棉2 号最低(图2)。 差异显著性分析表明,在接菌后1、4、5、6、7 d,抗病品种、耐病品种和感病品种之间根部黄萎病菌DNA含量均达差异显著水平,在接菌后的1 d,感病品种冀棉11根部黄萎病菌DNA含量最高(3.0 mg·g—1),抗病品种中植棉2 号最低(0.83 mg·g—1),耐病品种鲁棉研21 介于两者之间(2.02 mg·g—1)。 为达到快速、准确的目的,确定接菌后1 d 为最佳取样时间。

图1 实时荧光定量PCR 标准曲线
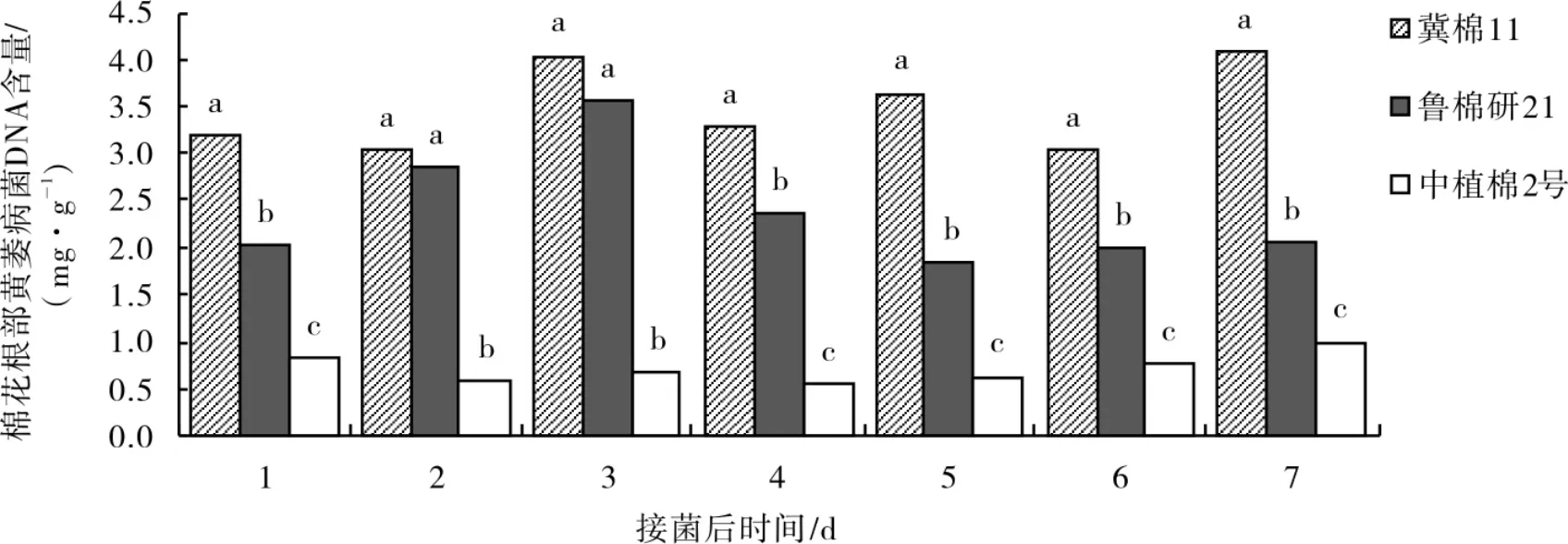
图2 3个品种接菌后不同时间的黄萎病菌DNA含量比较

图3 接菌后1d不同品种棉花根部黄萎病菌DNA含量和相对病情指数对比
2.4 不同品种棉花根部黄萎病菌DNA的含量
接种1 d 后,在28 个棉花品种根部黄萎病菌DNA的含量为0.3~5.0 mg·g—1。 病圃鉴定中表现为高抗的品种创0712(病情指数为9.0)根部黄萎病菌DNA的含量最低,为0.3 mg·g—1;DNA含量最高的为感病对照品种冀棉11,达到5.0 mg·g—1,其病圃鉴定中病情指数也是最高(50.0)(图3)。 相关性分析显示,供试品种的病情指数与根部黄萎病菌DNA含量之间呈显著正相关(图4)。
2.5 依据根部黄萎病菌DNA含量评价棉花品种抗病性的标准
28个供试品种中表现为高抗的品种有1个,为创0712,其根部黄萎病菌DNA含量为0.3 mg·g—1;表现为抗病的有冀棉169、中植棉2 号、周棉9408、新植5 号、冀棉958、银瑞361 和中棉所49共7 个,其根部黄萎病菌DNA含量为0.5~1.0 mg·g—1;表现耐病的品种有鲁棉研28、百棉1 号、中棉所41、新陆中47 号、嘉兴5388、银科178、中棉所63、中棉所50、H559、鲁棉研21、新陆早41 号、中棉所8 号、瑞杂816、中棉所35 和铜杂411 F1共15个,其根部黄萎病菌DNA含量为1.2~3.0 mg·g—1;表现感病的品种有新陆早42 号、鄂杂棉29、湘杂棉7 号、新陆早7 号和冀棉11 共5 个,其根部黄萎病菌DNA含量为3.1~5.0 mg·g—1(表1)。 因此,依据人工病圃鉴定结果和荧光定量PCR 的检测结果,推荐基于棉花根部黄萎病菌荧光定量PCR 检测结果评价棉花黄萎病抗性的分级标准:0~0.3 mg·g—1为高抗品种,0.3~1.0 mg·g—1为抗病品种,1.0~3.0 mg·g—1为耐病品种,>3.0 mg·g—1的为感病品种。

图4 供试棉花品种的病情指数与根部黄萎病菌DNA含量之间的相关性
3 结论与讨论
鉴于棉花黄萎病发病周期长,在病圃和重病田鉴定棉花黄萎病抗性结果可靠,但是耗时较长,为了满足研究者的不同需求,有必要摸索棉花抗病性快速鉴定的新方法。棉花根部是黄萎病菌侵入寄主的第一道屏障[22],不同抗病性棉花品种的根系分泌物对黄萎病菌生殖生长和孢子萌发影响不同,前者起抑制作用,后者则呈现促进作用。 分析氨基酸和可溶性糖的组分,发现抗病品种根系分泌物中的种类较感病品种显著降低[23-24]。 由于不同抗病性棉花品种根系分泌物的差异,或许会引起病原菌在根部定植量的差异。目前很多研究结果已经证明实时荧光定量PCR 技术能够有效地区分抗病性不同的植物寄主[13-14],优于单纯通过植株外部病症严重程度进行评价。
传统的温室培养,一般接种病原菌7 d 后棉花叶片才有轻微的典型黄萎病病斑出现[17],但是不足以进行抗病性评价。 本研究通过荧光定量PCR 技术能够在棉花品种表现出明显发病症状前定量检测寄主根组织内的黄萎病菌DNA含量,在水培棉苗接种后1 d 没表现出任何发病症状时就可以有效区分不同抗病性的品种[25]。 这使得该技术克服了传统抗病鉴定方法中耗时长、受环境影响大、准确性不高等缺陷。 但是,本研究建立的棉花黄萎病抗性快速评价方法仅是根据病圃鉴定标准菌株Vd076 的根部黄萎病菌DNA含量建立的,后续研究中研究者如果采用其他菌株,需要重新建立根部黄萎病菌DNA含量与品种抗病性之间的关系。
综上,该研究为棉花资源材料、新品种(系)的快捷筛选提供了新思路,在抗病品种分子辅助选择中有很好的应用前景。

