温度胁迫对大鳞副泥鳅抗氧化与非特异性免疫指标的影响*
范耘硕 邵 蓬 贾旭颖 高金伟 窦 勇 史谢尧 周文礼
(天津市水产生态与养殖重点实验室 天津农学院水产学院 天津 300384)
水产动物在养殖与运输过程中会受到多种胁迫因子的影响。机体在胁迫作用下的应激反应分为三级(Wendelaar Bonga,1997),其中,主要应激反应包括儿茶酚胺和皮质醇循环水平的增加;继发性应激反应由主要反应引起,包括能量调动的增加,主要表现为高血糖和脂质代谢量的上升,为应对胁迫提供了必要的能量。其他继发性应激反应与体内渗透压及心血管、呼吸和免疫功能有关(Barton,2002)。而主要应激反应与继发性应激反应可能会引起影响鱼体机能的三级应激反应,如生长性能、繁殖能力和存活率等(Schreck,2010)。温度胁迫是水产养殖过程中重要的胁迫因子之一,鱼类对水温变化的响应主要表现为摄 食量、生长周期、繁殖率和存活率等生理生化指标的变化(李勇等,2011)。抗氧化酶通常存在于好氧生物的各种组织中,超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)是水生动物重要的抗氧化因子,可以除去体内过量的活性氧自由基(成艳波等,2017)。抗氧化酶活力直接受温度调控,环境温度过高或过低会导致抗氧化酶活力下降(刘峰等,2016; 罗伟等,2017)。非特异性免疫是鱼类免疫反应的主要机制,溶菌酶(Lysozyme,LZM)和碱性磷酸酶(Alkaline phosphatase,AKP)是这一过程中的2个关键酶(薛宝贵等,2013)。温度也是刺激鱼类非特异性免疫机能变化的主要环境因素之一,当环境温度低于鱼类最适水温时,鱼体的免疫反应通常会降低或延迟,而过高的水温会则造成与免疫相关酶活力的丧失,影响鱼类正常的免疫应答反应(Raidaet al,2007; Bowden,2008)。
大鳞副泥鳅(Paramisgurnus dabryanus)为鲤形 目(Cypriniformes)、鳅科(Cobitidae)、副泥鳅属(Paramisgurnus),属温水性鱼类,具有口感风味佳,营养价值高,生长速度快,环境耐受力强等特点,已成为东亚地区,特别是中国和韩国重要的淡水养殖品种之一(Youet al,2011; Xiaet al,2011; Zhanget al,2015)。目前,关于温度胁迫对水产动物影响的研究多见于常见或名贵水产经济动物,而关于温度胁迫对大鳞副泥鳅的研究较少。本研究以大鳞副泥鳅为研究对象,通过对实验鱼进行4种温度下12 h的胁迫实验及24 h的恢复实验,测定肝脏和血清中部分抗氧化与非特异性免疫指标的变化,以期为评价大鳞副泥鳅对环境变化的适应能力提供理论依据。
1 材料与方法
1.1 实验用鱼与饲养管理
实验用鱼由天津鸿腾水产科技发展有限公司提供,体重为(38.20±3.70) g,体长为(19.3±2.8) cm。实验用鱼运回实验室后,暂养7 d,暂养水温为22℃。实验开始前,选取大小均匀、体格健壮、活力较强的个体,禁食24 h后用于实验。实验分为胁迫期与恢复期,实验共36 h,其中,胁迫期为12 h,分为4个处理,分别标记为对照组、高温组、降温组和低温组,对应水温分别为22℃、29℃、15℃和8℃,每个处理设3个平行,每个平行使用60 L玻璃水槽养殖容器,每个水槽中随机放60尾鱼。使用加热棒和制冷循环水机控制温度,各水槽温度误差为±0.5℃,每20 min检测1次水温;恢复期为24 h,各处理水温快速调整至(22±0.5)℃。实验用水为曝气48 h的自来水,实验期间使用气泵充气,水体pH为8.5~8.0,溶解氧为6.1~ 7.3 mg/L,总N浓度为0.2~0.3 mg/L。
1.2 样品采集
在胁迫期的第1、2、4、8、12 h及恢复期的第4、8、12、24 h(以r-4、r-8、r-12和r-24 h表示)分别取血清和肝脏样品,每次随机从各槽中取出5尾实验鱼,使用MS-222(0.5 mg/L)麻醉后,进行尾静脉取血,将取出的血液转入1.5 ml离心管后,4℃静置2 h,4℃条件下,3000 r/min离心10 min,取上清液,转入-80℃超低温冰箱保存;取血后,在冰盘上解剖实验鱼,取肝脏,用4℃去离子水冲洗,并按1∶9(W/V)加入预冷生理盐水(4℃,0.86%),使用玻璃匀浆器在冰水浴中匀浆,制成10%组织匀浆液,4℃条件下3500 r/min离心10 min,取上清液,转入-80℃超低温冰箱保存。
1.3 实验指标测定
实验鱼肝脏样品中的CAT、SOD、丙二醛(Malondialdehyde,MDA)、LZM及AKP分别采用南京建成生物工程研究所提供的A007-2过氧化氢酶(CAT)测定试剂盒(可见光法)、A001-1总超氧化物歧化酶(T-SOD)测试盒(羟胺法)、A003-1丙二醛(MDA)测定试剂盒(TBA法)、A050-1溶菌酶(LZM)检测试剂盒(比浊法)以及A059-1碱性磷酸酶(AKP)测试盒(可见光比色法)进行测定,测定仪器为SHIMADZU紫外UVmini-1240可见分光光度计,Thermo Scientific Varioskan Flash全波长扫描式多功能读数仪(多功能酶标仪);血清谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate transaminase,AST)含量使用东芝TBA-120FR全自动生化分析仪进行测定;使用考马斯亮蓝G250染料结合法测定总蛋白质含量(Bradford,1976)。
1.4 实验数据处理
实验数据以平均值±标准差(Mean±SD)表示。使用IBM SPSS 21.0对实验数据进行单因素方差分析(One-way ANOVA)和Duncan多重比较,设定P值为0.05,P<0.05表示差异显著。
2 结果
2.1 温度胁迫对大鳞副泥鳅肝脏抗氧化相关指标的影响
实验期间,对照组SOD活力基本稳定。温度胁迫显著降低肝脏SOD活力(P<0.05),至胁迫期结束 (12 h),各实验组SOD活力均显著低于对照组(P<0.05),其中,高温组SOD活力最低,显著低于其他处理组(P<0.05)。恢复期内,各实验组SOD活力均逐渐升高,至恢复期结束时(r-24 h),各实验组SOD活力基本恢复至对照组水平(P>0.05)(图1)。对照组CAT活力在实验期间基本稳定。温度胁迫显著降低肝脏CAT活力(P<0.05),至胁迫期结束(12 h),各实验组CAT活力均显著低于对照组(P<0.05),其中,高温组显著高于降温组与低温组(P<0.05)。恢复期内,各实验组CAT活力均逐渐升高,至恢复期结束时(r- 24 h),各实验组CAT活力基本恢复至对照组水平(P> 0.05)(图2)。对照组MDA含量在实验期间基本稳定。温度胁迫显著升高肝脏MDA含量(P<0.05),至胁迫期结束(12 h),各实验组MDA含量均显著高于对照组(P<0.05),其中,低温组显著高于高温组(P<0.05)。恢复期内,各实验组MDA均逐渐下降,至恢复期结束时(r-24 h),各实验组MDA含量基本恢复至对照组水平(P>0.05)(图3)。
2.2 温度胁迫对大鳞副泥鳅肝脏LZM与AKP活力的影响
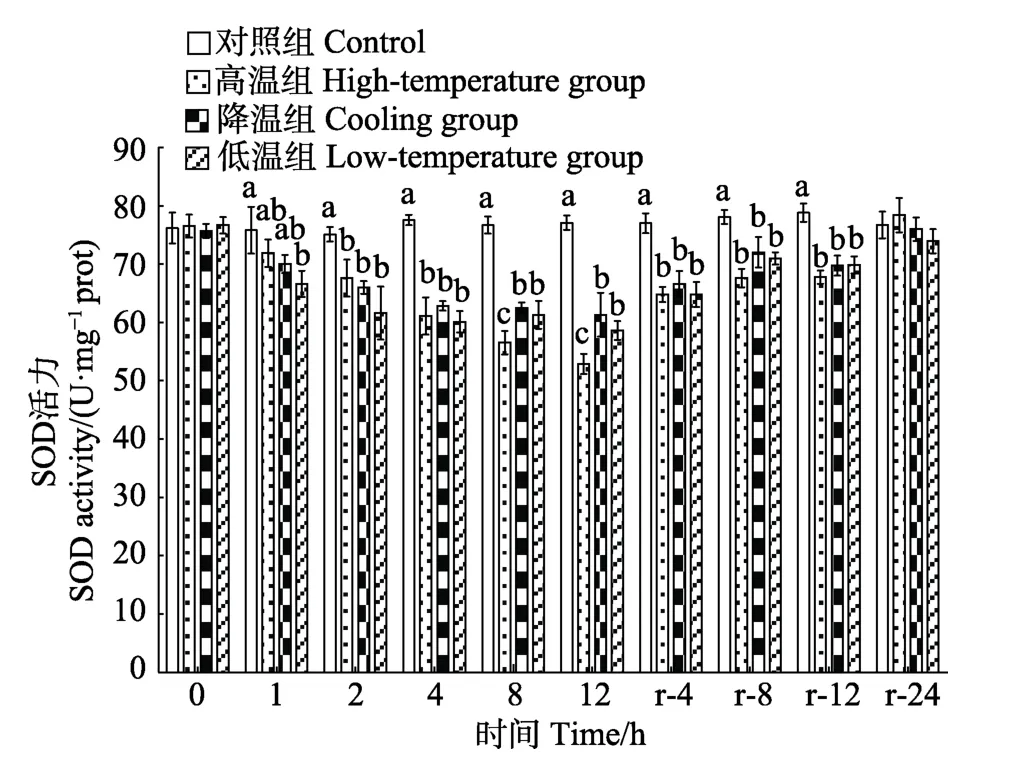
图1 温度胁迫对大鳞副泥鳅肝脏SOD活力的影响 Fig.1 Effects of temperature stress on SOD activity of P.dabryanus
实验期间,对照组LZM活力基本稳定。温度胁迫显著降低肝脏LZM活力(P<0.05),至胁迫期结束(12 h),各实验组LZM活力均显著低于对照组(P< 0.05)。恢复期内,高温组LZM活力基本稳定,降温组与低温组逐渐升高,至恢复期结束时(r-24 h),高温组LZM活力显著低于其他各组(P<0.05),降温组与 低温组基本恢复至对照组水平(P>0.05)(图4)。对照组AKP活力在实验期间基本稳定。温度胁迫显著降低肝脏AKP活力(P<0.05),至胁迫期结束(12 h),各实验组AKP活力均显著低于对照组(P<0.05)。恢复期内,高温组AKP活力基本稳定,降温组与低温组逐渐升高,至恢复期结束时(r-24 h),高温组AKP活力显著低于其他各组(P<0.05),降温组与低温组基本恢复至对照组水平(P>0.05)(图5)。
2.3 温度胁迫对大鳞副泥鳅血清转氨酶含量的影响
实验期间,对照组AST含量基本稳定。温度胁迫显著升高肝脏AST含量(P<0.05),至胁迫期结束(12 h),各实验组AST含量均显著高于对照组(P< 0.05)。恢复期内,各实验组AST含量均呈先升高后下降的趋势,至恢复期结束时(r-24 h),各实验组AST 含量基本恢复至对照组水平(P>0.05)(图6)。对照组ALT含量在实验期间基本稳定。温度胁迫显著升高血清ALT含量(P<0.05),至胁迫期结束(12 h),各实验组ALT含量均显著高于对照组(P<0.05),其中高温组显著高于降温组。恢复期内,各实验组ALT含量均呈先升高后下降的趋势,至恢复期结束时(r-24 h),高温组ALT活力显著高于其他各组(P<0.05),降温组与低温组基本恢复至对照组水平(P>0.05)(图7)。

图4 温度胁迫对大鳞副泥鳅肝脏LZM活力的影响 Fig.4 Effects of temperature stress on LZM activity of P.dabryanus

图5 温度胁迫对大鳞副泥鳅肝脏AKP活力的影响 Fig.5 Effects of temperature stress on AKP activity of P.dabryanus
3 讨论
3.1 温度胁迫对大鳞副泥鳅肝脏抗氧化指标相关酶活力的影响

图6 温度胁迫对大鳞副泥鳅血清AST含量的影响 Fig.6 Effects of temperature stress on AST content of P.dabryanus

图7 温度胁迫对大鳞副泥鳅肝脏ALT含量的影响 Fig.7 Effects of temperature stress on ALT content of P.dabryanus
应激可以通过细胞色素C氧化酶复合物功能增加肝细胞色素P450产生活性氧自由基的能力(Kato,1977),而过量的自由基会导致肝脏损伤。SOD通过 去除自由基来平衡氧化和抗氧化过程,从而防止细胞损伤;CAT催化H2O2分解为氧和水,阻断高活力羟基自由基反应,并阻止H2O2的毒性细胞效应(van der Oostet al,2003; Gület al,2004)。而作为脂质过氧化的最终产物,MDA浓度是反映体内氧自由基数量的重要指标(Mourenteet al,1999)。研究表明,温度胁迫会对影响鱼类抗氧化系统造成影响。对石斑鱼杂交后代(Epinephelus moara♀ ×Epinephelus lanceolatus♂)的研究发现,低温胁迫会使实验鱼CAT活力呈现波动性变化,导致幼鱼免疫力和抗氧化能力下降(邵彦翔等,2017)。谢明媚等(2015)在银鲳(Pampus argenteus)幼鱼的急性温度胁迫研究中发现,急性温度胁迫会在一定程度上引起实验鱼肝脏的损伤,并对其抗氧化能力和免疫应答反应产生影响。彭婷等(2012)对罗非鱼(Oreochromis niloticus)的低温胁迫研究发现,随着温 度降低,罗非鱼的生化、免疫及抗氧化指标均发生显著变化,由此可能导致罗非鱼在低温胁迫后出现昏迷及死亡等异常状况。潘桂平等(2016)对云纹石斑鱼(Epinephelus moara)幼鱼的研究发现,低温胁迫对云纹石斑鱼幼鱼抗氧化和免疫性能影响显著,低温胁迫导致该鱼体内的MDA含量升高,因而肝脏合成更多 的抗氧化物质来进行抗氧化防御。本研究中,实验鱼肝脏CAT与SOD活力随着温度胁迫的进行与对照组相比呈现出逐渐降低的趋势,至胁迫期结束,各实验组均显著低于对照组,MDA含量在温度胁迫过程中持续升高,至胁迫期结束各实验组均与对照组差异显著,表明在温度骤变的条件下,实验鱼抗氧化酶活力会受到显著抑制,抗氧化能力减弱。而进入恢复期,各实验组CAT与SOD活力均逐渐提高,MDA含量逐渐降低,至恢复期结束时与对照组不存在显著差异,则表明当温度恢复后,本实验温度骤变范围对大鳞副泥鳅肝脏抗氧化酶活力的抑制是可恢复的,可以认为实验条件下的温度骤变不会造成大鳞副泥鳅永久性肝损伤。
3.2 温度胁迫对大鳞副泥鳅肝脏LZM与AKP活力的影响
LZM在鱼类的体液、血清和巨噬细胞中普遍存在,是吞噬细胞杀菌的物质基础,具有溶解细菌作用(殷海成等,2014)。LZM主要针对革兰氏阳性菌,但也影响一些革兰氏阴性菌,如肠道沙门氏菌(Salmonella enteritidis)和嗜水气单胞菌(Aeromonas hydrophila),其具有抗感染、抗肿瘤、抗病毒以及增强抗生素的功能,起到防御病原体的重要作用(Saurabhet al,2008; Junget al,2012)。AKP是一种磷酸单酯水解酶,特异性低,起到解毒剂的作用,它在水中溶解生成乙醇和磷酸,因此,是鱼类生物健康的重要标志(Hoseinifaret al,2015)。研究认为,温度胁迫会对鱼类非特异性免疫机能产生影响。低温胁迫下,河豚(Takifugu obscurus)血浆蛋白和AKP等生化指标显著下降,诱导抗氧化酶、HSP90和C3的基因表达,表明其免疫系统会受到低温胁迫的影响(Chenget al,2017)。对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼的研究表明,温度胁迫下实验鱼血清LZM与AKP活力在实验期内,基本呈先上升后下降的变化趋势,认为温度胁迫显著改变罗非鱼幼鱼的非特异性免疫能力(强俊等,2012)。低温胁迫下,虹鳟(Oncorhynchus mykiss)血清的AKP活力显著降低,并在48 h的恢复期内维持在较低水平,而高温胁迫下,AKP活力相比对照组略有降低(管标等,2014)。本研究中,实验鱼肝脏LZM与AKP活力在胁迫期均受到温度骤变的影响,至胁迫期结束时,各实验组均显著低于对照组,表明温度骤变显著降低肝脏LZM与AKP活力,减弱机体非特异性免疫功能;进入恢复期,高温组LZM与AKP活力基本停留在胁迫结束时的水平,至恢复期结束时仍显著低于对照组,而降温组与低温组LZM与AKP活力则持续升高,至恢复期结束时,基本恢复至对照组水平,表明高温胁迫会对大鳞副泥鳅非特异性免疫机能造成不可逆的破坏,而低温胁迫对大鳞副泥鳅非特异性免疫机能的抑制是可恢复的,实验条件下不会造成永久性破坏。
3.3 温度胁迫对大鳞副泥鳅血清转氨酶的影响
正常情况下,AST和ALT在包括肝脏在内的许多器官中普遍存在,当机体由于应激反应或发生病变时,细胞膜通透性发生变化,在浓度差作用下导致细胞内的AST和ALT释放到血液中,引起血清中的ALT和AST含量升高(孙学亮等,2010)。因此,检测血清中AST和ALT水平的变化,可以反映细胞膜通透性的变化,并判断肝脏等组织是否发生病变(Lemaireet al,1991; Lee,2001)。本研究中,温度胁迫显著升高实验鱼血清的AST与ATL含量表明温度骤变会引起实验鱼细胞膜通透性的变化,肝脏细胞的凋亡速度或数量增加使转氨酶进入血液;进入恢复期,各实验组AST与ALT含量均呈下降趋势,至恢复期结束时,各实验组AST含量基本恢复到对照组水平,而ALT含量上则在降温组与低温组基本恢复至对照组水平,高温组则仍显著高于对照组。高温条件会引起大鳞副泥鳅血液ALT含量升高,造成不可逆的破坏,而低温条件对大鳞副泥鳅血液转氨酶含量的影响是可恢复的,实验条件下不会对机体肝细胞机能造成永久性破坏。
4 结论
在实验条件下,连续12 h的温度胁迫会显著抑制大鳞副泥鳅抗氧化能力与非特异性免疫能力,且在高温条件下对其非特异性免疫相关酶活力造成持续抑制,大鳞副泥鳅对低温条件的耐受能力较强,在实际生产中应避免高温。

