慢病毒干扰YAP表达对肾癌细胞增殖的影响及其机制的探讨
曹建佳 王开翔 黄贵闽 曹贵华 刘光涛 何祥彪
(乐山市人民医院泌尿外科 四川 乐山 614000)
肾癌是泌尿系统最常见的恶性肿瘤之一,每年全世界有超过100,000例患者因此死亡。目前,肾癌的治疗手段很有限,RCC治疗仍靠外科手术,晚期治疗非常棘手。随着基因靶向治疗近年来在临床肿瘤诊断和治疗领域的开展并取得良好应用,因此,本实验将研究方向集中在肾细胞癌的基因靶向治疗。
Yes相关蛋白(Yes-associated protein,YAP) 因与Src蛋白激酶家族中的Yes蛋白的SH3区域结合而命名为Yes-associated protein65(YAP65)[1]。最近研究发现YAP是Hippo通路的关键效应因子,而Hippo通路是调节细胞增殖和凋亡的关键信号通路。TEAD是位于Hippo通路中YAP下游的最主要的转录因子之一,YAP通过与TEAD的相关结构域结合而发挥重要作用[2]。尽管越来越多的研究表明YAP在肿瘤的发展中具有重要作用,但YAP在肾癌中的作用仍不甚清楚,相关研究尚未深入开展。本研究目的旨在通过慢病毒介导的干扰载体沉默YAP基因,探讨沉默YAP后对肾透明细胞癌增殖和凋亡的影响及其可能的机制。
1.资料与方法
1.1 一般资料
ACHN肾癌细胞株购自ATCC;786-O、caki-2肾癌细胞株及HEK-293细胞株由本实验组保存;PRMI 1640、DMEM培养基购自Hyclone公司;胎牛血清FBS购自杭州四季青公司及Hyclone公司;引物由华大基因公司构建并检测;Total RNA提取试剂、逆转录试剂盒、TaqDNA 聚合酶及Marker购自大连宝生物工程有限公司(Takara);YAP兔抗人多克隆抗体购自美国Santa Cruz生物技术公司,TEAD1抗体购自美国Proteintech Group生物技术有限公司.;CCK-8细胞计数试剂盒购自美国Sigma公司。
1.2 方法
1.2.1 细胞培养 肾透明癌细胞系786-O、caki-2、ACHN以含有10%胎牛血清的RPMI-1640培养液,HEK-293细胞株以含有10%胎牛血清的DMEM培养液,于37℃、5%C02孵育箱中培养,待细胞密度长至80%~90%时,用0.125%胰酶将贴壁生长的细胞消化传代培养。
1.2.2 慢病毒干扰载体的设计合成及肾癌细胞的转染 3条YAP-shRNA和一条阴性对照shRNA (negative control shRNA,NC-sh RNA) 慢病毒重组质粒载体[均含绿色荧光蛋白(green fluorescence protein,GFP ]由上海生博生物医药科技有限公司合成。根据我们实验组前期的研究基础,慢病毒在肾癌细胞的转染效率上,最佳感染复数 ( Multiplicity of infection,MOI)为20,ShYAP-3慢病毒干扰载体抑制效率最高。
1.2.3 RT-PCR检测细胞中mRNA的表达 收集实验所培养的各组细胞,根据Trizol试剂盒说明书提取各组细胞中的总RNA,总RNA的质量由紫外线分光光度仪检测。取1 µg总RNA逆转录为cDNA,并进行PCR扩增YAP和TEAD1基因,GAPDH作为内参基因。PCR反应条件:95℃预变性5 min,95℃变性30s,56℃退火30s,72℃延伸30s,共30个循环后,72℃终末延伸5 min。PCR产物于2.5%琼脂糖凝胶电泳,电泳后放置于凝胶成像仪紫外光下观察并拍照。Quantity One软件照相并对相应条带定量做分析。
1.2.4 Western-blot检测细胞中蛋白的表达 使用RIPA裂解液提取各组所需要细胞中的总蛋白。按照BCA法测定蛋白浓度及上样时每孔应加入蛋白体积。经10%聚丙烯酰胺凝胶(SDS-PAGE)80V电压下分离,250mA恒流将凝胶上的蛋白转移到0.45µm PVDF膜上,5%脱脂奶粉配制成封闭液37 ℃封闭已经电转好PVDF膜2 h。根据不同膜分别加入兔抗人YAP一抗(1:200),TEAD1一抗(1:200)及内参β-actin抗体(1:1000)过夜后,最后经TBST充分漂洗后于PVDF膜上,ECL化学发光显影,Bio-Rad凝胶成像仪软件对各组细胞Western-blot结果做出分析。
1.2.5 CCK-8检测细胞增殖能力的改变 将处于对数生长期的786-O细胞制备成单细胞悬液,以每孔5x103/个细胞接种到96孔细胞培养板中。37℃,5% CO2培养箱中孵育12小时,将细胞分为空白对照组、阴性对照组及实验组3组,阴性对照组及实验组分别转染NC-shRNA及shYAP-3 慢病毒载体。每组设6个复孔,将96孔板置于37℃,5% CO2培养箱中分别培养48,96,144小时,然后将10ulCCK-8试剂和90ul含有10%胎牛血清的RPMI-1640培养液混合均匀后加入到各孔,CO2培养箱,37℃继续孵育1小时,用酶标仪检测各组细胞在450nm处吸光度。
1.3 统计学方法
数据采用SPSS19.0统计软件进行统计分析,计数资料采用率(%)表示,进行χ2检验,计量资料采用(±s)表示,进行t检验,P<0.05为差异具有统计学意义。
2.结果
2.1 YAP在4种细胞中的表达
RT-PCR和Western blot法分别检测YAP基因在786-O、caki-2、ACHN 三种肾癌细胞系及人胚肾细胞HEK-293细胞中表达情况。RT-PCR检测结果显示:YAP mRNA的表达在肾透明癌细胞系786-O、caki-2、ACHN中较HEK-293细胞中明显增高;Western blot法检测结果显示YAP蛋白在肾透明癌细胞系786-O、caki-2、ACHN中的表达水平明显高于人胚肾细胞HEK-293细胞,见表1。
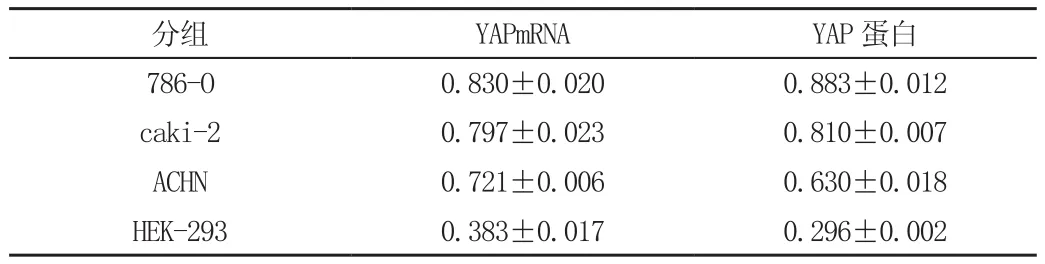
表1 YAP在4种细胞中的表达
2.2 shRNA慢病毒转染786-O细胞后YAP的表达
ShYAP-1、ShYAP-2和ShYAP-3组YAP mRNA表达水平分别为0.297±0.023、0.437±0.025、0.273±0.006,与阴性对照组(0.830±0.020)相比YAP mRNA表达水平明显降低 (P<0.05),其抑制效率分别为64.3%、47.4%、67.1%。ShYAP-1、ShYAP-2和ShYAP-3组YAP蛋白表达量分别为0.323±0.006、0.357±0.021、0.193±0.015,较阴性对照组(0.883±0.012)有明显减弱(P<0.05),蛋白表达抑制效率分别为63.4%、59.6%、78.1%。,结果表明3个实验组shRNA慢病毒干扰载体有效抑制了YAP蛋白表达,其中ShYAP-3慢病毒干扰载体抑制效率最高。
2.3 转染ShYAP-3慢病毒后TEAD1表达受到抑制
ShYAP-3组TEAD1 mRNA表达水平为0.620±0.036,与阴性对照组(0.923±0.006)相比ShYAP-3转染组TEAD1 mRNA表达水平明显降低 (P<0.05)。ShYAP-3组TEAD1蛋白表达量为0.530±0.062,较阴性对照组(0.873±0.032)有明显减弱(P<0.05),实验结果表明转染组ShYAP-3慢病毒干扰载体抑制YAP蛋白表达后,对下游转录因子TEAD1表达产生了明显抑制效应。
2.4 转染后786-O细胞的增殖变化
将最佳转染沉默效果的ShYAP-3慢病毒干扰载体,NC—shRNA转染786-O细胞96小时后细胞重悬制备为5×103/ml的单细胞悬液,ShYAP-3组786-0细胞在培养48h、96h、144h后,细胞吸光度值较对照组明显减小(P<0.05)。这表明ShYAP-3组细胞生长较对照组细胞生长速度减慢,并且病毒感染144h后这种生长抑制持续存在,进一步说明shRNA干扰慢病毒抑制YAP在肾癌786-0细胞表达后,有效抑制细胞增殖,见表2。
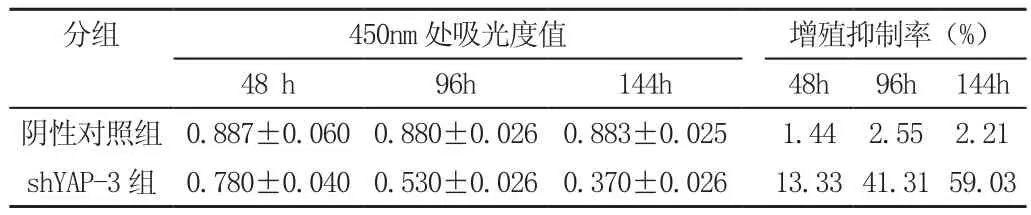
表2 各组细胞的吸光度值和增殖抑制率
3.讨论
Hippo-YAP信号通路最初于果蝇中发现,调控细胞生长、增殖及器官大小的发育。在哺乳动物体内,Hippo-YAP信号通路包括Mst1/2、SAV1、LATS1/2、YAP、TAZ和TEAD等。TEAD是位于YAP下游的转录因子,YAP通过与TEAD相互结合发挥作用。人类YAP基因位于染色体11q22上,蛋白则广泛表达于机体各组织中。Hippo-YAP信号通路中YAP一旦激活,可导致下游转录因子和调节因子表达量增加,进而发挥促进细胞增殖和抑制细胞凋亡的作用。
在众多的Hippo通路的下游转录调节因子中,TEAD是目前研究较多且较深入的。由于YAP不具有直接调控转录的功能,YAP能够与Hippo通路下游转录因子相结合,而转录因子TEADl具有抑制某些基因转录的功能。TEAD在前列腺癌、卡波济肉瘤,基底细胞型乳腺癌中发现高表达[3]。研究显示抑制YAP的活性可以通过阻碍YAP-TEAD结合的方式降低TEAD的转录活性。最近有研究证实通过基因靶向药物干扰YAP-TEAD的结合,都可有效抑制YAP的致癌作用[4]。
本实验研究肾癌细胞中YAP的表达情况。研究证实,同对照细胞HEK-293 相比,YAP基因在肾癌细胞系中高度表达,这提示YAP在肾癌的发病机制中可能扮演的是癌基因的角色。这与YAP在肺癌,肝癌,卵巢癌中的表达情况相似。接下来继续研究YAP在肾癌细胞中的作用并探讨其作用机制。本实验前期构建了3条带有目的RNAi 序列的慢病毒pLV-GFP,利用慢病毒载体高效的转染效率及长期稳定表达的特点[5],将带有特异性沉默YAP的RNAi 序列慢病毒载体转染进入786-O细胞,用RT-PCR及Western blot法检测慢病毒沉默YAP前后肾癌786-O细胞中YAP、TEAD1表达情况,YAP 和TEAD1 mRNA及蛋白的表达明显降低。通过CCK-8法对转染ShYAP-3慢病毒干扰载体细胞不同时间段细胞吸光度值检测,证实shRNA慢病毒干扰载体沉默YAP后能有效抑制786-0细胞增殖。
本结果提示YAP基因沉默可能阻止YAP和TEAD1的结合,该反应抑制了TEAD1的表达并影响其转录活性,导致下游细胞生长调节因子失活,最终导致肾癌细胞增殖抑制,但其详尽的分子机制有待进一步研究。

