犬细小病毒病实验室诊断方法建立与分析
张 磊,张爱国,连辉霞,李四豪
(1.河南牧业经济学院,河南 郑州 450011; 2.漯河市郾城区畜牧局,河南 漯河 462000;3.郑州小俏皮宠物医院,河南 郑州 450011)
犬细小感染是由犬细小病毒引起的一种急性、热性、传染性烈性疾病,临床上以严重急性肠炎综合征和非化脓性心肌炎综合征为特征,是一类仅次于犬瘟热的一种传染病。20世纪70年代末发现的一种由犬细小病毒引起的出血性肠道传染病,对犬危害极大[1]。1977年,美国学者Eugster和Nairn最先从患有出血性肠炎的病犬粪便中分离到该病毒颗粒,随后加拿大、澳大利亚、法国等均有犬细小病毒病感染的报道[2]。1982年,梁士哲等[3]最早报道了类似CPV-2所致的犬出血性肠炎。1983年,徐汗坤等[4]正式报道了本病的发生,其主要特征是肠炎型先呕吐后拉稀,继而拉血便,气味腥臭难闻,心肌炎型突发心力衰竭,呼吸困难,血液学检查白细胞显著低于正常范围,犬细小病毒以其传播范围广、传染性强、感染率高、死亡率高等特点,成为犬行业中最严重的传染病之一。
1 试验材料和方法
1.1 样本的采集
2017年12月-2018年5月,从郑州小俏皮宠物医院收集40例疑似犬细小病毒病例病料、犬瘟热病毒阳性病料、犬冠状病毒阳性病料、犬副流感病毒阳性病料等,患犬年龄从20天到5岁不等,收集后冷藏保存。
1.2 试剂及仪器设备
犬细小病毒抗原快速检测试剂盒(北京林特睿检有限公司),犬细小病毒抗原荧光免疫定量分析仪(RS-6600型)(江苏雷森生物科技有限公司),犬细小病毒抗原(CPV-Ag)(江苏雷森生物科技有限公司),PCR仪(力康生物医疗科技控股有限公司),DNA提取试剂盒、平衡缓冲液BL、裂解缓冲液、洗液W1、洗液W2、DNA洗脱液、2×PCR Taq mix DNA Marker酶(均购置宝生物工程大连有限公司),超微量紫外分光光度计(上海美普达仪器有限公司)。
1.3 引物设计与合成
根据GenBank中发表的犬细小病毒基因序列,采用序列分析软件进行分析,CPV-b株型设计引物如下:上游:5’-CAGCAAGCCAAGCAATC-3’,下游:5’-GCGGCGTCAGAAGGGTTA-3’,引物有北京华大基因研究中心合成。
1.4 粪便样品的采集与处理
本试验所用的样品均是在郑州宠物医院收集,收集那些临床症状出现高热、呕吐、拉血便的患犬粪便,并通过CPV抗原检测试剂盒检测,结果显示为弱阳性或强阳性的10份样品,样品经沉淀处理后吸取上清液,冷藏保存。
1.5 病毒DNA提取
1.5.1样品处理
吸取0.5mL的粪便样品上清液,转入到新的1.5mL离心管,5000rpm离心1~2min,弃上清。接着向1.5mL离心管的沉淀中加入1mL匀浆缓冲液,轻微吹打混匀后,5000rpm离心1~2min,弃上清。
1.5.2DNA分离
向沉淀中加入400μL裂解缓冲液,轻轻的上下颠倒混匀6~8次,室温静置5min,5000rpm离心2min,将上清全部转入吸附柱,室温静置2min,12000rpm离心45s,离心完成后倒掉收集管废液,向柱中加入500μL洗液W1,12000rpm离心45s,倒掉收集管废液,12000rpm离心2min,打开收集管盖室温静置10min,将吸附柱放入一个干净的1.5mL离心管中,向吸附膜的中间部位滴加50μL-100μL DNA洗脱液,室温放置5min,12000rpm离心1min,反复2次,保留收集管,冷藏保存。
1.6 PCR产物扩增及鉴定
PCR反应混合液总体积20μL:2×Taq PCR10μL,上下引物各1μL,模板DNA2μL,ddH2O6μL。反应条件:95℃预变性5min,98℃变性10s,55℃退火30s,72℃延伸1min,30个循环,4℃保存。反应结束后,吸取扩增产物用1%琼脂糖凝胶电泳,观察并记录结果。
2 实验结果
2.1 犬细小病毒抗原快速检测试纸条结果
2.1.1CPV抗原检测试剂盒的简便、快速试验结果
5~10min可显示结果,该试纸条操作简单,快速判断结果。
2.1.2CPV抗原检测试纸条的敏感性试验
用犬细小病毒抗原检测试纸条,对一个弱阳性CPV(图1)样本稀释到不同浓度进行检测,当检测极限为1:1000时,不再出现阳性结果,但其结果不能得到在1000倍稀释下粪便中含有多少病毒,该CPV抗原检测试纸条只能定性的检测CPV。
2.1.3CPV抗原检测试纸条的特异性试验
从收集的犬瘟热阳性病例样本稀释液通过犬细小病毒抗原试纸条进行检测,结果显示为阴性。同样的试验用犬冠状病毒阳性病料,犬副流感病毒阳性稀释液进行试纸条检测,也是同样的结果,分析结果得出两种不同抗原不具有相同部分或抗原表位,说明CPV试纸条特异性高。
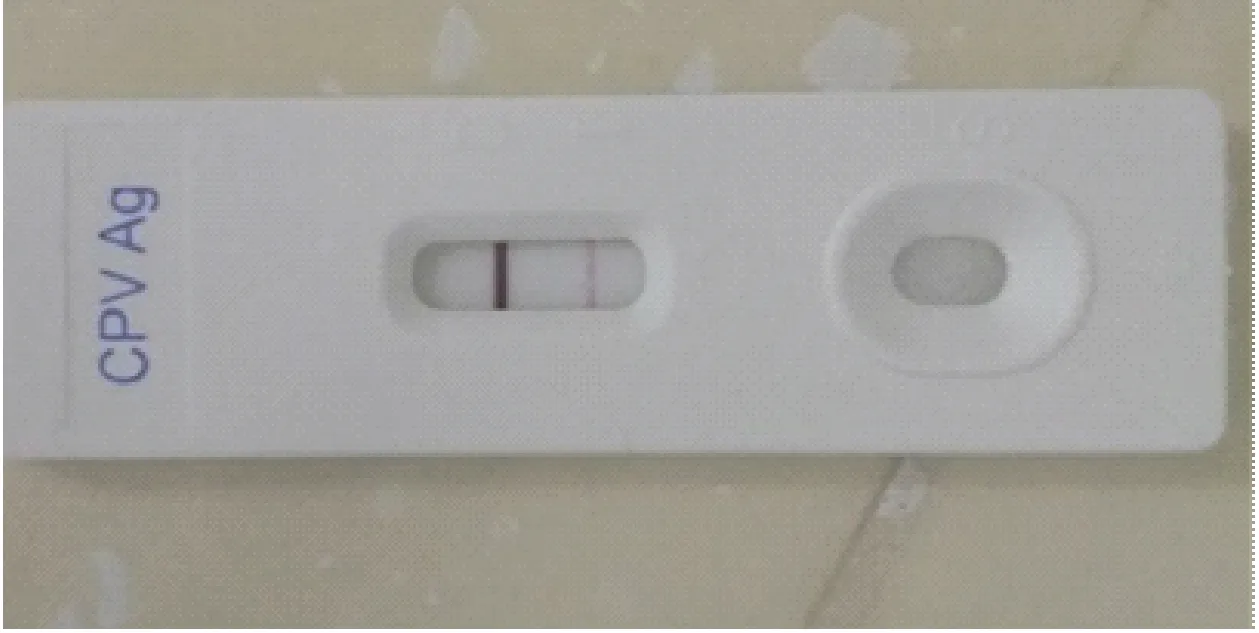
图1 试纸条检测CPV为弱阳性样本
2.1.4犬细小病毒抗原检测试剂盒假阳性或假阴性
假阳性试验:根据犬细小病毒抗原检测试剂盒操作说明书进行,对收集的40份临床粪便样本进行检测,CPV阳性率为82.5%,将同样的40份粪便样本离心沉淀后吸取上清液进行检查,阳性率为75%。结果表明,粪便沉淀处理过后再检测,阳性率降低,说明未处理过的病例样本有些不是阳性,也说明CPV抗原快速检测试纸条存在假阳性,结果如下,见表1。

表1 试纸条假阳性试验
假阴性试验:有些患犬发病正处于潜伏期,经过试纸条检测结果为阴性,可进行PCR检测。取40份经试纸条检测离心沉淀处理后的10例为阴性的样本,进行PCR试验。结果所示(表2),10例阴性样本中,经PCR检测存在1例阳性,阳性率10%,可试纸条在一些条件下存在假阴性,PCR方法检出1例阳性,说明PCR优于犬细小病毒抗原试纸条,PCR敏感性是高于犬细小病毒抗原检测试纸条。
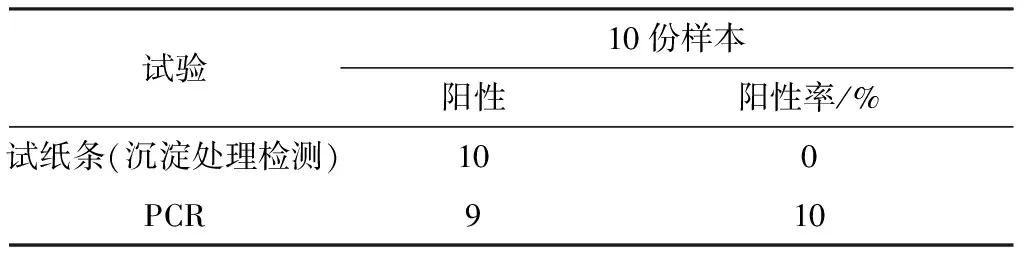
表2 试纸条与PCR试验比较
2.2 犬细小病毒抗原荧光免疫定量分析仪检测结果
2.2.1 犬细小病毒抗原荧光免疫定量分析仪敏感性试验
用犬细小病毒抗原荧光定量分析仪对一个弱阳性样本粪便按照1:10稀释至不同浓度进行检测,样本稀释至1000倍时,CPV试纸条检测不再出现阳性,进行犬细小病毒抗原荧光免疫定量分析,结果检测出病毒含量为15.08AU(图2)。
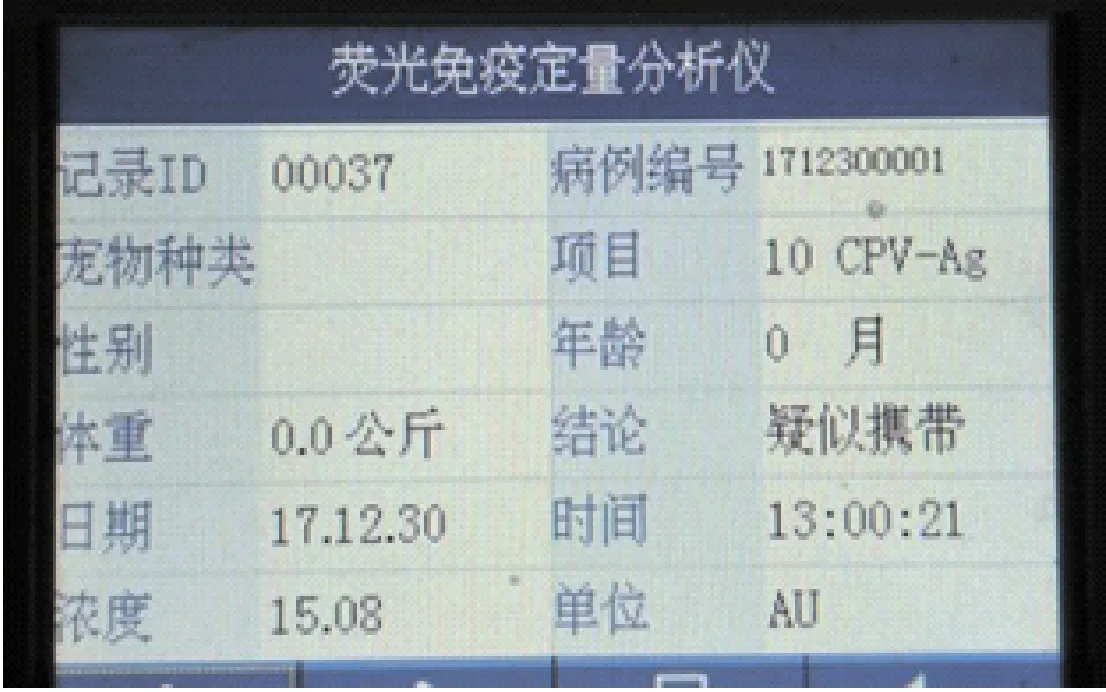
图2 CPV-Ag荧光免疫分析仪敏感性试验
2.2.2 犬细小病毒抗原荧光免疫定量分析仪检测CPV结果

表3 犬细小病毒抗原荧光免疫定量检测40例样本
2.2.3 犬细小病毒抗原荧光免疫定量分析仪特异性试验
从收集的犬瘟热阳性病例样本稀释液、犬冠状病毒阳性病料、犬副流感阳性稀释液进行犬细小病毒荧光定量检测,结果显示无交叉反应。
2.3 PCR试验结果
2.3.1 PCR特异性检测
用从收集的临床病例样本1-犬细小病毒,样本2-犬细小病毒,样本3-犬瘟热病毒,样本4-犬冠状病毒,样本5-水作为阴性对照,由图3可见样本1,样本2能够扩增出特异性片段,样本3,4,5没有任何条带,说明PCR检测细小病毒具有特异性。

图3 PCR特异性试验结果注:M,Marker;1,CPV;2,CPV;3,CDV;4,CCV;5,水
2.3.2 PCR灵敏性检测
按照以上操作方法将提取的一例弱阳性患犬细小病毒DNA进行试验,通过仪器检测可检测出大约15.7 ng/uL的病毒DNA(如图4),结果表明,将粪便样品上清液稀释104倍以后仍能扩增出CPV 特异性基因片段。
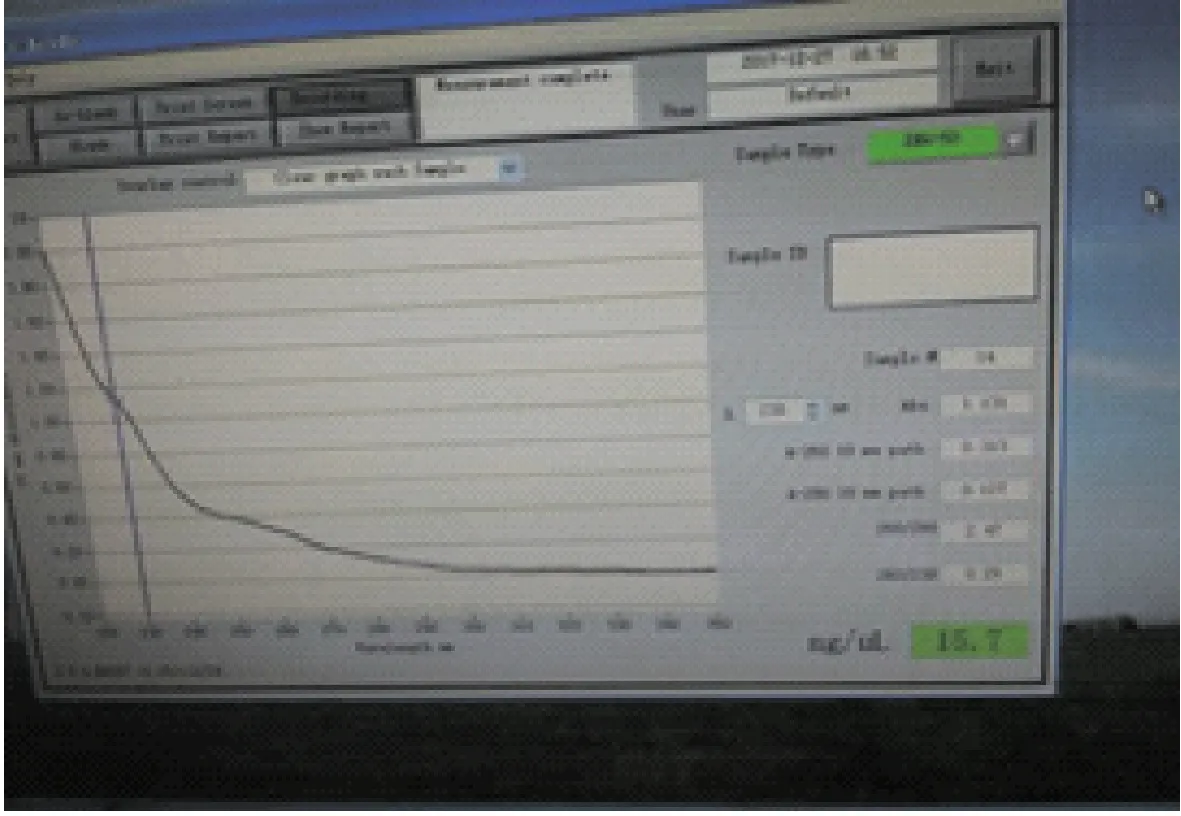
图4 超微量紫外分光光度计检测结果
2.3.3 PCR重复性检测
将收集的10份阳性患犬细小病毒的粪便样本按照以上操作方法进行操作,重复三次,并对这三次结果进行分析,结果表明,均得到相同的结果,说明该方法重复性好。
2.4 犬细小病毒抗原快速检测试纸条与PCR比较
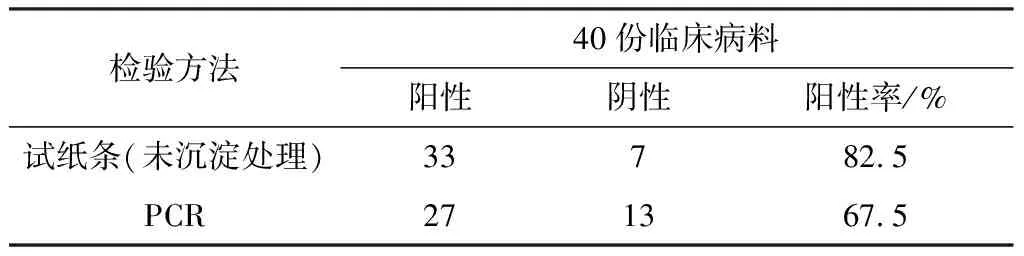
表4 CPV与PCR试验比较
由表4可知,PCR阳性率低于试纸条,对此结果存在一些问题,再进行临床治疗效果对比试验,对40个犬细小病毒抗原诊断试剂盒诊断为阳性的病例临床效果进行跟踪调查,结果如表5所示,犬细小病毒抗原试纸条诊断为阳性的病例阳性率为66.3%,PCR诊断出27例阳性,阳性率为56.7%。
2.5 犬细小病毒抗原(CPV-Ag)荧光免疫定量分析仪与PCR 的比较

表5 试纸条与PCR试验比较

表6 CPV-Ag与PCR试验比较
2.6 犬细小病毒抗原快速检测试剂盒与犬细小病毒抗原荧光免疫定量分析仪比较

表7 CPV试纸条与CPV-Ag荧光定量分析仪比较
3 讨论
3.1 犬细小病毒抗原快速检测试剂盒与PCR试验结果的讨论与分析
如表4所示,CPV阳性率高于PCR方法,但根据以往学习的理论知识可知PCR敏感性要高于试纸条。所以对此进行了表5的犬细小病毒病临床治疗效果的跟踪调查,结果显示,试纸条为阳性的病例的阳性率为66.3%,PCR诊断出27例阳性的,其阳性率为56.7%。结果说明,犬细小病毒抗原诊断试纸条检测到的某些弱阳性病例不一定就是犬细小病毒。PCR检测结果准确率是要高于试纸条,由表5证明了试纸条存在假阳性或假阴性,这与粪便样品未沉淀处理有关,未处理粪便中存在一些复杂物质,会干扰试纸条的检测,导致假阳性结果的产生。
3.2 犬细小病毒荧光免疫定量分析仪与PCR 试验结果的讨论与分析
由表6可知,40例样本中,CPV-Ag荧光免疫定量分析仪检测到25例阳性,阳性率为62.5%,PCR方法检测到27例阳性,阳性率67.5%,可知PCR阳性率高于CPV-Ag荧光免疫定量分析仪,准确性高于CPV-Ag荧光免疫定量分析仪,PCR更优于检测犬细小病毒。
3.3 犬细小病毒抗原快速检测试剂盒与犬细小病毒抗原荧光免疫定量分析仪比较
在40例样本中,表7中CPV试纸条检测33例阳性,阳性率为82.5%,CPV-Ag荧光定量分析仪检测25例阳性,阳性率为62.5%,结果显示,CPV-Ag荧光免疫定量分析仪阳性率低于CPV试纸条,说明CPV试纸条是定性检测犬细小病毒,存在假阳性,而CPV-Ag荧光免疫分析仪是定量检测。在临床中经犬细小病毒抗原快速检测试剂盒检测两次都为阴性,最后经犬细小病毒抗原荧光免疫定量分析仪检测显示为弱阳性,可知其敏感性高于犬细小病毒抗原快速检测试剂盒。
4 结论
犬细小病毒抗原快速检测试剂盒存在假阳性或假阴性,而且只能定性检测犬细小病毒,但操作简单,时间短,结果显而易见,且成本不高。犬细小病毒抗原荧光免疫检测分析仪能在15 min定量检测犬粪便中细小病毒具体含量,且敏感性高于犬细小病毒抗原试纸条,但成本稍高。在犬细小病毒抗原性速检测试剂盒和犬细小病毒抗原荧光免疫定量分析仪检测不出时,PCR具有更高的敏感性,而且感染早期就能实现病毒的快速检测,但它需要昂贵的设备,而且反应时间长。临床检测中,可以根据需要将三种试验方法进行结合,更利于诊断的准确性。

