SBHFRT和CFRT技术对NSCLC组织中淋巴细胞和细胞因子的影响*
岳宏程,熊良庚,张建文,林盛,傅少志,刘伟,彭红菊
(1.西南医科大学附属医院 肿瘤科,四川 泸州 646000;2.重庆市巴南区人民医院 肿瘤科,重庆401320;3.西南医科大学附属医院 核医学与分子影像四川省重点实验室,四川 泸州 646000)
肺癌是我国发病率和死亡率最高的肿瘤,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)≥80%[1]。放疗是NSCLC主要治疗措施之一,合适的放疗模式可增加肿瘤组织中抗肿瘤淋巴细胞表达和细胞因子含量,增强抗肿瘤作用[2-3]。而单次近距离大分割放疗(single brachytherapy hypofractionated radiotherapy, SBHFRT)是否增强肿瘤组织中抗肿瘤淋巴细胞表达和细胞因子含量,目前少有报道。本研究探讨SBHFRT和常规放疗(conventional fractionation radiotherapy, CFRT)对NSCLC肿瘤组织中淋巴细胞表达和细胞因子含量的影响,为NSCLC放疗方案的制定和联合免疫治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 荷瘤小鼠模型复制 取对数生长的Lewis细胞株(西南医科大学附属医院肿瘤科)接种于4、5周龄,体重16~22 g健康C57BL/16雌性小鼠(重庆腾鑫华阜生物科技公司,合格证编号:11401300024918,SPF级饲养)右后肢根部皮下。观察记录小鼠一般状态、体重、成瘤情况及瘤体积变化。待移植瘤直径达8~10 mm时,分成对照组、CFRT组、SBHFRT组进行实验,每组12只小鼠。其中6只用于观察肿瘤体积和代谢情况,其余6只用于淋巴细胞和细胞因子的检测。
1.1.2 主要实验仪器与设备 直线加速器(瑞典Elekta有限公司),石蜡切片机(德国莱卡仪器有限公司),新型BGZ系列Ⅱ型高精度烤箱(上海博讯实业有限公司),移液器(德国艾本德公司),倒置相差显微镜(日本奥林巴斯公司),Oncentra brachy TPS近距离治疗计划系统、Ir192三维后装近距离治疗机购自荷兰Nucletron Netherlands公司。
1.2 方法
1.2.1 主要实验试剂 DMEM高糖培养液(美国HyClone公司),胎牛血清(美国Gibco公司),抗小鼠CD4、CD8、Foxp3单克隆抗体(美国Bio-world公司),白细胞介素10(Interleukin-10, IL-10)、白细胞介素12(Interleukin-12, IL-12)及γ干扰素(Interferon-γ,INF-γ)检测试剂盒购自北京安迪华泰生物科技有限公司。
1.2.2 实验分组 ①CFRT组:Dt=20 Gy/10 d,放射源为6 MV X射线,源皮距100 cm,从接种后第19天开始放疗,连续放疗5 d后间隔2 d再连续放疗5 d,接种后第30天放疗结束;②SBHFRT组:于接种后第30天开始放疗,沿肿瘤长轴方向植入施源器(依肿瘤大小植入1或2根),行模拟定位CT扫描,在Oncentra brachy TPS勾画大体肿瘤靶区,设计和实施放疗计划(Dt=11.3 Gy/1F,D95%≥10 Gy),只放疗1 d。按L-Q模型计算生物等效剂量(biological equralent dose, BED)( 肿 瘤 α/β=10),CFRT组 BED=24 Gy,SBHFRT组BED=24.07 Gy,两者BED基本相同。
1.2.3 CD4+、CD8+及Foxp3+T淋巴细胞表达检测放疗结束后第14天,每组处死6只小鼠,完整剥离肿瘤,切取部分肿瘤用于酶联免疫吸附(ELISA)检测,其余肿瘤组织采用免疫组织化学SP法检测肿瘤组织中CD4+、CD8+及Foxp3+T淋巴细胞表达,由2位经验丰富的病理科医生分别独立对实验结果进行双盲法评估。CD4+、CD8+及Foxp3+T淋巴细胞表达判断标准:CD4+、CD8+T淋巴细胞染色为细胞质或细胞膜呈棕黄色或褐色,Foxp3+T淋巴细胞染色为细胞核呈棕黄色或褐色。CD4+、CD8+及Foxp3+T淋巴细胞数计算方法:每张切片选5个视野,显微镜(400倍)下计数每个视野阳性淋巴细胞数,计算5个视野阳性淋巴细胞数平均值即为该切片阳性淋巴细胞数。
1.2.4 IL-10、IL-12及INF-γ含量检测 采用ELISA法检测肿瘤组织中IL-10、IL-12及INF-γ含量。具体操作:将肿瘤组织磨碎取上清液,用洗液清洗酶孔板,每孔加样本稀释液和检测缓冲液,加等量样本,加检测抗体(1∶100),封板震荡,室温孵育2 h,洗板,加HRP标记的链霉亲和素(1∶100),封板震荡,室温孵育45 min,洗板,TMB显色,避光室温孵育30 min,加终止液。调节酶标仪波长为450 nm测定吸光度值。依据标准曲线计算各样本IL-10、IL-12及INF-γ的含量。
1.2.5 肿瘤体积的测量和生长抑制率(tumor growth inhibition rate, TGIR)的计算 各组从肿瘤接种后第12天开始,每隔2 d测量各组移植瘤最大直径(a)与最小直径(b),肿瘤体积(V):V=a×b2/2。放疗后第14天计算各治疗组TGIR。TGIR=(V对照组-V实验组)/V对照组×100%。
1.2.6 肿瘤代谢活性检测 放疗结束后第14天,每组选6只小鼠分别行18F-FDG micro PET/CT扫描。18F-FDG micro PET-CT扫描参数:80 kV;500μA;层距1.5 mm。扫描图像由2位经验丰富的核医学科医师对18F-FDG PET/CT图像进行分析,计算肿瘤组织SUV。SUV值高低反映肿瘤代谢活性,即肿瘤SUV值越小表示肿瘤代谢活性越低。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件。计量资料以均数±标准差(±s)表示,多组比较用单因素方差分析,两两比较用LSD-t检验;计数资料以率(%)表示,比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组CD4+、CD8+及Foxp3+ T淋巴细胞表达水平比较
3组CD4+、CD8+及Foxp3+T淋巴细胞表达水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较,SBHFRT组CD4+、CD8+T淋巴细胞表达高于CFRT组和对照组,而Foxp3+T淋巴细胞表达低于CFRT组和对照组(P<0.05)。见表1和图1。
表1 3组CD4+、CD8+及Foxp3+ T淋巴细胞表达水平比较 (n =6,个,±s)
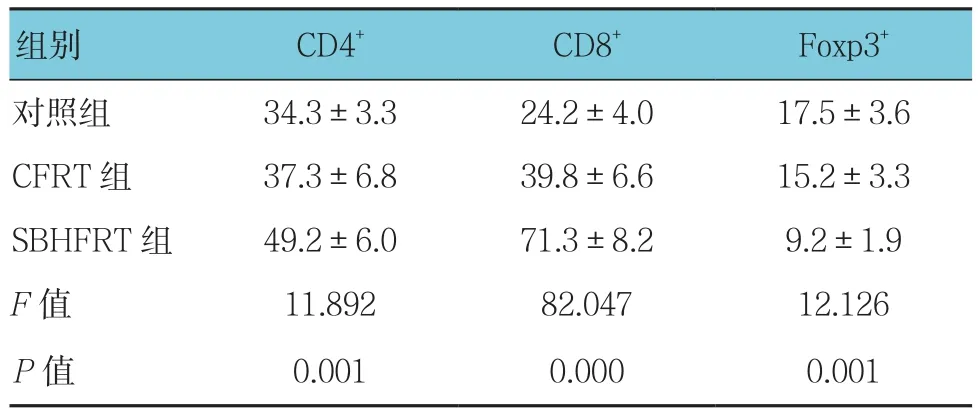
表1 3组CD4+、CD8+及Foxp3+ T淋巴细胞表达水平比较 (n =6,个,±s)
组别 CD4+ CD8+ Foxp3+对照组 34.3±3.3 24.2±4.0 17.5±3.6 CFRT 组 37.3±6.8 39.8±6.6 15.2±3.3 SBHFRT 组 49.2±6.0 71.3±8.2 9.2±1.9 F值 11.892 82.047 12.126 P值 0.001 0.000 0.001

图1 3组CD4+、CD8+及Foxp3+ T淋巴细胞的表达 (SP×400)
2.2 3组IL-10、IL-12及INF-γ含量比较
3组IL-10、IL-12及INF-γ含量比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较,SBHFRT组IL-12和INF-γ含量高于CFRT组和对照组(P<0.05);而IL-10含量低于CFRT组和对照组(P<0.05)。见表2。
2.3 3组肿瘤体积、肿瘤SUV值比较
3组肿瘤体积、肿瘤SUV值比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较,SBHFRT组肿瘤体积、肿瘤SUV值低于CFRT组和对照组(P<0.05)。见表3和图2。
2.4 SBHFRT组和CFRT组TGIR比较
SBHFRT组、CFRT组TGIR分别为(37.0±2.5)%和(19.2±3.2)%。两组TGIR比较,经t检验,差异有统计学意义(t=10.701,P=0.000);SBHFRT组TGIR高于CFRT组。
表2 3组IL-10、IL-12及INF-γ含量比较(n =6,pg/ml,±s)
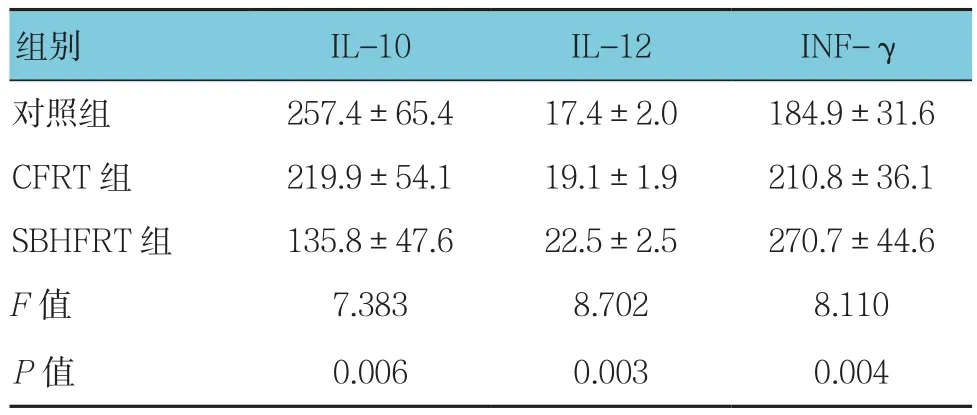
表2 3组IL-10、IL-12及INF-γ含量比较(n =6,pg/ml,±s)
组别 IL-10 IL-12 INF-γ对照组 257.4±65.4 17.4±2.0 184.9±31.6 CFRT 组 219.9±54.1 19.1±1.9 210.8±36.1 SBHFRT 组 135.8±47.6 22.5±2.5 270.7±44.6 F值 7.383 8.702 8.110 P值 0.006 0.003 0.004
表3 3组肿瘤体积、肿瘤SUV值比较 (n =6,±s)
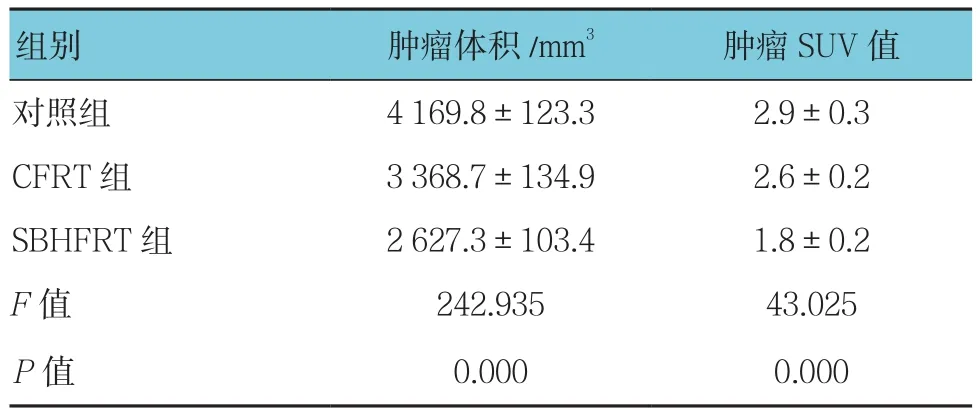
表3 3组肿瘤体积、肿瘤SUV值比较 (n =6,±s)
组别 肿瘤体积/mm3 肿瘤SUV值对照组 4 169.8±123.3 2.9±0.3 CFRT 组 3 368.7±134.9 2.6±0.2 SBHFRT组 2 627.3±103.4 1.8±0.2 F值 242.935 43.025 P值 0.000 0.000

图2 3组18F-FDG micro PET-CT扫描图
3 讨论
以立体定向放疗(stereotactic body radiotherapy,SBRT)为代表的大分割放疗能提高cT3和cT4N0M0期NSCLC患者的2年总生存率(overall survival, OS)和局部控制率[4]。NSCLC行SBHFRT放疗研究较少,缺乏基础性研究。对临床NSCLC原发灶行SBHFRT联合纵隔转移淋巴结调强放疗研究发现,其有效率、2年OS分别为92.3%和67%,中位生存期22.5个月[5]。上述结果表明,SBHFRT与SBRT能有效提高NSCLC治疗的有效率和患者生存期。
肿瘤微环境的组成和作用十分复杂[6-7],对抗肿瘤免疫有抑制作用[8-10]。研究表明,放疗可改变肿瘤微环境中淋巴细胞和细胞因子的组成,增强抗肿瘤免疫反应[11-13]。NSCLC肿瘤组织中CD4+、CD8+及Foxp3+T淋巴细胞表达与放疗生存期密切相关,肿瘤组织中CD4+、CD8+T淋巴细胞高表达,中位生存期和3年生存率均高于低表达和无表达;而Foxp3+T淋巴细胞低表达中位生存期和3年生存率均高于高表达[14-15]。上述研究表明,增加肿瘤组织中CD4+、CD8+T淋巴细胞表达,降低Foxp3+T淋巴细胞表达,可提高肿瘤患者生存期和生存率。本研究结果提示,NSCLC行SBHFRT治疗相对于CFRT治疗,能有效聚集抗肿瘤淋巴细胞的能力,和其他学者报道类似[15-17]。
细胞因子在抗肿瘤免疫反应中发挥重要的作用,IL-12能诱导IFN-γ的产生,后者可刺激CD8+T淋巴细胞增值和活化,在抗肿瘤免疫反应中发挥正向调节作用[18]。IL-10由肿瘤细胞分泌的一种免疫抑制因子,其不仅可抑制肿瘤细胞凋亡,还有对抗FIN-γ作用,抑制抗肿瘤免疫反应[19]。本研究表明,SBHFRT较CFRT可增加肿瘤组织中IL-12和INF-γ含量,降低IL-10含量,更利于促进淋巴细胞增殖和肿瘤细胞凋亡,增强放射线作用。
肿瘤SUV值对肿瘤代谢情况及预后评估具有重要指导意义[20]。本研究通过PET-CT检测各组肿瘤SUV值显示,放疗后SBHFRT组肿瘤代谢低于CFRT组和对照组;同时本研究显示,SBHFRT在控制肿瘤体积和TGIR方面优于CFRT组,其机制可能与SBHFRT增加肿瘤组织中CD4+、CD8+T淋巴细胞浸润和IL-12、INF-γ含量,从而增强抗肿瘤作用有关。
综上所述,SBHFRT比CFRT更能促进肺癌肿瘤组织中抗肿瘤淋巴细胞浸润,以及增加具有肿瘤杀伤作用的细胞因子IL-12和INF-γ含量,更有利于增强放疗效应。但SBHFRT促进肿瘤组织中上述物质增加的最佳放疗分割剂量,有待进一步研究。

