Box-Behnken响应面法优化健脾祛湿丸醇提工艺
依孜提·帕力哈提 张刚 王萍

摘要:目的 采用Box-Behnken响应面法优化健脾祛湿丸的醇提工艺。方法 以盐酸小檗碱、苦参碱含量及浸膏得率的综合评分为指标,在单因素试验基础上,采用Box-Behnken响应面法考察乙醇浓度、加醇倍量和提取时间对健脾祛湿丸醇提工艺的影响。结果 最佳提取工艺为:加10倍量60%乙醇,回流提取3次,每次2 h。结论 本试验优选的醇提工艺稳定、可行,为工业大生产奠定了基础。
关键词:健脾祛湿丸;醇提工艺;盐酸小檗碱;苦参碱;Box-Behnken响应面法
中图分类号:R283.5 文献标识码:A 文章编号:1005-5304(2019)02-0084-05
DOI:10.3969/j.issn.1005-5304.2019.02.018
开放科学(资源服务)标识码(OSID):
Abstract: Objective To optimize the ethanol extraction process of Jianpi Qushi concentrated pills by using Box-Behnken response surface method. Methods On the basis of single factor test, taking the comprehensive scores of content of berberine hydrochloride and matrine and extract yield as indicators, the effects of ethanol concentration, alcohol addition and extraction time on alcohol extraction process were examined by Box-Behnken response surface method. Results The optimal extraction process was adding 10 times amount of 60% ethanol, reflux extracting 3 times and 2 hours each time. Conclusion The optimized ethanol extraction process is stable and predictable, which can lay foundation for industrial production of Jianpi Qushi concentrated pills.
Keywords: Jianpi Qushi concentrated pills; ethanol extraction process; berberine hydrochloride; matrine; Box-Behnken response surface method
健脾祛湿丸处方来源于新疆医科大学附属中医医院皮肤科刘红霞教授多年临床实践的经验方,由黄柏、苦参、白术、土茯苓等药组成,具有健脾祛湿、润燥止痒功效,临床用于脾虚湿盛所致的白疕(寻常型银屑病)静止期及慢性湿疹,证见皮疹斑块色淡、肥厚浸润,难以消退,反复发作,伴有面色不华,舌质淡胖。黄柏苦寒,泻火解毒、清热燥湿,其主要活性成分为盐酸小檗碱,含量达1.4%~5.8%,药理作用为抗炎、抗菌、免疫抑制、抗溃疡等,其抗炎作用主要通过下调炎症介质的mRNA表达来实现[1-5]。苦参具有清热解毒、利湿止痒功效。苦参碱为苦参的主要活性成分,具有抗炎、抗过敏、抗病毒、抗纤维化和免疫抑制等多方面药理活性,可用于瘙痒性、炎症性、免疫性等皮肤疾病的治疗[6-10]。健脾祛湿丸原以散剂形式作为医院制剂在临床应用多年,使用不便,患者依从性较差,浓缩丸剂在保持散剂疗效的同时能克服以上缺点,并可提高药物稳定性,减少刺激性,遮盖不良口感,方便患者服用。本试验依据处方功能、主治及组方药物的理化性质,运用Box-Behnken响应面法优化健脾祛湿丸的醇提工艺,为该制剂工业大生产奠定基础。
1 仪器与试药
高效液相色谱仪(Waters 2424、Waters 2996),美国Waters;SI-234电子天平(d=0.1 mg),丹佛仪器(北京)有限公司;AGL-135型电子天平(d=0.01 mg),瑞士梅特勒-托利多仪器有限公司;Direct-Q 5型超纯水仪,美国Millipore公司;Dl-820智能超声波清洗器,上海之信仪器有限公司;DLSB-10/20低温冷却液循环泵,郑州长城科工贸有限公司;KDM型调温電热套,山东甄城光明仪器有限公司。
盐酸小檗碱对照品(批号110713-201212,纯度86.7%)、苦参碱对照品(批号110805-200508,纯度99.8%),中国食品药品检定研究院。甲醇、乙腈为色谱纯(Fisher公司),磷酸等其他试剂均为分析纯,超纯水。苦参、黄柏、白术等饮片均购于亳州市中正中药材饮片有限公司,均符合2015年版《中华人民共和国药典》(一部)各药项下规定。
2 方法与结果
2.1 盐酸小檗碱含量测定
2.1.1 色谱条件
采用Symmetry Shield C18柱(4.6 mm×150 mm,5 ?m),流动相为乙腈∶0.1%磷酸溶液(每1000 mL磷酸溶液加十二烷基磺酸钠1.0 g)=45∶55,进样量10 μL,流速1.0 mL/min,柱温30 ℃,检测波长265 nm[11]。
2.1.2 对照品溶液的制备
精密称取适量盐酸小柏碱对照品,加流动相制成浓度为1.02 mg/mL的盐酸小檗碱对照品贮备液。
2.1.3 供试品溶液的制备
称取处方中拟醇提的药物饮片,加10倍量60%乙醇,每次1 h,加热回流提取2次,合并提取液,取上清液1 mL,转移至5 mL容量瓶,加60%乙醇定容至刻度,过滤,取续滤液,即得。
2.1.4 阴性对照溶液的制备
按处方量称取除黄柏以外拟醇提的药物饮片,按“2.1.3”项下方法制备,即得。
2.1.5 线性关系考察
精密吸取“2.1.2”项下对照品贮备液,加甲醇分别稀释至0.2、0.4、0.6、0.8、1.0 mg/mL,按“2.1.1”项下色谱条件进样测定,以峰面积积分值对质量浓度进行回归,得回归方程Y=37 819 336.69X-163 479.38(r=0.999 5),结果表明盐酸小檗碱在2.00~10.00 μg范围内线性关系良好。
2.1.6 精密度试验
精密吸取“2.1.2”项下对照品贮备液,按“2.1.1”项下色谱条件下连续进样6次,计算得盐酸小檗碱峰面积RSD=0.37%,表明仪器精密度良好。
2.1.7 重复性试验
称取拟醇提药物饮片,按“2.1.3”项下方法制备供试品溶液6份,按“2.1.1”项下色谱条件测定,结果盐酸小檗碱峰面积RSD=1.35%,表明重复性良好。
2.1.8 稳定性试验
精密吸取同一供试品溶液,按“2.1.1”项下色谱条件分别于制备后0、4、8、12、24、48 h测定,结果盐酸小檗碱峰面积RSD=0.99%,表明供试品溶液在48 h内稳定。
2.1.9 加样回收率试验
取盐酸小檗碱含有量已知的供试品6份,精密加入盐酸小檗碱对照品适量,按“2.1.1”项下色谱条件进样分析,结果平均回收率为100.11%,RSD=1.78%,表明加样回收率良好。
2.2 苦参碱含量测定
2.2.1 色谱条件
采用Symmetry Shield C18柱(4.6 mm×150 mm,5 ?m),流动相为乙腈∶甲醇∶三乙胺∶磷酸盐缓冲液(pH 6.8)=12∶12∶0.1∶76,进样量10 μL,流速1 mL/min,柱温30 ℃,检测波长220 nm[12-13]。
2.2.2 对照品溶液的制备
精密称取适量苦参碱对照品,加甲醇制成浓度为0.51 mg/mL的苦参碱对照品贮备液。
2.2.3 供试品溶液的制备
称取处方中拟醇提的药物饮片,加10倍量60%乙醇,回流提取2次,每次1 h,取醇提液30 mL,精密加入三氯甲烷-甲醇-浓氨水(40∶10∶1)混合溶液50 mL并超声处理30 min,转移至分液漏斗,取下层,蒸干,残渣加甲醇溶解,定容至10 mL容量瓶,摇匀,过滤,取续滤液,即得。
2.2.4 阴性对照溶液的制备
按处方量称取除苦参外拟醇提的药物饮片,按“2.2.3”项下方法制备,即得。
2.2.5 线性关系考察
精密吸取“2.2.2”项下对照品贮备液,加甲醇分别稀释至0.07、0.14、0.21、0.28、0.35 mg/mL,按“2.2.1”项下色谱条件进样测定,以峰面积积分值对质量浓度进行回归,得回归方程Y=6 950 797.44X-9791.88(r=0.999),结果表明苦参碱在0.70~3.50 μg范圍内线性关系良好。
2.2.6 精密度试验
精密吸取“2.2.2”项下对照品贮备液,按“2.2.1” 项下色谱条件连续进样6次,计算得苦参碱峰面积RSD=0.63%,表明仪器精密度良好。
2.2.7 重复性试验
称取处方中拟醇提的药物饮片30 g,按“2.2.3”项下方法制备供试品溶液6份,按“2.2.1”项下色谱条件进样,计算得苦参碱峰面积RSD=0.72%,表明该方法重复性良好。
2.2.8 稳定性试验
精密吸取同一供试品溶液,按“2.2.1”项下色谱条件分别于制备后0、4、8、12、24、48 h测定,计算得苦参碱峰面积RSD=0.83%,表明供试品溶液在48 h内稳定。
2.2.9 加样回收率试验
取苦参碱含有量已知的供试品溶液6份,精密加入苦参碱对照品适量,按“2.2.1”项下色谱条件进样分析,结果平均回收率为100.03%,RSD=1.85%,表明加样回收率良好。
2.3 浸膏得率测定
将50 mL醇提液精密吸取至已干燥恒定质量的蒸发皿中,水浴蒸干后放入105 ℃烘箱干燥3 h,置于干燥器冷却30 min,迅速精密称重,计算浸膏得率。浸膏得率(%)=浸膏质量×供试品溶液体积÷(药物饮片总质量×移取供试品溶液体积)×100%。
2.4 提取工艺优选
以乙醇浓度、加醇倍量和提取时间为自变量,以盐酸小檗碱、苦参碱和浸膏得率的综合评分为因变量,根据评价指标对醇提工艺的影响拟定权重,以各指标综合评分作为提取效果的评判依据。健脾祛湿丸方中黄柏为臣药、苦参为佐药,故给予盐酸小檗碱40%权重,苦参碱和浸膏得率各给予30%权重,分别计算各指标评分及综合评分。指标评分(%)=测得值÷最大值×权重×100%。综合评分=盐酸小檗碱评分+苦参碱评分+浸膏得率评分。
2.5 单因素试验
2.5.1 提取次数
称取处方中拟醇提的药物饮片30 g,将乙醇浓度固定为60%,加醇倍量固定为10倍,提取时间固定为1 h,依次考察提取1、2、3次,结果综合评分呈递增趋势,故最佳提取次数为3次。

2.5.2 乙醇浓度
称取处方中拟醇提的药物饮片30 g,将提取次数固定为1次,加醇倍量固定为10倍,提取时间固定为1 h,结果乙醇浓度为60%时,综合评分最高,故将50%、60%、70%乙醇浓度作为响应面设计范围。
2.5.3 加醇倍量考察
称取处方中拟醇提的药物饮片30 g,将提取次数固定为1次,乙醇浓度固定为60%,提取时间固定为1 h,结果加醇倍量为10倍量时,综合评分最高,故将8、10、12加醇倍量作为响应面设计范围。
2.5.4 提取时间
称取处方中拟醇提的药物饮片30 g,将提取次数固定为1次,乙醇浓度固定为60%,加醇倍量固定为10倍,当提取时间为2 h时,综合评分最高,故选提取时间1.5、2.0、2.5 h为响应面设计范围。

2.6 Box-Behnken响应面法优化提取工艺
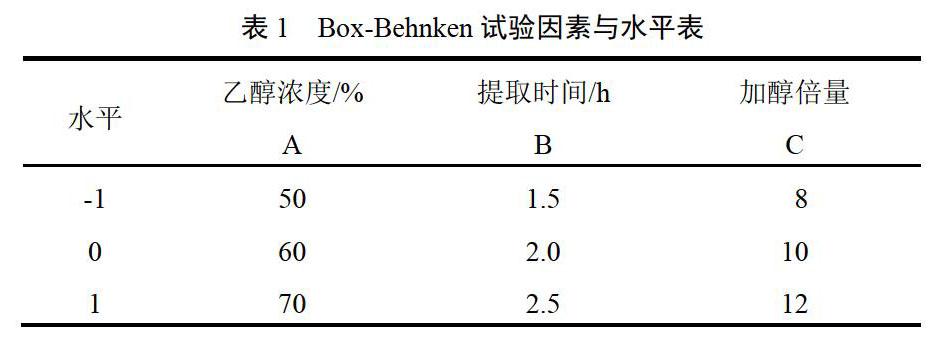
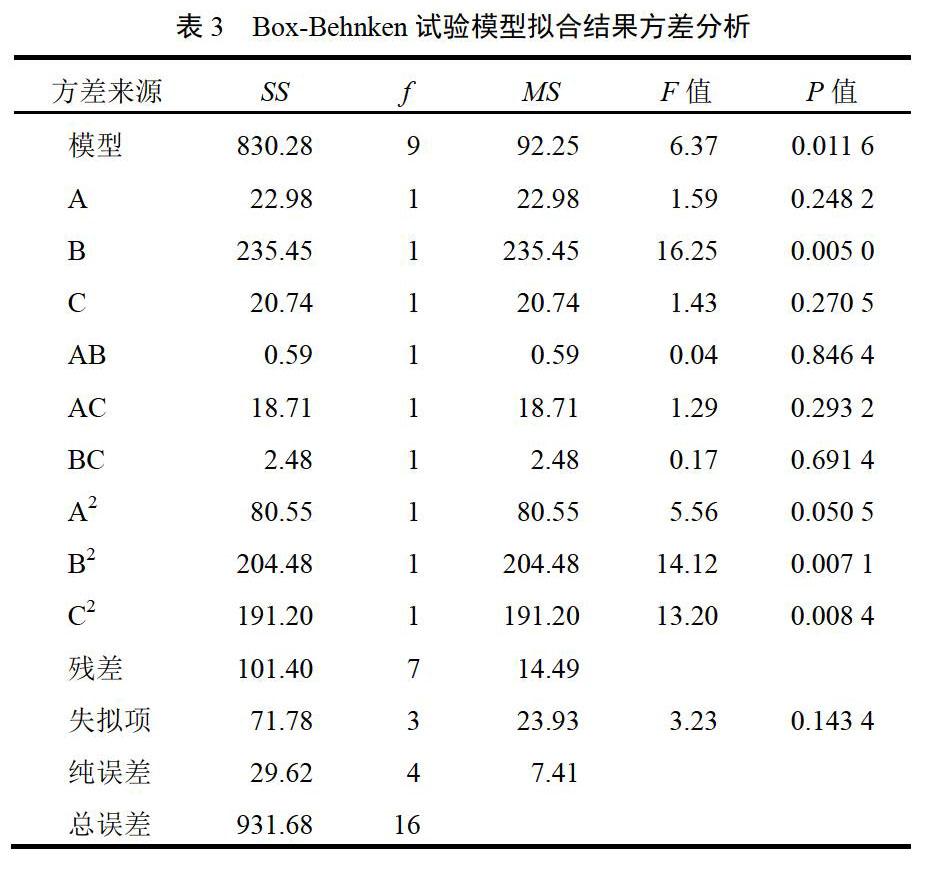
称取处方中拟醇提的药物饮片30 g,在单因素试验基础上,确定各因素的适宜范围,提取次数固定为3次。以乙醇浓度(A)、加醇倍量(B)和提取时间(C)作为考察指标进行Box-Behnken响应面设计[14],试验因素与水平见表1。采用Design Expert 8.0.4软件设计试验方案,见表2。
2.6.2 验证试验
通过数据分析得到的最佳提取工艺为:称取处方中拟醇提的药物饮片30 g,加入59.44%乙醇10.27倍,提取2.13 h。结合实际生产,确定最佳工艺为:加入60%乙醇10倍,提取2 h。在最优工艺下进行3次验证试验,结果盐酸小檗碱、苦参碱平均质量分别为25.48、38.59 mg,浸膏得率为29.10%,综合评分为93.08%,与预测值(94.44%)接近,且盐酸小檗碱转移率为84.61%,苦参碱转移率为76.02%,表明该模型预测性较好,可用于优化健脾祛湿丸的醇提工艺。
3 讨论
本研究通过单因素试验考察多个因素水平,筛选出最佳提取方案,使进入响应面设计试验的范围缩小;以综合评分为评价指标,盐酸小檗碱、苦参碱及浸膏得率为影响因素进行试验设计与模型拟合,并对最优提取工艺进行验证,结果表明该方法合理可行。苦参碱含量测定首先参照2015年版《中华人民共和国药典》(一部)苦参项下方法,结果有效成分无法分离。通过查阅大量文献总结发现,甲醇-乙腈-磷酸盐缓冲液流动相较适合,故考察了9∶10∶72~15∶15∶80共12个比例,其中12∶12∶76条件下色谱峰分离度较好,且加入三乙胺溶液可减少拖尾,进而考察了pH值对分离情况及峰形的影响,发现当pH=6.8时结果最佳。制备供试品溶液时,为有效提取苦参总碱生物碱类成分,应首先使生物碱游离,故采用先加浓氨水后加有机溶剂的方法;其次对提取溶剂进行考察,分别筛选了饱和正丁醇、乙醚和三氯甲烷3种试剂,结果表明用三氯甲烷超声处理的提取效率最高,故采用三氯甲烷作为提取溶剂。
参考文献:
[1] XIAO C W, JI Q A, WEI Q, et al. Antifungal activity of berberine hydrochloride and palmatine hydrochloride against Microsporum canis -induced dermatitis in rabbits and underlying mechanism[J]. BMC Complement Altern Med,2015,15:177.
[2] 孙森凤,张颖颖,褚万春.黄柏药理作用的研究进展[J].山东化工, 2017,46(14):99-100.
[3] XIAN Y E, MAO Q Q, IP S P, et al. Comparison on the anti-inflammatory effect of cortex Phellodenri Chinensis and Cortex Phellodendri Amurensis in 12-0-tetradecanoylphorbol-13- acetate-induced ear edema in mice[J]. J Ethnopharmacol,2011, 137(3):1425-1430.
[4] 邢宇,刘鑫,林园,等.小檗碱药理作用及其临床应用研究进展[J].中国药理学与毒理学杂志,2017,31(6):491-502.
[5] HUANG L H, PAN X P, GONG K R, et al. Antiinflammatory effects of three kinds of traditional Mongolian medicine monomer and its combination on LPS-stimulated RAW264.7 macrophages[J]. Eur Rev Med Pharmacol Sci,2016,20(5):950-958.
[6] 張丽华,陈邦恩,潘明佳.苦参碱药理作用研究进展[J].中草药,2009, 40(6):1000-1003.
[7] 张明发,沈雅琴.苦参碱类生物碱抗病毒的临床药理作用研究进展[J].抗感染药学,2018,15(2):185-191.
[8] SUN M, CAO H, SUN L, et al. Antitumor activities of Kushen: literature review[J]. Evid Based Complement Alternat Med,2012, 2012(4):373219.
[9] 陈燕,张丽华.苦参水提物治疗湿疹豚鼠皮肤炎症的实验研究[J].现代医院,2015(5):22-24.
[10] 吴芳妮,张芊,张春雷.苦参在T细胞介导的皮肤良恶性疾病中的应用进展[J].中国皮肤性病学杂志,2016,30(8):847-849.
[11] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:19-20,899-900.
[12] 何超然,李哲,李任,等.HPLC法同时测定山豆根中4种生物碱及其含量[J].中国药物应用与监测,2018,15(2):77-81.
[13] 毛丹,陈钶,王柯,等.HPLC法测定苦参软膏中苦参碱、槐定碱和氧化苦参碱[J].中成药,2011,33(9):1531-1534.
[14] 张江,张丽,木卡代斯·斯依提,等.响应面法优选银槐解毒颗粒提取工艺[J].中国中医药信息杂志,2018,25(1):64-68.

