鼻咽癌放疗后双侧颞叶白质及海马结构早期损伤的扩散峰度成像研究
陈红,何浩强,吕晓飞,韩路军,杨雅迪,李晶,文戈
鼻咽癌(nasopharyngeal carcinoma,NPC)是好发于我国南方的恶性肿瘤,放射治疗是鼻咽癌的主要治疗方式,而放射治疗难以避开临近的双侧颞叶、海马等结构,放射性脑损伤已成为严重影响患者生活质量的并发症之一[1]。晚期放射性脑损伤为不可逆性,治疗效果较差,故早期监测放射性脑损伤尤为重要。既往扩散张量成像(diffusion tensor imaging,DTI)对放射性脑损伤研究集中于白质,且DTI是假设分子呈高斯运动,而生物组织由于受到细胞膜、细胞器、细胞内外环境的影响,分子运动呈非高斯扩散[2]。扩散峰度成像(diffusion kurtosis imaging,DKI)作为DTI技术的延伸,适用于研究脑组织灰白质,能够反映非高斯运动的扩散特性,更接近组织中分子真实扩散情况,从而反映脑组织微观结构变化[3-6]。近年来,DKI已在轻微脑损伤、注意力缺陷多动障碍、阿尔茨海默病、乳腺癌、前列腺癌、脑胶质瘤等有初步运用,但其在鼻咽癌颞叶白质及海马早期隐匿性放射性脑损伤的研究鲜见。本研究旨在采用DKI技术探讨鼻咽癌早期放射治疗后双侧颞叶及海马微观结构变化的非高斯扩散特点,评价DKI在早期放射性脑损伤的运用价值,以期为其临床早期发现及监测提供客观依据。
1 材料与方法
1.1 研究对象
本研究共纳入鼻咽癌组(NPC组)及正常对照组(NC组)两组被试。NPC组为2015年10月至2018年1月在中山大学肿瘤防治中心就诊的29例NPC患者,男21例,女8例,年龄(40.28±9.45)岁,教育年限(12.29±2.98)年,鼻咽癌分期:AJCC第7版TNM I-IVb期。
纳入标准:(1)经活检病理证实,且未接受手术、诱导化疗、放疗等抗肿瘤治疗的鼻咽癌初诊患者;(2)拟按临床计划行适型调强放射治疗(intensity modulated radiation therapy,IMRT);(3)年龄18~60岁,右利手;(4)无远处转移及明显颅内侵犯征象;(5)常规MRI检查颅内无明显实质性病变(包括脑实质肿瘤、脑组织炎症、脑血管病变、脑白质病变);(6)既往无颅脑外伤及手术史,无神经及精神疾病史。
排除标准:(1)对磁共振检查禁忌者;(2)糖尿病、高血压患者及合并其他系统疾病;肿瘤复发再次放疗或不能坚持及完成IMRT治疗者;(3)文盲、智力或视力低下不能完成量表测试者。
NC组为同时期收集的20例正常被试者,男13例,女7例,年龄(41.00±10.04)岁,教育年限(12.15±3.48)年。所有正常被试均无不适临床症状;无颅内病变;无严重血管疾病及肿瘤病史;无本人及家族性精神疾病史;无高血压及糖尿病;无其他全身性或系统性疾病;无药物滥用史;均为汉族、右利手。
所有NPC被试于治疗前及放疗后3个月时、所有NC被试均接受颅脑MRI检查。被试在MRI检查当天行蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)量表测试,完成量表评价的NPC组治疗前被试26例、NPC组放疗后3个月被试18例、NC组被试20例。本研究通过中山大学肿瘤防治中心伦理委员会审核批准(批准号:GZR2014-073),所有被试在检查前均签署了知情同意书。
1.2 鼻咽癌治疗方法和剂量
1.2.1 放射治疗
鼻咽癌患者均行根治性IMRT,选用大孔径CT以3 mm层距进行平扫及增强扫描,扫描范围从头到胸锁关节下2 cm,参照ICRU50[7]和62号[8]文件勾画鼻咽大体肿瘤体积(GTVp)、颈部转移淋巴结体积(GTVnd)、临床靶区体积1(CTV1)及临床靶区体积2(CTV2),GTVp、GTVnd、CTV1、CTV2靶区处方剂量分别为:66~72 Gy、64~70 Gy、60~63 Gy、54~56 Gy[9],剂量分割次数为30~33次。对双侧颞叶和海马结构在逐个CT图像层面上勾画进行剂量评价,通过Eclipse或Monaco计划系统将鼻咽癌患者剂量数据进行收录汇总。双侧颞叶及海马最大剂量/平均剂量分别如下,左侧颞叶:(7009.8±690.4) cGy/(1928.9±572.8) cGy;右侧颞叶:(7019.4±710.6) cGy/(2029.7±668.3) cGy;左侧海马:(4911.7±1495.4) cGy/(2150.1±816.4) cGy;右侧海马:(4983.9±1460.9) cGy/(2160.3±890.1) cGy。
1.2.2 化疗
鼻咽癌化疗方案相近,鼻咽癌患者均经过1~3程诱导化疗或/和同期放化疗,化疗方案包括TPF (多西他赛+顺铂+5-氟尿嘧啶)、TP (紫杉醇+顺铂)、DDP (顺铂)、力朴素、尼妥珠单抗等化疗方案。
1.3 MRI数据采集
采用GE Discovery MR750 3.0 T扫描仪和32通道头线圈。扫描序列包括常规MR序列(矢状位3D-T1WI、T2FLAIR)和DKI序列。扫描参数如下,矢状位3D-T1WI:矩阵256×256,FOV 256 mm×256 mm,层厚1 mm,层间距0,FA=8°,TR 8.2 ms,TE 3.2 ms,TI 800 ms,扫描层数176层。DKI:25个方向扩散敏感度,b值分别为:0、1000、2000 s/mm2,矩阵128×128,FOV 240 mm×240 mm,层厚3 mm,层间距0,TR 5300 ms,TE 77.1 ms,NEX为1,扫描层数46层。
1.4 图像后处理
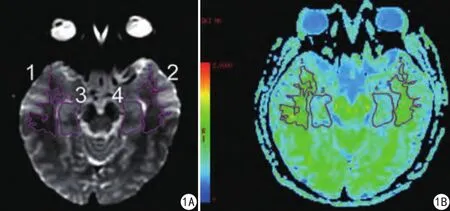
图1 DKI参数测量的ROI示意图。1为右侧颞叶白质ROI,2为左侧颞叶白质ROI,3为右侧海马ROI,4为左侧海马ROI;勾画过程参考b0图。A;b0图;B:MK彩图Fig. 1 The ROI maps for measurement of DKI parameters. ROI 1 represents the white matter of the right temporal lobe. ROI 2 represents the white mater of the temporal lobe. ROI 3 represents the right hippocampus. ROI 4 represents the left hippocampus. ROIs were drawn referred to b0 and MK maps. A: b0 map. B: MK map.
使用ADW4.6工作站对数据进行分析处理,得到7个参数图:各向异性分数(fractional anisotropy,FA)图、平均扩散系数(mean diffusivity,MD)图、轴向扩散张量(axial diffusivity,Da)图、径向扩散张量(radial diffusivity,Dr)图、平均峰度(mean kurtosis,MK)图、轴向峰度(axial kurtosis,Ka)图、径向峰度(radial kurtosis,Kr)图,于双侧颞叶白质、双侧海马手动勾画ROI (region of interest),ROI放置于靠近侧脑室下角的双侧颞叶白质、双侧海马最大面积层面,应尽量避开脑沟、脑室以及邻近的血管等结构。勾画过程参考b0图及DKI彩图,同时将ROI投射到其他DKI参数图上(图1)。ROI的勾画参考以往文献[10-11],由2名医师(具有3年经验的住院医师及11年经验的副主任医师)共同讨论决定,并测量3次后取平均值。
1.5 统计学分析
采用SPSS 23.0软件包对数据进行分析。首先采用kolmogorov-smimov法对数据进行正态分布检验,数据符合正态性分布时采用配对或两独立样本t检验。ROI测量的各DKI参数值以均数±标准差(±s)形式表示。采用两独立样本t检验比较NPC组治疗前和NC组的年龄、教育年限间的差异,采用χ2检验比较NPC组和NC组的性别差异。采用两独立样本t检验对NPC组治疗前与NC组基线DKI各参数值及MoCA量表评分差异进行比较,采用配对样本t检验对NPC组治疗前及3个月后各DKI参数值及MoCA量表评分差异进行比较,DKI相关参数的比较采用同侧分别进行比较。在NPC组内,采用两独立样本t检验对放疗前后有统计学差异的左右侧颞叶DKI参数值的变化程度进行比较;对NPC组内放疗前后差异有统计学意义的DKI参数值,采用偏相关分析,以年龄、性别、教育年限作为协变量,分析其放疗前后差值变化与MoCA量表评分差值变化、与所在同侧颞叶/海马的最大/平均剂量之间的相关关系。上述P<0.05被认为具有统计学意义。

图2 NPC组治疗前与放疗后双侧颞叶白质及右侧海马的DKI参数变化。Temp_R:右侧颞叶白质;Temp_L:左侧颞叶白质;HIPP_R:右侧海马;pre_NPC:鼻咽癌组治疗前;3m_NPC:鼻咽癌组放疗后3个月;NC:正常对照组;ns:无统计学差异Fig. 2 Changes of DKI related parameters of the bilateral temporal lobe white matter and the right hippocampus before and after treatment in NPC group. Temp_R: white matter of right temporal lobe, Temp_L: white matter of left temporal lobe. HIPP_R: right hippocampus. pre_NPC: pretreatment in NPC group. 3m_NPC: 3 months after radiotherapy in NPC group. NC: normal control. ns: not significant.
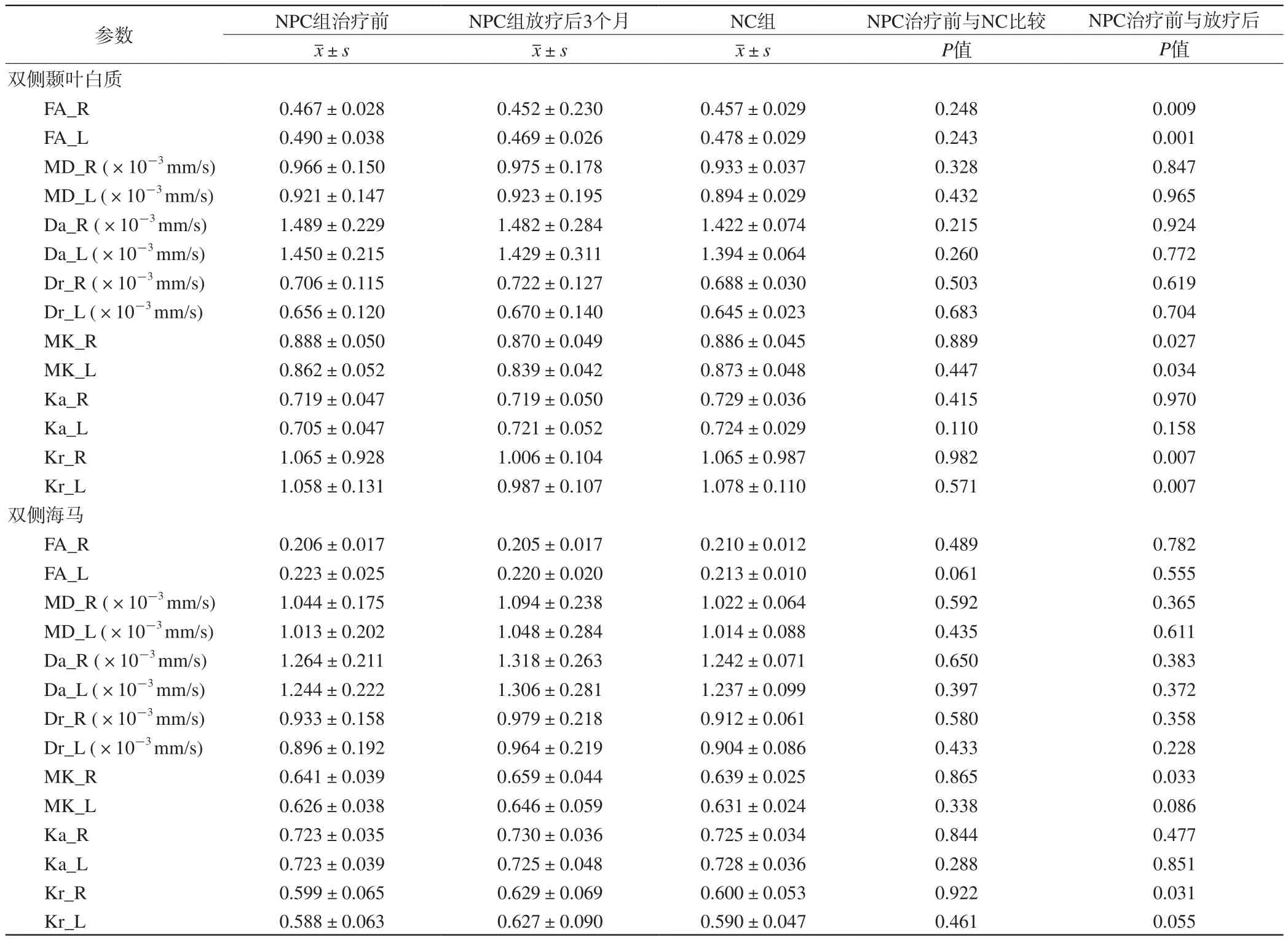
表1 NPC组和NC组双侧颞叶白质、双侧海马ROI各参数比较Tab. 1 Comparisons of the parameters of each ROI within bilateral temporal lobe white matter and bilateral hippocampus between NPC group and NC group

图3 NPC组左侧颞叶白质治疗前与放疗后3个月MK、Kr的差值(△MK、△Kr)与左侧颞叶放疗最大剂量(Temp_L_max)呈显著正相关Fig. 3 The different values of MK and Kr (△MK, △Kr) in white matter of the left temporal lobe show significant a positive correlation with the maximum irradiation dose of the left temporal lobe (Temp_L_max), respectively.
2 结果
2.1 临床资料
NPC组和NC组临床资料无统计学差异(年龄:t=0.66,P=0.36;教育年限:t=0.21,P=0.89;性别:χ2=0.30,P=0.58)。
2.2 双侧颞叶及海马各DKI参数值比较
2.2.1 双侧颞叶白质
与NPC组治疗前比较,NPC组放疗后3个月双侧颞叶白质的FA(左侧:P=0.009;右侧:P=0.001)、MK(左侧:P=0.027;右侧:P=0.034)、Kr值(左侧:P=0.007;右侧:P=0.007)均显著减低(表1,图2);左右颞叶白质的放疗前后FA、MK、Kr值的变化程度、双侧颞叶白质的MD、Da、Dr、Ka值治疗前与放疗后3个月的改变均无显著统计学差异(P值均大于0.05)。NPC组治疗前与NC组基线双侧颞叶白质的各DKI参数值均无显著统计学差异。
2.2.2 双侧海马
与NPC组治疗前比较,NPC组放疗后3个月右侧海马的MK值(P=0.033)、Kr值(P=0.031)显著升高(表1,图2);左侧海马的MK、Kr值、双侧海马的MD、Da、Dr、Ka值的改变均无显著统计学差异。NPC组治疗前与NC组基线双侧海马各DKI参数值均无显著统计学差异。
2.3 MoCA量表评分值比较及相关性分析
NPC组放疗后3个月的MoCA评分[(27.47±2.04)分]较治疗前MoCA评分[(28.94±1.20)分]显著减低(t=2.58,P=0.02)。NPC组治疗前与NC组的MoCA评分[(28.90±0.91)分]统计学分析无显著统计学差异(t=0.32,P=0.75)。偏相关分析结果表明,NPC组治疗前与放疗后MoCA量表的差值与双侧颞叶放疗最大/平均剂量、与双侧海马放疗最大/平均剂量、与双侧颞叶白质放疗前后FA、MK、Kr差值、与右侧海马放疗前后MK、Kr差值的相关性均无显著统计学差异(P值均大于0.05)。
2.4 DKI差异参数的变化与放疗最大/平均剂量相关性分析
在NPC组内,左侧颞叶白质治疗前与放疗后3个月MK、Kr的差值(△MK、△Kr)与左侧颞叶放疗最大剂量呈显著正相关(P=0.044,r=0.407;P=0.006,r=0.530)(图3),与左侧颞叶放疗平均剂量无显著相关(P>0.05)。右侧颞叶白质治疗前与放疗后3个月MK、Kr的差值与右侧颞叶放疗最大/平均剂量、右侧海马治疗前与放疗后3个月MK、Kr的差值与右侧海马放疗最大/平均剂量、双侧颞叶白质治疗前与放疗后3个月FA的差值与右侧颞叶放疗最大/平均剂量均无统计学差异(P值均大于0.05)。
3 讨论
3.1 DKI参数在放射性脑损伤中的运用
放射性脑损伤是NPC患者严重影响生活质量的并发症,根据放疗时间和临床症状,放射性脑损伤分为三个阶段:急性反应期(放疗后数天到数周内),亚急性期或早期延迟反应期(放疗3个月后),晚期延迟反应期(放疗后6个月到数年)[12-13]。早期放射性脑损伤的临床症状表现为嗜睡、头痛、恶心等,这些通常是短暂可逆的,晚期延迟反应期症状包括不同程度的渐进性神经认知功能损害,甚至最终不可逆性的放射性脑坏死[14],因而放射性脑损伤的临床早期检测显得尤为重要。
DKI在DTI模型的基础上引入了概率与四阶峰度,可以评价脑组织白质和灰质水分子扩散的受限程度及扩散的不均质性,显示DTI难以显示的纤维交叉、弯曲等复杂微观环境的结构特征[15]。DKI可同时获得衍生的DTI扩散度量(FA、MD、Da、Dr)及DKI度量指标(MK、Ka、Kr)[5]。FA常用来评价脑白质水分子沿纤维束方向的扩散,MD用于反映分子整体扩散水平和扩散阻力的整体情况,Da及Dr分别代表与轴突方向平行和垂直的水分子的扩散。MK是定义为峰度在所有方向峰度的平均值,被认为是组织微结构复杂程度的指标,Ka是指沿着扩散椭球轴向的峰度值,Kr代表扩散正交方向上的峰度值,因扩散受限主要在径向,Kr较Ka较为突出[5]。
3.2 颞叶白质的DKI参数改变及其意义
本研究中,NPC组双侧颞叶白质放疗后3个月FA值较治疗前显著减低,这与以往的人体及动物实验研究结果相似[14,16-19]。在放疗后早期延迟反应期,由于白质轴突的脱髓鞘过程,会导致FA值的减低,并且由于放疗后早期的炎症反应,充填在轴突周围的胶质细胞增生及周围血管的水肿,轴突密度的减低,这也会导致颞叶白质的FA值减低[14,16-17,19]。还有一种说法认为,由于水肿的存在,轴突组织变得疏松,其组织排列变得不规则,组织一致性减低,导致了FA值的减低[2]。本研究中NPC组放疗后3个月双侧颞叶白质MK值较放疗前显著减低,可能是由于双侧颞叶白质放疗后轴突完整性破坏,细胞减少,轴突密度减低,导致了脑组织复杂程度减低[3-4,12,15]。在以往潘海宾等[20]的横断面研究中,亦发现了鼻咽癌放疗结束后早期出现颞叶白质MK值降低,但他们的研究并未进一步探讨Kr及Ka值的变化。我们进一步的研究发现双侧颞叶白质放疗后Kr值减低,说明水分子垂直于轴突方向的扩散受限程度减低,进一步说明了NPC组放疗后颞叶白质早期延迟反应期脱髓鞘过程的存在[15]。而本研究中反映髓鞘完整的DTI衍生参数Dr在鼻咽癌放疗前后并未有显著差异,与之相似的是,Cheung等[21]的研究发现Kr值较Dr值能更敏感探测神经组织径向的改变,本研究结果表明Kr值能比DTI衍生参数Dr值能够更敏感反映NPC放疗后颞叶白质髓鞘的丢失。
3.3 海马的DKI参数改变及其意义
海马是对放疗后早期损伤效应尤为敏感的脑区。本研究首次探讨了海马放疗后早期的扩散峰度改变,我们发现NPC组放疗后3个月右侧海马的MK值及Kr值显著升高。海马是以灰质为主的颞叶解剖结构,MK值的升高可能是由于放疗后早期神经元胞体细胞和细胞器肿胀,且伴随着胶质细胞的增生,导致脑灰质组织的复杂程度升高所致。而右侧海马放疗后3个月的Kr值升高,可能是由于NPC放疗后早期延迟反应期神经元细胞及细胞器肿胀,胶质细胞增生,导致了水分子扩散受限程度升高[15]。放疗后早期颞叶海马扩散峰度参数改变模式的机制需要进一步深入研究。
3.4 DKI的参数改变与放疗剂量相关关系及其意义
剂量依赖性的改变在放射性脑损伤相关研究常有报道[13,22-25],而扩散峰度参数的变化与剂量间的关系鲜有研究。本研究中NPC组左侧颞叶白质治疗前和放疗后3个月的MK、Kr值差值和左侧颞叶放疗最大剂量值呈显著正相关关系,提示NPC组颞叶白质的微观结构改变与放疗剂量密切相关。与之相似的是,以往的临床和动物实验研究究表明放射性脑损伤与放疗剂量有关[22-25]。而右侧颞叶白质、右侧海马治疗前后的MK、Kr差值与相关放疗剂量无显著统计学差异,可能是由于本研究样本量不够大所致。
3.5 MoCA量表值的改变及其意义
本研究发现NPC组放疗后3个月的MoCA量表值减低,表明了NPC组放疗后早期延迟反应期患者的神经认知功能下降。有研究认为放疗引起的学习及记忆功能减退与海马的损伤有关[26]。海马被认为负责言语记忆的形成,其功能障碍可能会导致患者记忆能力下降[10,27]。放疗可能会引起血管的损伤从而导致海马结构功能障碍,有临床试验表明放疗时保护海马能使患者早期意识功能障碍的受损程度减低[28]。但本研究MoCA量表评分值的改变与DKI参数值的改变没有显著相关性,这可能是由于MoCA量表评估的简单性及不敏感性引起的,以往的研究显示MoCA量表在评价被试的执行功能、语言和视觉记忆、注意力方面并不非常敏感[29]。
本研究仍存在一些不足:(1)本研究样本量偏小,今后将扩大样本量进一步研究;(2) MoCA量表是简易神经认知评估量表,有待进一步采用精细量表评估神经认知功能;(3)尽管本研究表明颞叶白质损伤与放疗关系密切,但所有NPC组患者均进行诱导化疗或(和)同期放化疗,化疗药物对脑组织结构的损伤仍未能排除[30],进一步研究单纯放射治疗患者的颞叶损伤可以排除化疗影响;(4)本研究采用手动勾画ROI方式获得DKI参数值,其可重复性较差,今后采用基于体素的全脑研究可以克服这一局限性。
综上所述,本研究显示了鼻咽癌放疗后早期双侧颞叶白质和海马的隐匿性微观结构改变,并表明左侧颞叶白质扩散峰度参数呈剂量依赖性改变,采用DKI能较DTI更敏感地发现这些病变非高斯扩散特点。DKI可以作为客观的影像学手段监测鼻咽癌放疗后颞叶白质和海马早期隐匿性放射性脑损伤,为临床早期发现及干预提供客观影像学依据。
利益冲突:无。

