白蛋白纳米颗粒的制备研究进展
李 艳 蓝锦晓 罗 成
(宜春学院医学院,江西 宜春 336000)
引言
纳米颗粒在生物医学领域具有广泛应用, 多种生物活性物质(如药物、核酸、多肽或蛋白质等)都可以通过纳米颗粒来递送[1]。纳米颗粒易通过高渗透长滞留效应(enhanced permeability and retention effect, EPR 效应)及受体介导的主动靶向作用在肿瘤组织富集, 提高药物的生物利用率, 降低游离药物的毒副作用[2-4]。白蛋白是血浆中含量最丰富的蛋白质(35~50 g/L, 人血清)[5], 具有生物相容性好、无免疫原性、可生物降解等特性, 是制备纳米颗粒的理想材料[4]。此外, 血管内皮细胞表面的白蛋白结合糖蛋白60(gp60)和多种肿瘤细胞表面过表达的SPARC(富含半胱氨酸的酸性分泌蛋白)都能与白蛋白高效结合, 促使载有药物的白蛋白纳米颗粒集中在肿瘤细胞间质, 增加药物在肿瘤组织的局部浓度[4,6-7]。因此, 白蛋白纳米颗粒已经成为生物医学领域尤其是靶向运输药物和诊断试剂方面的研究热点之一[8-9]。2005年, FDA首次批准白蛋白结合紫杉醇纳米制剂Abraxane®用于转移性乳腺癌的临床治疗。随后,关于Abraxane®对非小细胞性肺癌、转移性胰腺癌和转移性黑色素瘤等治疗作用的研究也逐渐开展[3]。2014年, Sheng等将负载吲哚菁绿(ICG)的白蛋白纳米颗粒用于肿瘤的光动力/光热协同治疗[10]。此外, 白蛋白纳米颗粒在阿尔兹海默症等多种疾病的诊疗、基因载体等方面的应用也被不断开发[11-13]。颗粒大小、表面修饰等是影响纳米颗粒体内药代动力学特性的重要因素[14], 选择优化的制备工艺对于制备具有特定性质的白蛋白纳米颗粒具有重要意义。下面综述近年来白蛋白纳米颗粒的制备研究进展, 并按照制备方法分类进行介绍。
1 白蛋白概述
人血清白蛋白(human serum albumin, HSA)和牛血清白蛋白(bovine serum albumin, BSA)在药物递送系统的应用受到广泛关注。HSA是循环系统的重要成分, 具有结合和运输内源性及外源性物质、维持渗透压、清除自由基等生理功能[15]。HSA是一种单肽, 由585个氨基酸构成, 含有17个二硫键和1个游离巯基[16], 它的三维形状[17]是由3个同源结构域(I、II、III)通过二硫键交联而成的α螺旋椭球体[5]。每个结构域都包含一对子域, 称为A和B[18],在IIA 和 IIIA子域上有两个主要的药物结合位点[19],能够与多种药物(如抗生素、抗凝血剂、消炎药、麻醉剂等)结合[16], 提高药物的生物利用率[20]。BSA由583个氨基酸组成, 与HSA具有75.6%的同源序列,因此BSA的结构与HSA的结构十分类似, 同样可以与多种药物结合。由于分子内存在若干可诱导T细胞增殖的抗原表位, BSA用于注射时会导致轻微的过敏反应[21]。
2 制备方法
2.1 去溶剂化法
去溶剂化法是在搅拌条件下,用乙醇等脱水剂除去白蛋白的水化膜,暴露其疏水区域,降低白蛋白溶解度,从而将白蛋白析出为纳米颗粒;再通过热变性或化学交联,形成稳定的白蛋白纳米颗粒, 其中交联剂多采用戊二醛;最后去除残留的交联剂和有机溶剂,得到纯化的白蛋白纳米颗粒。去溶剂化法具有制备过程简单、反应快速、不需要添加表面活性剂等优点, 适用于多种疏水性药物的包裹, 是目前应用最广的白蛋白纳米颗粒制备方法, 缺点在于残余的戊二醛等交联剂对生物体有一定的毒副作用[19,22]。
传统去溶剂化法制备工艺存在搅拌速度不稳定、大体积搅拌效率降低、与反应容器底部摩擦等缺点, 使其大规模制备受到限制。2011年, Wacker等利用双桨搅拌系统实现白蛋白纳米颗粒的大规模制备[23],纳米颗粒的粒径在(234.1±1.5)和(251.2±27.0)nm范围内, 多分散指数(PDI)低于0.2。纳米颗粒经冷冻干燥后可以长期储存, 并且再悬浮后的纳米颗粒能够被进一步处理, 如吸附药物或在颗粒表面共价修饰靶向配体等。
2013年, Wang等首先利用还原性谷胱甘肽(GSH)还原HSA分子内部二硫键形成游离巯基, 之后利用去溶剂化法制备HSA纳米颗粒, 利用HAS分子间游离巯基发生氧化反应生成二硫键, 同时分子内二硫键与游离巯基发生交换反应, 两种方式共同形成分子间二硫键, 从而稳定HSA纳米颗粒(见图1)[24]。该方法无需使用戊二醛等交联剂, 从而避免了其可能导致的毒副作用。

图1 二硫键交联HSA纳米颗粒的制备原理[24]Fig.1 Schematic of the preparation of HSA nanoparticles by a reduction and desolvation method[24]
纳米氧化铈(CNPs)能够模拟超氧化物歧化酶和过氧化氢酶的活性, 从而降低细胞内活性氧(ROS)的含量。2015年, Bhushan等利用去溶剂化法制备包裹CNPs的BSA纳米颗粒(BCNPs)(见图2), 纳米颗粒粒径为231.05 nm[25]。该纳米颗粒能够增强细胞的抗氧化系统, 避免氧化损伤导致的细胞凋亡。

图2 包裹CNPs的BSA纳米颗粒的制备原理[25]Fig.2 Schematic outline of BCNPs fabrication by desolvation method[25]
2015年, Peralta等利用去溶剂化法制备负载光热剂金纳米棒和化疗药物紫杉醇的HSA纳米颗粒, 颗粒粒径为(299±6)nm, 紫杉醇的负载量可以达到3 μg/mg HSA, 近红外光照射15 min,纳米颗粒的溶液能够升温至46 ℃, 从而可以用于肿瘤的光热疗/化疗的协同治疗[26]。
2016年,Jahanban-Esfahlan等利用EDC(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)代替戊二醛,对制备的白蛋白纳米颗粒进行交联,避免了戊二醛残留可能导致的毒副作用, 同时将纳米颗粒的制备时间缩短到3 h,最终获得了粒径在100 nm左右且PDI低于0.2的白蛋白纳米颗粒[19]。
2017年, Wang等首先对钆类造影剂Gd-DOTA [钆III-1,4,7-三(叔丁氧羰甲基)-10-(乙酸)-1,4,7,10-四氮杂环十二烷]进行甘草次酸修饰, 得到造影剂衍生物GGD, 该衍生物能够通过甘草次酸与BSA分子的疏水区域结合, 之后利用去溶剂化法制备得到负载GGD的BSA纳米颗粒,可将其用于T1-T2双模式核磁共振成像[27]。
美登素及其衍生物是强效的微管去组装剂, 具有显著的抗肿瘤活性, 但是其系统毒性大、对正常组织无选择性等缺点限制了它的临床应用。2017年, Wang等通过去溶剂化法制备负载美登素衍生物DM1的HSA纳米颗粒, 该纳米颗粒能够显著降低DM1的系统毒性[28]。
2017年, Liu等首先利用点击化学制备了肿瘤细胞靶向性Trp-Lys-Tyr-Met-Val-D-Met(W peptide, Wpep)修饰的HSA, 之后利用GSH还原HSA分子内部二硫键, 通过去溶剂化法制备得到负载紫杉醇的肿瘤靶向性Wpep-HSA纳米颗粒(见图3)[29]。纳米颗粒粒径为118 nm, 紫杉醇的载药量和包封率分别为9.87%和86.3%。该纳米颗粒中分子间二硫键起到稳定纳米颗粒结构的作用, 不仅避免了戊二醛等交联剂的使用, 同时还可以在细胞内部GSH的作用下断裂, 从而对紫杉醇起到控释作用。

图3 Wpep-HSA纳米颗粒的制备原理[29]Fig.3 Schematic outline of Wpep-HSA nanoparticles fabrication by desolvation method[29]
2.2 乳化法
乳化法是将白蛋白的水溶液与含有药物及乳化剂的油相混合, 经搅拌、超声或高压均质等方式乳化, 得到油包水(W/O)型乳液,与药物结合的白蛋白分布在内部水相液滴中,通过热变性或化学交联法固化液滴, 去除有机相后得到白蛋白纳米颗粒。乳液的大小受剪切力水平、乳化剂的性质和浓度以及添加方式的影响[30]。乳化法能够有效制备负载疏水性药物的纳米颗粒,但其不足在于乳化过程中的机械剪切力、超声作用等都可能破坏白蛋白的稳定性, 使白蛋白发生降解[31]。
吡柔比星(THP)是一种蒽环类药物, 可以用于实体瘤的治疗, 然而潜在的毒副作用限制了它的临床应用。2013年, Zhou等通过HSA纳米颗粒包裹THP来克服这一缺点[32]。THP首先与油酸(oleic acid, OA)通过离子键形成复合物(THP-OA), 之后THP-OA与蛋黄卵磷脂E80共同溶解在二氯甲烷中形成油相, 向油相中加入HSA的水溶液后通过高压匀质机乳化, 减压蒸馏二氯甲烷后得到负载THP-OA的HSA纳米颗粒(见图4)。纳米颗粒粒径为(128.4±12.9)nm, PDI=0.187±0.018, 包封率和载药量分别为(91.63±1.29)%和(5.54±0.22)%。

图4 负载THP-OA的HSA纳米颗粒结构[32]Fig.4 Schematic illustration of THP-OA loaded HSA nanoparticles[32]
2015年, Yi等利用类似的方法,制备了同时负载THP和紫杉醇的HSA纳米颗粒, 颗粒粒径为(156.9±3.2)nm, PDI=0.16±0.02[33]。当纳米颗粒注射入4T1小鼠乳腺癌异种移植瘤模型小鼠体内后, 可以显著富集在肿瘤区域。细胞实验和肿瘤模型小鼠实验的结果表明,与游离的单个药物或两种药物组合相比, HSA纳米颗粒的细胞毒性更高, 同时对正常组织的毒性显著降低。
2.3 双乳化法
乳化法制备的纳米颗粒能够有效包封疏水性药物,但这种方法对亲水性药物的包封效果不佳。双乳化法可用于制备载有亲水性药物的白蛋白纳米颗粒。先将溶解有白蛋白和亲水性药物的水相与含有表面活性剂的油相混合,形成初级W/O乳液, 白蛋白与药物分散在内部水相中, 表面活性剂分布在乳液表面起到稳定作用;再将初级乳液分散到添加有另一种表面活性剂的水相中, 得到水/油/水(W/O/W)复合乳液, 蒸发中间油相溶剂后,得到粒径分布均匀的纳米颗粒。2017年, Martinez等利用双乳化法制备了300~500 nm的BSA纳米颗粒[34]。溶解有脂质和聚己内酯(PCL)的氯仿作为油相, 与BSA的水溶液混合得到初级乳液, 之后分别与含有聚乙烯醇(PVA)或Pluronic的水溶液混合得到复合乳液, 蒸发氯仿后得到BSA纳米颗粒。实验表明,纳米颗粒粒径分布与表面活性剂的浓度密切相关,通过降低PCL浓度制备得到了粒径为247.5 nm、PDI=0.233±0.01的BSA纳米颗粒。双乳化法制备的白蛋白纳米颗粒具有成本低廉、药物负载效率高及良好的控释动力学等优点, 但缺点在于过程较为复杂, 需要多种表面活性剂的参与, 同时与乳化法类似,乳化过程中的机械应力、剪切力、溶剂化等可能会导致蛋白质结构的改变和生物活性的丧失[31]。
2.4 nabTM 技术
由American Bioscience公司开发的nabTM技术是一种制备负载疏水性药物白蛋白纳米颗粒的独特方法[35]。此技术以白蛋白为基质和稳定剂, 将含疏水性药物的非极性溶剂(氯仿、二氯甲烷等)和含白蛋白的水相混合, 在高剪切力(超声处理、高压均质等)的作用下得到纳米尺寸的乳液, 蒸发非极性溶剂后得到负载药物的白蛋白纳米颗粒,其粒径通常在100~200 nm范围内[36]。与传统制备方法相比,nabTM技术不需要使用其他表面活性剂, 同时避免了使用对人体有毒性的交联剂戊二醛, 是一种相对简单、安全的载药白蛋白纳米颗粒制备方法[37],缺点在于仍然需要使用氯仿、二氯甲烷等有毒溶剂。
白蛋白结合紫杉醇纳米制剂Abraxane®(也称nab-PTX)是首个应用nabTM技术制备并且被FDA批准用于一线肿瘤治疗的化疗药物,能够有效治疗包括转移性乳腺癌和非小细胞肺癌(NSCLC)在内的多种癌症。此外,该品已被FDA批准与吉西他滨联合治疗晚期转移性胰腺癌[3,38]。
2011年, Kim等采用nabTM技术,制备了粒径分布在130~150 nm、载药率为(7.2±2.5)%的姜黄素-HSA纳米颗粒[39]。先将HSA溶解到氯仿饱和水中, 另将姜黄素溶解到水饱和氯仿中,再将两种溶液混合后高压均质, 在25℃、减压条件下旋转蒸发15 min除去氯仿, 得到的纳米颗粒经冷冻干燥后保存。实验结果表明, 姜黄素-HSA纳米颗粒在水中的溶解度是姜黄素的300倍。
2015年,Wan等制备了负载拉帕替尼的HSA纳米颗粒[40]。该纳米颗粒具有球形和均匀的核壳结构特征, 其平均粒径约为140 nm, 载药量和包封率分别为(6.06±0.18)%和(84.9±2.45)%, 且粒径分布窄(PDI=0.189)。
2016年, Thao等采用nabTM技术,制备了负载免疫抑制剂他克莫司(tacrolimus, TAC)的HSA纳米颗粒, 颗粒粒径为(185.8±6.8)nm, 包封率(79.3±3.7)%[41]。TAC-HSA纳米颗粒可以显著提高TAC的水溶性(46倍), 同时其抗关节炎活性明显高于静脉注射TAC和口服TAC悬浮液。
2.5 热凝胶
热凝胶化是一个包括蛋白质间相互作用(氢键、静电、疏水相互作用和二硫键-巯基交换反应等)和热诱导去折叠化的连续过程。该方法优势在于操作简便, 不需要使用交联剂, 制备的白蛋白纳米颗粒具有良好的稳定性, 缺点在于不适用于热敏感性药物分子。
2010年, Qi等通过加热壳聚糖和BSA-葡聚糖共轭物的混合物, 制备了生物相容性良好的BSA-葡聚糖-壳聚糖纳米颗粒[42]。BSA构成纳米颗粒的核心, 部分壳聚糖通过与BSA之间的静电引力被包裹在纳米颗粒中间部位, 其余的壳聚糖和葡聚糖链在纳米颗粒壳中延伸。调整混合物的pH值至7.4后, 阿霉素可以通过与纳米颗粒的静电和疏水相互作用,有效地负载到纳米颗粒中去。纳米颗粒可以在生理环境下稳定在130~230 nm, 同时大大降低阿霉素的体内毒副作用。
2.6 喷雾干燥
喷雾干燥是将物料从液态转变为粉末状材料的过程, 典型的喷雾干燥过程包括4个步骤, 即物料的雾化、通过干燥气体干燥、微粒形成和颗粒收集[43]。喷雾干燥具有生产过程简单、干燥速度快、适用范围广、产物分散性好等优点, 在乳制品、洗涤剂、水泥、医药等工业生产中广泛应用。然而, 传统的喷雾干燥装置难以捕获粒径小于2 μm的颗粒, 并且干燥过程中温度较高的湍流热空气易使白蛋白失活, 因而不适用于白蛋白纳米颗粒的制备。2011年, Lee等使用配备有超声驱动振动网格和静电粒子收集器的新型纳米喷雾干燥仪B-90, 以Tween 80作为表面活性剂, 制备得到了中值粒径为460±10 nm、具有光滑球形表面的BSA纳米颗粒[44]。B-90通过层流加热系统, 使气体通过热的多孔金属泡沫层而受热, 这种加热方式能够优化能量输入, 进口温度为120 ℃时, 出口温度介于51~55 ℃, 因此能够温和地干燥BSA纳米颗粒, 保持BSA的结构稳定性。在制备过程中, 喷雾干燥器的网格尺寸及表面活性剂浓度对产物BSA纳米颗粒的粒径和形貌有较大的影响。
2013年, Yu等制备了具有近红外吸收特性的Au2Se/Au核-壳纳米材料, 与BSA混合后,利用喷雾干燥法制备得到包裹Au2Se/Au的BSA纳米颗粒, 并通过热变性进行固化, 颗粒粒径为450~600 nm。吸附疏水性光敏剂锌酞菁后, 该复合纳米颗粒可以用于肿瘤的光热/光动力协同治疗[45]。
2.7 自组装
自组装法是通过一定方法增加白蛋白分子疏水性, 包括还原白蛋白分子内部二硫键、热处理或加入变性剂等, 之后药物分子与白蛋白的疏水域结合, 介导白蛋白自组装成纳米颗粒。常用的还原剂包括β-巯基乙醇、二硫苏糖醇以及半胱氨酸等[46-47]。部分自组装法操作与去溶剂化法十分相似。
2016年, Tang等利用自组装法,成功制备了粒径为150 nm的多西紫杉醇纳米颗粒[48]。基本过程为:在搅拌条件下,向HSA水溶液中加入二硫苏糖醇, 再缓慢加入多西紫杉醇的乙醇溶液, 溶液变为浅蓝色表明纳米粒子形成, 产物过滤后冷冻干燥保存。利用该方法制备的纳米颗粒具有较高的载药量和包封率, 同时避免了其他制备方法中残留有机溶剂导致的毒性。
2013年, Yuan等利用自组装法,制备了负载阿霉素(DOX)的HSA纳米颗粒[49]。在搅拌条件下,向HSA溶液中加入β-巯基乙醇, 用NaOH溶液调节pH值至10后加入一定量的DOX·HCl, 悬浮液经超滤去除游离的DOX和β-巯基乙醇, 最后调节溶液的pH值至7左右, 生成的纳米颗粒经冷冻干燥后保存。在制备过程中,需将HSA溶液的pH值调整为10,以除去DOX·HCl中的HCl, 改变药物的水溶性。测得纳米颗粒的粒径为(120.1±26)nm, 载药量和包封率分别为4.3%和99.2%。体内实验表明, 该纳米颗粒具有良好的药物缓释性, 有助于减少用药量,且与游离阿霉素相比, 其最大耐受剂量由10 mg/kg增加到30 mg/kg。
ICG是一种近红外染料, 具有荧光成像和光声成像功能, 同时还可以将吸收的光能转换为热能并诱导ROS生成, 从而能用于光热疗法和光动力学疗法。2014年, Sheng等通过向ICG和HSA的混合溶液中加入GSH, 还原HSA分子内二硫键, 之后向混合溶液中加入乙醇,诱导HSA和ICG组装为纳米颗粒(HSA-ICG)(见图5)[10]。纳米颗粒的水动力学直径为(75±2.4)nm, ICG负载量为11.0%,经静脉注射入4T1移植瘤小鼠模型体内后,能够靶向性富集在肿瘤区域;同时在近红外光照射下,显著诱导ROS生成和温度升高,有望用于成像制导的肿瘤光动力/光热协同治疗。
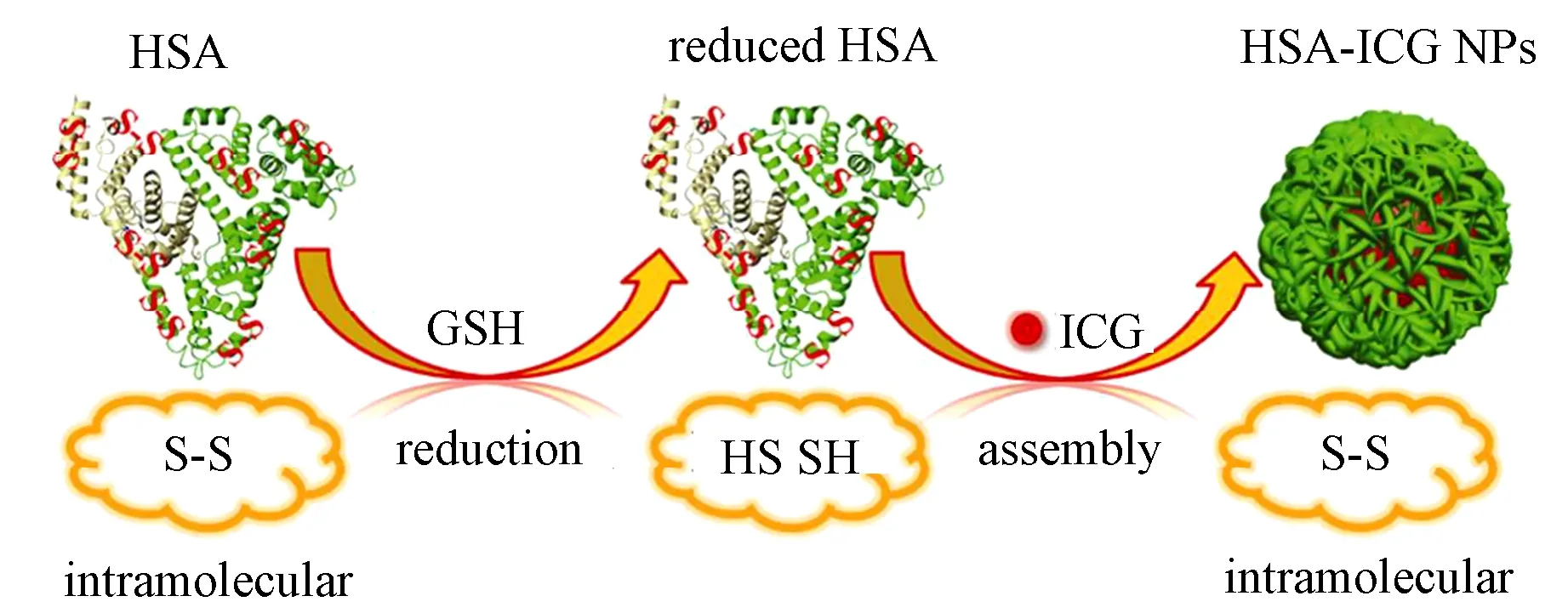
图5 HSA-ICG纳米颗粒的制备原理[10]Fig.5 Schematic illustration of the programmed assembly strategy for the preparation of HSA-ICG nanoparticles[10]
2014年, Asghar等利用热驱动,实现无还原剂自组装紫杉醇BSA纳米颗粒的合成[50]。BSA溶解在25 mM Tris缓冲液中, 在65~75 ℃恒温水浴中搅拌一定时间, 逐滴加入10 mg/mL 紫杉醇的乙醇溶液, 继续搅拌一定时间后,经冷水浴冷却到室温以终止反应。颗粒粒径受BSA浓度、pH值、水浴温度和紫杉醇/BSA比例的影响, 样品的粒径在188~482 nm范围内, 药物包封率为72.5%~87.9%, 有效产率为80%~93.8%。该方法不需要交联剂或对白蛋白进行化学修饰, 因而降低了生产成本;不足之处在于高温操作可能会引起热敏感型药物或生物分子等热降解[41]。
2015年, Chen等制备了光敏剂chlorin e6(Ce6)修饰的HSA, Ce6能够与Mn2+螯合, 实现核磁共振成像功能; 同时制备了肿瘤血管内皮靶向性Arg-Gly-Asp(RGD)三肽修饰的HSA, 利用紫杉醇诱导两种修饰的HSA自组装,得到纳米颗粒[51]。该纳米颗粒不仅具有肿瘤靶向性, 同时还能实现肿瘤的荧光/核磁共振成像以及光热/化疗的协同治疗。
2016年, Lin等利用自组装法,制备了能够穿透血脑屏障的BSA纳米颗粒[52]。先将低分子量鱼精蛋白(low molecular weight protamine, LMWP)与BSA共价结合(LMWP-BSA), 再向LMWP-BSA的尿素溶液中加入硼氢化钠使BSA变性, 暴露疏水区域, 继而加入疏水性化疗药物紫杉醇和芬维A胺的乙醇溶液, 最后加入水诱导LMWP-BSA自组装, 得到负载紫杉醇和芬维A胺的LMWP-BSA纳米颗粒。通过gp60和SPARC介导的靶向作用, LMWP-BSA纳米颗粒可以穿透血脑屏障与神经胶质瘤细胞结合, LMWP修饰可以显著提高纳米颗粒穿透血脑屏障的能力, 同时增加肿瘤细胞对纳米颗粒的摄取。
2017年, Safavi等采用一种无还原剂的室温自组装技术制备负载姜黄素的BSA纳米颗粒(CCM-BSA-NPs)[53]。该研究表明, 使用高离子强度的缓冲溶液,能够在没有还原剂的情况下, 在25 ℃有效地制备CCM-BSA-NPs, 最终得到的纳米颗粒粒径为(110±6)nm, 载药量为7.1%, 产率为88.5%。该方法操作简便且产率较高, 可推广用于制备负载其他疏水性药物的白蛋白纳米颗粒。
2.8 pH凝聚法
改变溶液的pH值,可以有效调节白蛋白在水中的溶解度及其电离程度, 在此基础上加入乙醇等有机溶剂, 可以促使白蛋白析出为纳米颗粒, 相当于改进的去溶剂化法。该方法缺点与去溶剂化法类似, 同样需要使用戊二醛等交联剂, 可能会具有潜在的毒副作用。
1993年, Lin等首次采用pH凝聚法,制备了粒径在100 nm左右的球形HSA纳米颗粒。向不同pH值(7~9)的HSA水溶液中逐滴加入丙酮至系统出现浑浊, 经戊二醛交联后得到纳米颗粒。随溶液pH值的增加, HSA电离增加使颗粒尺寸减小[54]。
2001年,Lin等将溶解有模型药物玫瑰红的HSA溶液室温避光孵育30 min,用NaOH调节pH值至9, 逐滴加入丙酮, 经戊二醛交联得到玫瑰红质量分数为5%的纳米颗粒[55]。
2014年, Wilson等通过pH凝聚法,制备了负载有加巴喷丁的BSA纳米颗粒。首先将加巴喷丁溶解在BSA溶液中, 调节溶液pH值至7~8, 在搅拌下用注射器以1 mL/min的速度加入乙醇,直至溶液中出现混浊, 得到的纳米颗粒经戊二醛交联后冷冻干燥,得到粉末颗粒。纳米颗粒的粒径约为141.9 nm, 经聚山梨醇酯80包覆后能够增强药物的脑靶向性[56]。
3 总结与展望
白蛋白由于良好的生物相容性、无免疫原性、可生物降解等特性, 被广泛用于药物递送系统的制备。在目前主要的白蛋白纳米颗粒制备工艺中, 热凝胶、纳米喷雾干燥、双乳化法通常用于制备负载亲水性药物的白蛋白纳米颗粒, 而去溶剂化法、乳化法、自组装、nabTM技术、pH凝聚法则适用于负载疏水性药物的白蛋白纳米颗粒。
虽然白蛋白是良好的纳米药物载体材料, 但由于HSA来源有限, 而BSA用于注射会有轻度的免疫反应, 导致白蛋白纳米颗粒的实际临床应用受到一定限制。近年来,由酵母细胞表达的重组人血清白蛋白(rHSA),因其生物相容性、药代动力学过程都与HSA接近, 可作为HSA的替代品用于白蛋白纳米颗粒的制备,这是今后白蛋白纳米颗粒的一个重要发展方向。
如何稳定白蛋白纳米颗粒是目前制备技术上的难点。戊二醛等交联剂常被用来稳定得到纳米颗粒, 但是残留的戊二醛对生物体有显著的毒副作用[19,22]。基于二硫键形成的nabTM技术以白蛋白作为基质和稳定剂, 避免了使用交联剂造成的醛类物质残留、毒性大等问题。自组装法利用疏水相互作用,使白蛋白和药物结合成为纳米颗粒[57]。这两种方法能够获得生物安全性较高的白蛋白纳米颗粒, 有望在未来得到更广泛的应用。
此外, 在合成白蛋白纳米颗粒的过程中, 不同的制备条件对产物的尺寸、粒径分布、载药量及药物包封率等性质影响显著。随着制备工艺的不断优化, 白蛋白纳米颗粒的规模化生产必将推动其在临床上的应用。

