三维适形放疗与调强放疗对局部晚期非小细胞肺癌患者疗效及血清血管内皮生长因子、外周血免疫因子的影响
张尧天,温凤云,于子涵,张娜
中国医科大学肿瘤医院/辽宁省肿瘤医院放疗科,沈阳 1100420
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺部常见的一种恶性肿瘤[1]。早期NSCLC具有较高的隐匿性,因此多数患者确诊时已至中晚期,失去了手术治疗的机会。三维适形放疗(three-dimensional conformal radiation therapy,3D-CRT)是临床治疗中晚期NSCLC的重要方法。但是,由于肺部解剖结构较为特殊,大剂量3DCRT常易危及肺组织、食管及脊髓,导致放射性肺炎等并发症,严重影响患者预后[2]。调强放疗可以提高靶区的适形度及均匀性,降低正常组织的照射剂量,降低并发症发生率,已应用于临床。血管内皮生长因子(vascular endothelial growth factor,VEGF)可以促进NSCLC的血管形成,与NSCLC的复发、转移密切相关[3];而免疫因子可以破坏、排斥、清除抗原,维持人体健康。本研究对3D-CRT与调强放疗应用于局部晚期NSCLC的临床治疗效果及其对血清VEGF、外周血免疫因子的影响进行探讨,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月至2015年12月于辽宁省肿瘤医院接受治疗的局部晚期NSCLC患者的病历资料。纳入标准:①经细胞学和(或)病理学检查确诊为NSCLC;②首次行放化疗;③生存时间>90天;④具有客观可测量的病灶。排除标准:①合并脑部转移者;②依从性较差者;③孕期、哺乳期女性。根据纳入和排除标准,本研究共纳入局部晚期NSCLC患者88例,其中男性39例,女性49例;年龄37~80岁,平均年龄(57.64±5.81)岁;病理分型:腺癌65例,鳞癌16例,鳞腺癌4例,其他3例;TNM分期:Ⅲa期32例,Ⅲb期56例。根据放疗方法不同将患者分为A组和B组,每组44例。两组患者的性别、年龄、病理分型、TNM分期、功能状态评分、病灶位置比较,差异均无统计学意义(P>0.05)(表1),具有可比性。
1.2 治疗方法
A组患者行3D-CRT联合化疗治疗,B组患者行静态调强放疗联合化疗。
1.2.1 化疗 两组患者均于放疗前行紫杉醇联合卡铂方案化疗,具体方法:第1天,40 mg/m2紫杉醇,静脉滴注;卡铂(AUC=2),静脉滴注,21天为1个治疗周期,共进行4个周期化疗。化疗前给予苯海拉明、地塞米松等药物预防过敏反应,化疗期间依据实际情况给予患者粒细胞集落刺激因子等药物支持治疗。

表1 两组患者的基本临床特征
1.2.2 放疗 固定患者体位,以计算机体层摄影(CT)定位勾画大体肿瘤靶区(gross tumor volume,GTV),外扩6~8 mm为临床靶区(clinical target volume,CTV),然后再外扩 5~10 mm 为计划靶区(planning target volume,PTV),同时对正常肺组织、心脏、食管、脊髓等危及器官进行勾画。A组患者行3D-CRT(3~5野)放疗,以病变范围为高剂量靶区,以尽量保护正常组织为基本原则,治疗中心选取GTV的几何中心,共面等中心照射,照射期间适当调整不同照射野的权重、楔形板高度及入射角度,确保靶区和高剂量区适形;A组患者的总照射剂量为66 Gy,每天1次,每次2 Gy,每周5次,95%PTV≥处方剂量。B组患者行静态调强放疗(5野),以逆向原理设计照射计划,治疗中心选取PTV的几何中心,照射时兼顾靶区、脊髓照射量以及正常肺组织、心脏的受照容积;B组患者的总照射剂量为60 Gy,每天1次,每次2 Gy,每周5次,95%PTV≥处方剂量。
1.3 观察指标及评价标准
比较两组患者的近期疗效及治疗期间不良反应发生情况,并对两组患者治疗前及治疗后180天血清VEGF亚型(VEGFA、VEGFB、VEGFC)水平、外周血免疫因子(CD3+CD4+T细胞、CD3+CD8+T细胞、CD4+/CD8+T细胞)水平进行比较。
依据实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[4]对两组患者治疗后的临床疗效进行评价:完全缓解(CR),所有病灶完全消失,至少维持4周;部分缓解(PR),病灶最大直径总和减小≥30%,至少维持4周;疾病稳定(SD),病灶最大直径总和减小未达PR,或增加未达疾病进展(PD);PD,病灶最大直径总和增加≥20%或出现新病灶。病灶变化情况依据影像学检查结果进行评价。疾病控制率=(CR+PR+SD)例数/总例数×100%;客观有效率=(CR+PR)例数/总例数×100%。采用酶联免疫吸附试验检测VEGF亚型水平,采用流式细胞仪检测免疫因子水平。以美国国家癌症研究所不良反应分级标准V2.0(National CancerInstitute Common Toxicity Criteria Version 2.0,NCICTC V2.0)[5]评价放疗相关不良反应,依据不良反应严重程度分为0~5级:0级,无不良反应;1级,轻度不良反应;2级,中度不良反应;3级,重度不良反应;4级,威胁生命的不良反应;5级,死亡。
1.4 统计学方法
采用SPSS 19.0统计软件对数据进行分析。计数资料以例数和率(%)表示,组间比较采用χ2检验;有序分类变量比较采用Man-n-WhitneyU秩和检验;计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
两组患者的临床疗效比较,差异无统计学意义(P>0.05);A组和B组患者的疾病控制率分别为93.2%(41/44)、95.5%(42/44),差异无统计学意义(P>0.05);A组和B组患者的客观有效率分别为72.7%(32/44)、77.3%(34/44),差异无统计学意义(P>0.05)。(表2)

表2 两组患者的临床疗效[n(%)]
2.2 血清VEGF亚型水平的比较
治疗前,两组患者的血清VEGFA、VEGFB、VEGFC水平比较,差异均无统计学意义(P>0.05);治疗后180天,两组患者的血清VEGFA、VEGFB、VEGFC水平均低于本组治疗前,差异均有统计学意义(P<0.05);治疗后180天,两组患者的血清VEGFA、VEGFB、VEGFC水平比较,差异均无统计学意义(P>0.05)。(表3)
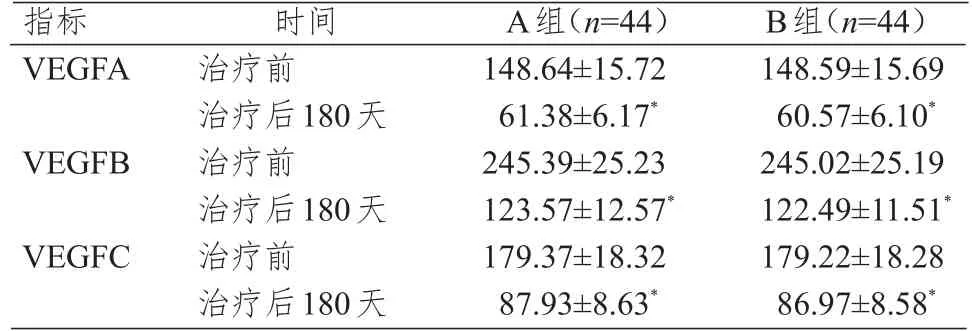
表3 两组患者-治疗前后血清VEGF亚型水平的比较(ng/ml,x±s)
2.3 外周血免疫因子水平的比较
治疗前,两组患者的外周血CD3+CD4+T细胞、CD3+CD8+T细胞、CD4+/CD8+T细胞水平比较,差异均无统计学意义(P>0.05);治疗后180天,两组患者的外周血CD3+CD4+T细胞、CD4+/CD8+T细胞水平均高于本组治疗前,CD3+CD8+T细胞水平均低于本组治疗前,差异均有统计学意义(P<0.05);治疗后180天,两组患者的外周血CD3+CD4+T细胞、CD3+CD8+T细胞、CD4+/CD8+T细胞水平比较,差异均无统计学意义(P>0.05)。(表4)
表4 两组患者治疗前后免疫因子水平的比较(±s)
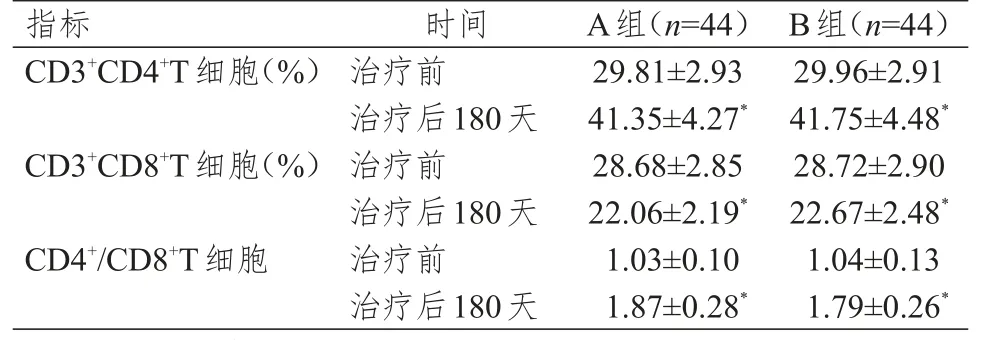
表4 两组患者治疗前后免疫因子水平的比较(±s)
注:*与本组治疗前比较,P<0.05
?
2.4 治疗期间不良反应发生率的比较
治疗期间,A组患者放射性食管炎的总发生率为56.8%(25/44),高于B组患者的31.8%(14/44),差异有统计学意义(χ2=5.572,P=0.018);A组患者放射性肺炎的总发生率为38.6%(17/44),高于B组患者的18.2%(8/44),差异有统计学意义(χ2=4.526,P=0.033)。(表5)

表5 两组患者治疗期间的不良反应发生情况[n(%)]
3 讨论
3D-CRT可以精确定位靶区,在提高病灶局部控制率的同时,尽量避免损伤正常组织,是目前临床治疗局部晚期NSCLC的重要方法[6]。但在3DCRT治疗局部晚期NSCLC的剂量选择上,仍存在一定争议。De Ruysscher等[7]研究表明,高剂量放疗能够引起强烈的不良反应,接受高剂量放疗(74 Gy)患者的生存率(54%)明显低于接受低剂量放疗(60 Gy)的患者(67%)(P=0.002)。Kong 等[8]研究发现,放疗剂量<70 Gy患者的中位总生存时间为18.2(10.9~25.4)个月,明显短于放疗剂量>70 Gy患者的41.9(20.6~63.1)个月(P=0.003)。本研究结果显示,尽管A组患者的放疗剂量高于B组(66 Gyvs60 Gy),但两组患者的疾病控制率和客观有效率比较,差异均无统计学意义(P>0.05),主要是由于调强放疗可以准确评价靶区照射剂量及其周围组织的耐受剂量,并优化配置射野内不同线束的权重,确保剂量分布区与靶区的形状在三维方向上相一致,从而有效提高照射效率。
已有研究表明,恶性肿瘤的发生与机体免疫功能较低关系密切[9]。细胞免疫是T淋巴细胞介导的重要免疫方式,CD3+CD4+T细胞与CD3+CD8+T细胞是机体内不可或缺的T淋巴细胞,在机体免疫功能的调节中发挥着重要的作用[10]。相关研究表明,CD3+CD4+T细胞不仅能够生成多种细胞因子,同时还可以启动免疫应答,以抵抗肿瘤。CD3+CD8+T细胞为杀伤性T细胞,可分化为细胞毒性T细胞、肿瘤细胞或感染细胞。若机体CD4+/CD8+T细胞水平降低,机体的免疫功能则会受到抑制,从而导致肿瘤细胞免疫逃逸[11]。由于肿瘤细胞对机体的免疫功能具有较强的抑制作用,因此清除肿瘤细胞可以有效解除免疫抑制[12]。林冠宏[13]研究表明,化疗联合中药治疗可以有效改善患者的T淋巴细胞水平,改善患者预后。本研究结果显示,治疗后,两组患者的免疫因子水平均较治疗前改善,差异均有统计学意义(P<0.05),且两组患者治疗后的免疫因子水平比较,差异均无统计学意义(P>0.05),表明3D-CRT与调强放疗联合化疗均可以有效杀灭肿瘤细胞,改善患者的免疫因子水平。
新生血管是肿瘤细胞增殖、侵袭以及转移的病理生理基础,抑制新生血管形成可以有效阻断肿瘤的进展[14]。已有研究表明,VEGF为促血管生成因子,对肿瘤新生血管生成、提高微血管通透性及促进肿瘤进展和转移具有重要作用[15]。VEGF与肿瘤的形成关系密切[16]。李晓平等[17]研究发现,VEGF水平越高,肺癌的浸润范围越广,远处转移率越高。杨会杰等[18]研究发现,VEGF水平与肿瘤的恶性程度及淋巴结转移呈正相关。付宝红等[19]研究发现,放疗前NSCLC患者的VEGF水平越高,疗效越差。梁宏等[20]将3D-CRT应用于复发性小细胞肺癌的临床治疗,放疗后患者的VEGF水平明显低于放疗前,且其疗效与患者的VEGF水平密切相关。本研究结果显示,两组患者治疗后的VEGF亚型水平均较本组治疗前降低(P<0.05),但两组患者治疗后的VEGF亚型水平比较,差异均无统计学意义(P>0.05)。提示3D-CRT与调强放疗联合化疗均可以有效降低晚期局部NSCLC患者的血清VEGF水平。另外,本研究结果还显示,治疗期间,A组患者放射性肺炎和放射性食管炎的发生率均高于B组(P<0.05),提示较大剂量放疗可为患者带来较大的不良反应。
综上所述,3D-CRT(66 Gy)与调强放疗(60 Gy)联合化疗均可以有效改善局部晚期NSCLC患者的免疫功能,降低血清VEGF水平,且疗效相近,但调强放疗的放射总剂量少,不良反应更小,更具有临床应用价值。

