女性盆腔肿物的影像诊断思维
张素芳 解骞 毕海霞 梁宗辉
病例资料患者,女,30岁,体检偶然发现右卵巢肿物,近一周患者自觉下腹胀。既往月经规则,月经量中等,无痛经,末次月经量较前减少。复查超声提示子宫前方混合块,卵巢肿瘤可能(生殖细胞来源?)。免疫检验报告:AFP大于3 000 ng/ml,CA125:178.40U/ML。CEA:6.3 ng/ml,癌胚抗原3.79 ng/ml。促卵泡成熟素4.61 mIU/ml,黄体生成激素8.80 mIU/ml,催乳素349.04 mIU/ml,睾 酮1.27 mIU/ml,雌二醇126.00 mIU/ml,孕酮4.25 mIU/ml,人绒毛膜促性腺素<0.6 mIU/ml。碱性磷酸酶48 u/l。
影像表现CT检查示盆腔内巨大囊实性肿物,可见囊壁及分隔,壁厚薄不均匀,边界清楚,增强后囊壁、分隔及实质成分明显强化,瘤体内可见较多增生血管影,下端可见多发小分隔,周围器官组织推移,肠间隙内可见液体密度影。卵巢等附件显示不清楚。腹膜后淋巴结肿大。考虑卵巢囊腺癌可能,请结合临床其他检查。
手术记录:术中见右侧卵巢增大,20 cm×17 cm×7 cm大小,呈多发囊性,包膜光滑,右卵巢动静脉曲张,右侧输卵管拉长变性,术中冰冻:右侧附件卵巢生殖细胞肿瘤,冰冻片示卵黄囊瘤。患者已婚未育,为保留生育功能,故行大网膜切除术、盆腔淋巴结清扫加盆腔腹膜多点活检术。术后化疗4次后AFP及CA125分别为:大于3 000 ng/ml、24.50U/ml;322.34 ng/ml、10.20 U/ml;29.65 ng/ml、8.7 U/ml;7.06 ng/ml、7.10 U/ml。
病理结果:腹腔冲洗液脱落细胞学检查见血细胞、炎症细胞、间皮细胞。大网膜见肿瘤累及。(腹膜活检)纤维结缔组织,未见肿瘤累及。右髂总血管旁、双髂淋巴结均未见肿瘤转移。(左髂总)为纤维脂肪组织。(右附件)卵巢卵黄囊瘤,输卵管未见癌累及。免疫组化:CK7(-),CK20(-),villin(+),CDX2(-),CD30(-),AFP(+),Ki-67(+,50%),SALL4(+),Oct-4(-),GLYPICAIN-3(-),PLAP(-),d2-40(-),NaPsinA(-)。
讨论卵黄囊瘤(yolk sac tumor,YST),又称内胚窦瘤(endodermal sinus tumor,EST),是由Teilum G[1]在1959年通过比较该病瘤组织与大白鼠胎盘内胚窦瘤结构相似而提出的,后经研究证实YST肿瘤细胞起源于原始生殖细胞,其形态结构与人胚胎期的卵黄囊相似,因此正式命名为卵黄囊瘤[2]。YST分为性腺和非性腺YST,其中以性腺YST多见,包括睾丸和卵巢;非性腺YST少见,常发生于头颈部、骶尾部、腹膜后、纵隔、胃、肝脏、松果体和阴道等[3]。YST是婴幼儿期及青春期最常见的生殖细胞肿瘤,卵巢YST的发生率仅占卵巢恶性肿瘤的1%。
卵巢YST可发生于任何年龄,好发于儿童及青年女性,发病中位年龄为19岁;早期临床症状不明显,病变快速生长时压迫邻近脏器出现非特异性症状,常以腹胀、腹痛及腹部包块就诊,而月经紊乱等症状少见。卵巢YST多为单侧受累,且以右侧多见[4];肿瘤体积较大,长径一般超过10 cm;肿瘤形态不一,可为规则的圆形/卵圆形,或为不规则形;大多表面光滑,有完整包膜;由于瘤体巨大,常出现扭转、出血及坏死等继发性改变,且容易出现复发及转移,预后较差。常见的转移途径为直接浸润和种植转移,淋巴道和血运转移则相对较少见。
YST可合成并分泌大量甲胎蛋白(AFP),术前血清中AFP含量可高达14 000~200 000μg/L(AFP正常值0~20μg/L),切除肿瘤后,AFP含量可逐渐降至正常水平,术后肿瘤复发时,AFP含量迅速升高,因此血清AFP含量可作为诊断YST的特征性指标之一。本病例术前平均血清AFP含量大于3 000μg/L,明显高于正常水平,术后经过4次化疗后血清AFP含量降至正常。
卵黄囊瘤的影像学表现与其大体表现及组织成分有关:病变较小时多呈实性,较大的病变多表现为囊实性,其内可见出血、钙化及脂肪,但较少见。CT平扫肿瘤呈等密度或等低混杂密度,伴出血时可呈不均匀高密度,钙化与脂肪的密度具有一定特征性。MRI平扫实性肿瘤或肿瘤的实性部分T1WI呈等偏低信号、T2WI呈等偏高信号,DWI多呈略高信号;囊性部分的信号与瘤内所含液体成分有关,以水为主时呈T1WI低信号、T2WI高信号,DWI呈低信号;黏液较多时T1WI信号偏高、T2WI信号偏低,DWI信号升高;伴有出血时可见其内有T1WI、T2WI高信号区;MRI对细小钙化不敏感,较大的钙化呈T1WI、T2WI低信号;脂肪在T1WI、T2WI上呈高信号,DWI为脂肪抑制序列故呈低信号。由于YST血管迂曲丰富、粗细不等,增强扫描后实质性肿瘤和肿瘤的实性部分呈显著不规则强化,延迟期持续强化,且强化范围逐渐扩大;瘤体内或囊壁分隔内可见走行迂曲的血管影,此为本病的特征性表现之一[5]。与本病例中肿块较大、囊实性为主,且可见明显强化的血管影相符。
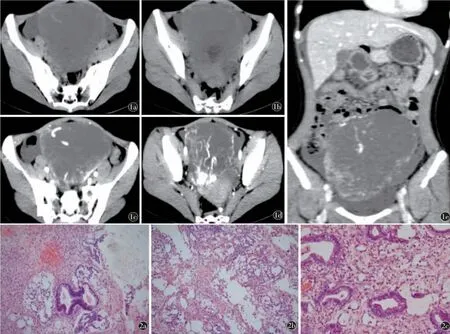
图1 a)CT平扫示盆腔内巨大囊实肿物,可见囊壁及分隔,壁厚薄不均。b~d)增强扫描示囊壁、间隔及实质部分明显强化,瘤体内较多增生扭曲血管影。卵巢等附件显示不清;e)冠状位CT增强示腹腔内团块影,与周围结构分界欠清,瘤内可见迂曲强化血管影图2 a)HE(10×10)多囊状卵黄囊样区域见梨形泡结构;b)HE(10×10)疏松空泡性蜂窝网状大小不等的囊腔或管,内衬扁平或立方形细胞;c)HE(10×20)腺泡-腺管结构,内衬扁平或立方形细胞
卵巢YST需要其他以囊性为主的卵巢恶性肿瘤相鉴别如浆液性或黏液性囊腺癌,其发病年龄一般40~60岁,多囊实性、单房或多房,壁及分隔可厚薄不均,可有壁内结节和颗粒样钙化,通常CA125升高,AFP正常;大量脂肪成分的存在常提示未成熟畸胎瘤;但与原始生殖细胞肿瘤不同类型如混合性生殖细胞瘤和无性生殖细胞瘤等的鉴别则主要依靠病理学、血清学及免疫组化。
影像诊断思维女性盆腔肿物病变的影像诊断,与其他部位肿物病变的诊断原则一样:首先是判断病变的起源,是起源于女性生殖系统的子宫、卵巢或输卵管,还是起源于肠道、腹膜等部位的肿瘤累及到女性生殖系统;其次是判断肿瘤的良恶性,恶性肿瘤要判断是否有周围结构的侵犯,是否有淋巴结的转移等,这些特征决定了治疗方案的选择。这也是影像诊断中一直强调的“先定位,后定性,再分期”的原则。
对于较大的病灶而言,往往与周围结构关系密切,使判断病变的起源形成困难。此时,要首先考虑与病变关系最密切的组织和器官,找不到正常的器官就要考虑是否该器官起源的病变,譬如肾上腺起源的巨大肿瘤往往与肾脏、肝脏、后腹膜关系密切,但肾上腺本身找不到则是病变起源于肾上腺的一个证据。此例病变较大,占据盆腔并向腹腔生长,子宫向后下方推移,而附件结构显示不清,提示病变起源于附件尤其是卵巢的可能性较大;同时,女性盆腔内巨大囊实性肿物病变,往往是卵巢肿瘤的特征之一,也是病变起源于卵巢的证据之一。这也是术前诊断首先考虑附件起源肿瘤的理由。
对于女性盆腔肿物病变的定性而言,巨大、生长迅速的肿瘤往往提示肿瘤为恶性或者具有恶变的倾向。从肿瘤本身的表现来看,实质性肿瘤表现为密度/信号不均匀,出现囊变、出血、坏死等继发改变、强化不均匀等往往提示恶性的可能;囊性肿瘤出现囊壁不规则增厚、实性成分增多、囊内分隔增厚、实质成分强化不均匀等亦提示恶性的可能。此例虽为体检发现,但在患者无明显症状的情况下发现巨大肿瘤,表明该肿瘤生长迅速;病灶表现为囊实性,但囊壁明显增厚且不规则,强化不均匀并可见多发血管影;肿瘤虽然边界清晰,但与周围结构关系密切;这些特点都提示肿瘤为恶性的可能性大。
对于卵巢肿瘤而言,其影像学表现与病理分类密切相关,包括上皮性肿瘤、生殖细胞瘤、性索间质细胞肿瘤、颗粒细胞瘤、卵泡膜细胞瘤、纤维瘤等,其中上皮性肿瘤最常见,且上皮性肿瘤以囊实性多见,包括浆液性囊腺瘤/癌和黏液性囊腺瘤/癌,好发于青年女性,囊腺瘤与囊腺癌在影像学上的鉴别主要是依靠囊壁、分隔、实性成分、强化等特点,也是术前诊断囊腺癌的原因。但影像学诊断要密切结合临床,囊腺癌一般会出现CEA的升高,而此例AFP升高提示肿瘤为生殖细胞起源。卵巢生殖细胞起源的肿瘤包括无性细胞瘤、畸胎瘤、卵黄囊瘤和绒毛膜癌。儿童和青春期卵巢肿瘤的60%为生殖细胞肿瘤,绝经期后则很少见。此例为青年女性,AFP明显升高,首先要考虑生殖细胞起源的肿瘤。
在生殖细胞肿瘤中,无性细胞瘤好发于青春期及育龄期妇女,血中乳酸脱氢酶(LDH)的显著升高具有一定的特异性。影像学上肿瘤通常为实质性或以实质性为主,可伴有不同程度的出血坏死囊变,实质成分在增强后明显强化,肿块内可见动脉期细隔样强化为其特征表现。而此例以囊性为主,与无性细胞瘤的表现不符合。畸胎瘤可分为成熟畸胎瘤和未成熟崎胎瘤,但往往具有多胚层成分,可见钙化、脂肪甚至牙齿,其中成熟型畸胎瘤以囊性多见,而未成熟型崎胎瘤以钙化为特点,且往往伴有AFP的明显升高。此例以囊性为主,AFP明显升高,但没有钙化,所以不符合畸胎瘤的表现。绒毛膜癌多继发于葡萄胎、流产或足月分娩以后,临床上出现阴道流血等症状,且HCG明显升高,发生于卵巢者为非妊娠性绒毛膜癌。此例临床表现不需要考虑绒毛膜癌。
综上所述,卵巢YST具有一定的影像学特征,肿瘤边界清晰,较小时以实性成分为主,肿瘤越大其囊变成分越多,与周围有粘连或侵犯邻近器官,肿瘤血供丰富,增强扫描后实性部分显著不规则强化,瘤体内可见走行迂曲的血管影,结合本病好发于年轻人及儿童,且生长速度快、肿瘤体积较大、病程短、AFP水平高、常伴有腹腔积液、临床无月经紊乱或激素异常等表现,有助于术前做出明确诊断。

