FLT-PET监测靶向治疗ALK阳性淋巴瘤早期疗效优于FDG-PET
侵袭性非霍奇金淋巴瘤的标准疗法是环磷酰胺-阿霉素-长春新碱-强的松或康速龙锭等类似药物,在B细胞起源的情况下再结合利妥昔单克隆抗体[1],然而并非对所有患者有效,复发性NHL预后不良。以受体信号分子(例如BTK、Syk、PKCb)、抗凋亡蛋白、脱乙酰酶和免疫调节剂为靶标的靶向性小分子药物的研究日益白热化[2,3]。尽管靶向性药物可能对复发的淋巴瘤治疗大有助益,但是其种类繁多。选择合适的生物标靶,对其治疗效果进行有效监测意义重大。准确评估早期疗效,有助于优化治疗方案,避免无效治疗和降低治疗成本。
FDG-PET成像被证实可用于淋巴瘤治疗后的预后分析[4,5]和治疗中的疗效监测[6,7]。这些研究表明,在治疗进行中PET具有预测无进展生存期(PFS)和总生存期的能力。也有研究指出FDG-PET特异性不足、预测价值有限[8-10]。究其原因,可能是FDG并非肿瘤特异性示踪剂,炎症也可引起FDG聚 集[11]。
细胞周期的混乱失调是癌细胞的显著特点,持续不断的增殖活性比葡萄糖代谢的增加在检测恶性肿瘤时更具特异性[12]。FLT是一种稳定的PET示踪剂,可在增殖组织和恶性肿瘤中聚集[13,14]。一些研究显示FLT摄取与肿瘤的增殖具有显著的相关性[15-18]。笔者之前的工作也表明侵袭性淋巴瘤首次治疗后FLT摄取的降低情况与治疗终止时的疗效直接相关[19]。
研究证明50%~60%的间变性大细胞淋巴瘤(ALCL)存在染色体异位并与间变性淋巴瘤激酶(ALK)基因相关,且引起致癌蛋白核仁磷酸蛋白间变性淋巴瘤激酶(nucleophosmin-ALK:NPM-ALK)的过表 达[20,21]。一些研究表明,酪氨酸激酶的活性是NPM-ALK阳性ALCL发病的关键因素,且导致STAT3、PI-3K/Akt和mTOR等信号通路的激活[22,23]。因此,ALK及ALK信号通路便成为治疗ALCL的靶标。除了ALK抑制剂外,正在进行的临床前测试和临床研究表明热休克蛋白90(HSP90)和mTOR的抑制可导致ALK阳性ALCL细胞中ALK降解[24,25]。
本课题中使用HSP90抑制剂NVP-AUY922(AUY922)和mTOR抑制剂癌伏妥对ALK阳性淋巴瘤小鼠进行治疗;并对其行FDG和FLT-PET来监测ALK阳性淋巴瘤对治疗的早期反应。
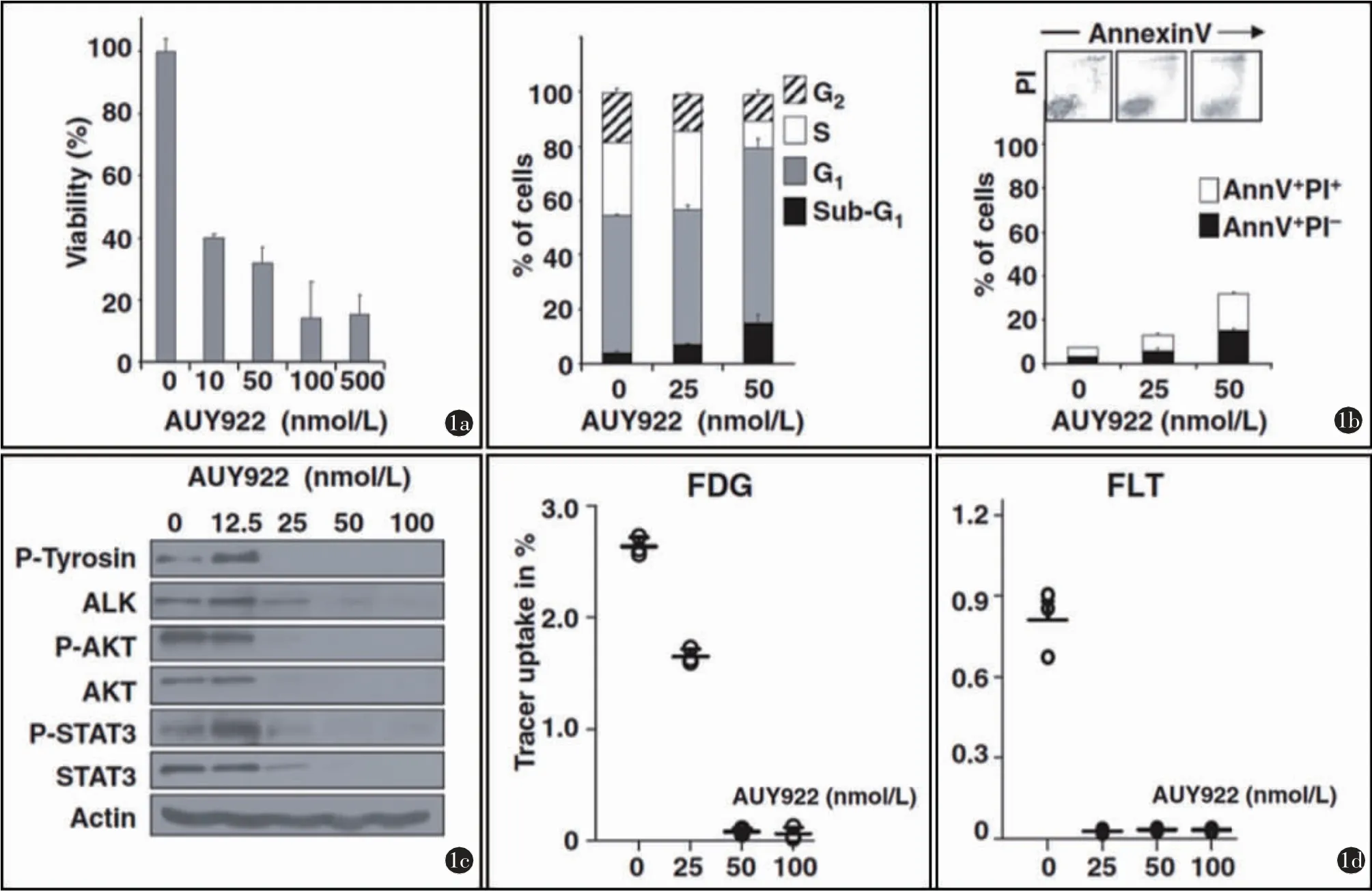
图1 FLT摄取对NPM-ALK阳性ALCL细胞的HSP90抑制治疗反应敏感。SUDHL-1细胞经不同浓度的AUY922处理48 h。a)使用MTT从测量细胞生存率;b)左边是细胞周期检测结果,右边是细胞死亡率结果;c)使用免疫组化监测致癌蛋白表达及磷酸化活性;d)癌细胞FDG和FLT的摄取随AUY922浓度升高而降低
FLT的摄取可显示NPM-ALK阳性ALCL细胞对HSP90抑制剂NVP-AUY922治疗的反应
MTT分析显示SUDHL-1对NVP-AUY922治疗敏感,治疗48 h后,最高疗效浓度为100 nM,50%的抑制浓度(IC50)应小于10 nM(图1a)。AUY922治疗可引起细胞周期停滞和细胞死亡,主要表现为S期细胞量的减少、G0-G1期细胞的大量聚集以及AnnexinV阳性细胞的增加(图1b)。另外,在AUY922干预下磷酸化及总NPM-ALK蛋白表达也随着AUY922浓度的增加而降低(图1c),而且当AUY922浓度为50 nM时,其下游蛋白STAT3和AKT[22]的表达已无法检测到。使用伽马计数器可测得在AUY922干预下,FLT和FDG在SUDHL-1细胞中的摄取也有明显下降,且FLT比FDG更敏感(图1d)。这些数据表明FLT可能比FDG更适合于监测以NPM-ALK为靶标的治疗。
在监测HSP90抑制剂靶向治疗SUDHL-1淋巴瘤时,FLT-PET的预测效果优于FDG-PET
使用SUDHL-1淋巴瘤小鼠模型来研究HSP90抑制,当肿瘤体积达到500 mm3时开始对小鼠进行治疗,治疗时间2周。对照组小鼠的肿瘤体积在整个过程中增加了3倍(图2a)。相反的,AUY922治疗组小鼠的肿瘤体积几乎没有变化。为了评估FDG和FLT-PET在预测治疗效果中的价值,笔者对所有小鼠在治疗前以及治疗开始后5 d行PET显像。在FDG-PET检测中发现对照组小鼠肿瘤的FDG摄取有了显著增加(P=0.03)(图2b),但治疗组的FDG摄取没有明显变化(P=0.151)。相比之下,FLT的摄取却降至治疗前的40%,变化显著(P=0.001)(图2c)。对照组的FLT摄取增至治疗前的200%(P=0.01)。另外,也对SUDHL-1淋巴瘤的病理检测进行了分析,结果显示治疗组肿瘤caspase-3阳性细胞明显高于对照组(P=0.04)(图2d);而Ki-67阳性细胞在治疗组肿瘤中为15.3%,明显低于对照组的63.3%(P=0.03)。总之,FDG及FLT摄取与肿瘤对HSP90抑制的反应直接相关。在肿瘤体积出现明显变化之前,FLT-PET对疗效的评估及预测效果优于FDG-PET。
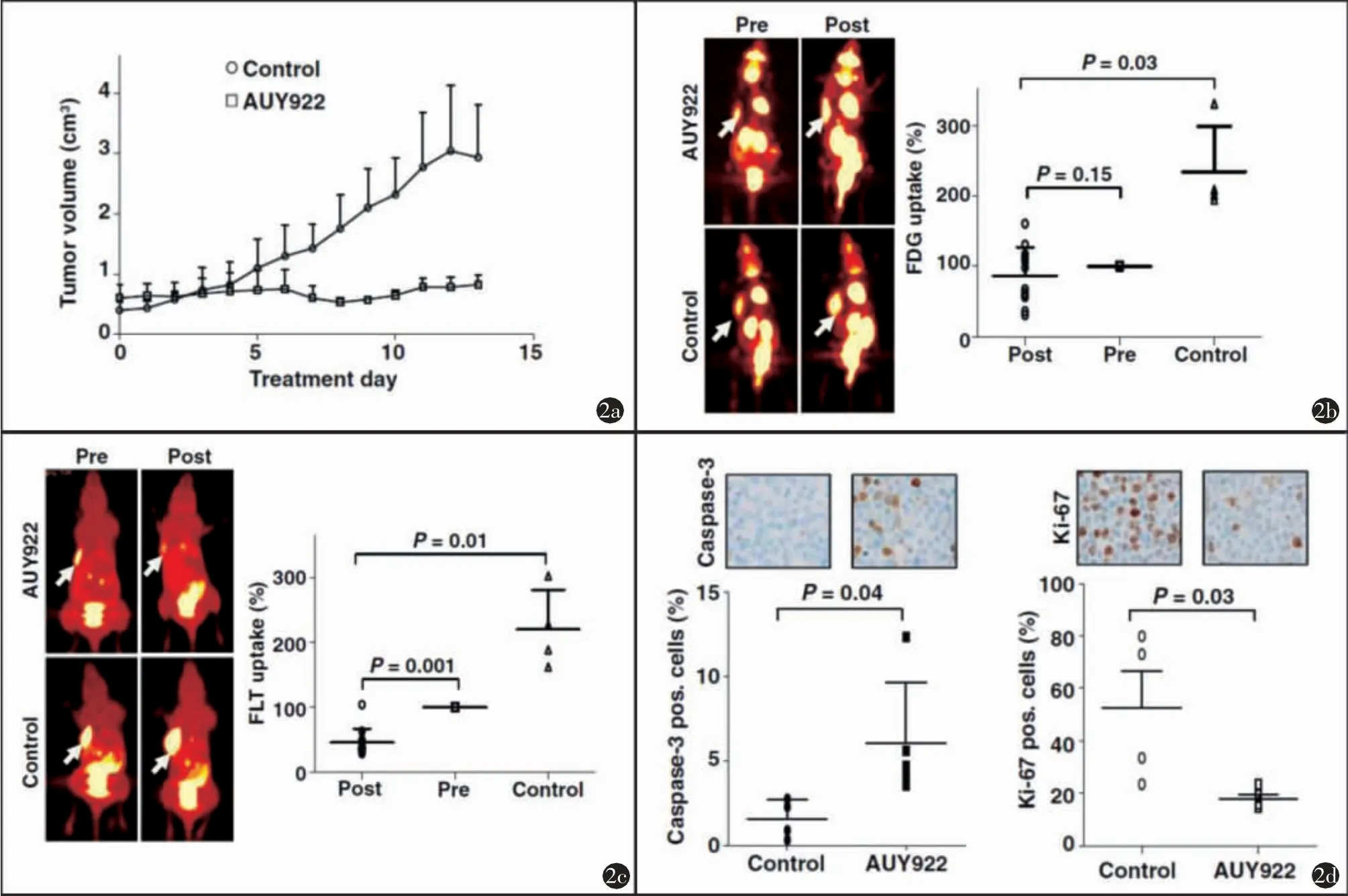
图2 功能成像FLT-PET在监测HSP90抑制治疗SUDHL-1淋巴瘤疗效时比FDG-PET更好。当携带SUDHL-1淋巴瘤的小鼠身上的肿瘤体积达到500 mm3时,开始AUY922的治疗(25 mg/kg,腹腔注射),测量肿瘤体积和FLT以及FDG摄取的变化,病理研究癌细胞Ki-67以及caspase-3的表达,监测14 d。a)SUDHL-1肿瘤生长曲线;b)治疗前及治疗5 d后FDG-PET监测治疗反应的结果;c)治疗前及治疗5 d后FLT-PET监测治疗反应的结果;d)肿瘤细胞中Ki-67以及caspase-3的表达
在监测mTOR抑制剂靶向治疗SUDHL-1淋巴瘤时,FLT-PET的预测效果优于FDG-PET
实验结果显示mTOR的抑制同样可以导致SUDHL-1淋巴瘤生长的停滞(图3a)、FLT摄取的降低(图3c)、caspase-3阳性细胞的增加和Ki-67阳性细胞的减少(图3d),但是FDG摄取在治疗开始5 d后无显著变化(图3b)。因而,实验结果再次表明FLT-PET对早期疗效的评估及预测效果优于FDG-PET。
验证FLT-PET在监测肿瘤对治疗反应的的预测性价值
为了评估FLT-PET对靶向性治疗效果的预测价值,使用不同的表达NPM-ALK淋巴瘤细胞系Karpas299。与SUDHL-1细胞不同,Karpas299淋巴瘤显示出对AUY922治疗的抗性,主要表现为治疗组肿瘤的生长与对照组相似(图4a)。相较而言,癌伏妥的治疗却使肿瘤生长停滞。对所有Karpas299淋巴瘤小鼠在治疗开始前以及治疗后2 d行FLT-PET。与预期相符,对照组和AUY922治疗组肿瘤的FLT摄取无显著差别(P=0.42),其值分别增至治疗前的154%和149%(图4b);值得关注的是在治疗开始后近2 d的时间,癌伏妥就导致治疗组与对照组肿瘤FLT摄取的显著差异(P=0.001),且其预测结果与肿瘤的生长一致。另外,病理检测结果显示癌伏妥的治疗导致显著的肿瘤细胞的死亡(P=0.02),但AU9Y922却没有(P=0.5);癌伏妥治疗组的肿瘤中Ki-67阳性细胞率(37.1%)明显低于对照组(59.9%;P=0.02),而AUY922的治疗只导致略低于对照组的细胞增殖抑制(Ki-67阳性细胞:45.1%;P=0.1)(图4d)。因此,表明FLT-PET成像可用于区分有效与无效的治疗,并对治疗效果有很高的预测价值。
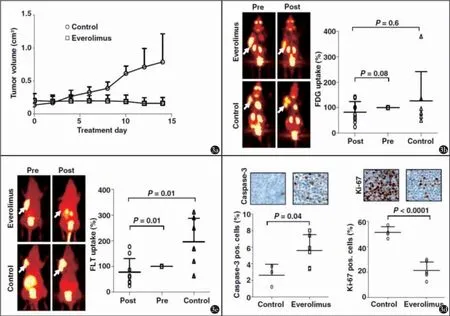
图3 功能成像FLT-PET在监测HSP90抑制治疗SUDHL-1淋巴瘤疗效时比FDG-PET效果更好。当携带SUDHL-1淋巴瘤的小鼠身上的肿瘤体积达到500 mm3时,开始癌伏妥的治疗(5 mg/kg,口服),测量肿瘤体积和FLT以及FDG摄取的变化,病理研究癌细胞Ki-67以及caspase-3的表达,监测14 d。a)SUDHL-1肿瘤生长曲线;b)治疗前及治疗5 d后FDG-PET监测治疗反应的结果;c)治疗前及治疗5 d后FLT-PET监测治疗反应的结果;d)肿瘤细胞中Ki-67以及caspase-3的表达

图4 FLT-PET可以在治疗早期就分辨有效和无效治疗的反应。当携带Karpars299淋巴瘤的小鼠身上的肿瘤体积达到500 mm3时,开始AUY922(25 mg/kg,腹腔注射)或者癌伏妥(5 mg/kg,口服)的治疗,测量肿瘤体积和FLT以及FDG摄取的变化,病理研究癌细胞Ki-67以及caspase-3的表达,监测14 d。A:Karpas299肿瘤生长曲线;B:治疗前及治疗2 d后FLT-PET监测治疗反应的结果;C:肿瘤细胞中Ki-67以 及caspase-3的 表 达
讨 论
随着淋巴瘤发病机制研究进展,大量以致病通路为目标的靶向性药物应运而生[26,27]。为了优化临床试验的设计和治疗管理,确定影像学生物标靶的敏感性和有效性至关重要。并且,这些影像学生物标靶还将大大提高对有效的联合治疗方案的验证效率。因为,尽管在药效学理论中认定的针对特定标靶的治疗会抑制癌症的发展,但在临床实践中未必能够真正实现[28];而且还有许多靶向性药物的药效并未经验证[29]。仅通过遗传谱或致癌途径无法对晚期淋巴瘤患者的靶向治疗的药物疗效进行预测,而常规影像成像检测(如CT或MRI)尚无法对治疗的有效性进行判断,功能性体内成像便可在治疗早期评估和预测肿瘤对靶向性治疗的反应。
本研究中以致癌蛋白ALK通路活性为基础的ALCL细胞被用来评估PET示踪剂FDG和FLT作为早期监测疗效的示踪剂的可靠性。其中,致癌蛋白ALK的活化是NPM-ALK阳性淋巴瘤的特征,并导致PI3K-AKT-mTOR和JAK-STAT信号传导被激活,这两个信号传导途径是癌细胞中关键的生存和增殖途径,并被证实可作为淋巴瘤等恶性疾病的药理学靶标[22,30,31]。HSP90蛋白被认为是抗癌治疗的一个重要的标靶,通过抑制它的表达可加速NPMALK以及其他致癌蛋白的降解,导致细胞凋亡[24,32]。癌伏妥作为mTOR抑制剂被用于多种肿瘤的治疗[33]。研究显示FLT的摄取与NPM-ALK或NPM-ALK下游途径抑制而导致的增殖抑制密切相关;FLT-PET在监测肿瘤体积产生明显变化前的早期疗效时比FDG-PET更敏感,更具特异性;而且,针对于此结论的细胞和小鼠肿瘤模型的评估结果显示一致性的结果。
FDG-PET是在治疗结束后对侵袭性淋巴瘤进行预后分级的有效无创性影像学方法[5]。但是,在治疗期间FDGPET作为监测中期疗效的方法对最终治疗结果进行预测时其预测能力并不理想[10,34];有研究证明,FDG-PET在预测以mTOR抑制为基础的晚期肿瘤疗效时表现不佳[35]。因此,临床上亟需一种能够在治疗早期便可反映肿瘤在增殖方面变化的新型影像学示踪剂。FLT以S期酶胸苷激酶1(TK1)为基础的示踪剂,可在具有增殖能力的细胞中大量聚集;TK1的活性与细胞增殖能力相关,且与细胞摄取FLT的能力直接相关,从而使FLT成为反映细胞增殖情况的 特 异 性 指 标[13-15,36]。
FDG在HSP90或mTOR靶向治疗早期监测肿瘤(如乳腺癌[37,38]、卵巢癌[39]和胰腺癌[35])针对治疗反应能力不足,这与本研究结果一致。究其原因,可能是mTOR抑制后48 h内可以起炎症反应,从而导致FDG摄取的增加[40]。由于炎症细胞的FDG摄取与肿瘤细胞相似甚至偏高,因此炎症反应引起短暂的FDG摄取增加可能导致对肿瘤代谢活性的过度估计[41],而FLT作为细胞增殖特异性示踪剂以用于监测PI3K-AKT-mTOR通 路靶向性 治 疗的疗效[39,42]。由于抑制NPM-ALK下游信号通路可导致细胞周期停滞于G1期,并且p27增加和细胞周期蛋白D1表达减少使TK1活性降低[43],FLT的摄取又与TK1的活性直接相关,因此,FLT可有效的监测针对该致癌途径的靶向性治疗的疗效并进行预后分级。研究证实FLT-PET在HSP90和mTOR抑制治疗5 d后便可反应治疗引起的FLT摄取的显著降低;而且肿瘤生长曲线和病理学 研究验证了这一结论,并显示了癌细胞增殖的显着减少和细胞凋亡的增加。
本课题提出了一个包括分子层面、细胞及肿瘤模型综合分析的转化研究,来验证PET在早期评估肿瘤对靶向治疗的反应时的预测价值。本结果表明FLT-PET作为一种无创的功能影像学方法可在治疗初期就显示肿瘤对靶向性治疗的反应,此发现将促进针对NPM-ALK途径的新型抑制剂效用的快速评估。
(参考文献从略)

