FH/Wjd大鼠和SD大鼠摄酒行为的比较观察
赵福坤,吴 芹,李 勃,张明辉,陈 晶,徐云燕,石京山
(遵义医科大学基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563006)
酒精系精神活性物质,可以影响人类情绪、思维、行为及意识状态。长期嗜酒者可出现酒精依赖综合征,即耐受性、冲动性觅酒行为和戒断症状[1]。在中国传统酒文化的影响下,酒在人类社交活动中被广泛使用,使得我国不论是酒的产量或消耗量,近年来都不断增加,酒产业作为一些国家的支柱产业,产生了很大效益[2-3]。然而,由于酒产量或消耗量的增加,酒相关的问题也相应呈上升趋势,并对人体健康产生重要影响[4-7],其中以酒精成瘾的精神依赖和人体肝脏受损最为严重[8-11]。据2018年世界卫生组织调查结果显示,2016年全世界因过度饮用酒精饮品造成了300万例死亡。酒精消费不仅能够导致依赖,还可增加人们罹患200多种疾病的危险,包括肝硬化和某些癌症[12]。
由于国内缺乏自身饮酒的动物模型,在过去的40年里,酒精给人类带来的疾病的治疗方法依旧没有明显的进展[13]。因此,在维持我国酒产量不减和保持中国传统酒文化不变的情况下,寻找一种与人类饮酒行为相似的动物模型,以研究恰当的饮酒方式,或者追求一种对身体健康损害较小的酒具有重要意义。FH/Wjd大鼠是远交系Wistar大鼠近亲繁殖了19代得到的品系[14],这个品系的大鼠具有遗传性5羟色胺(5-hydroxytryptamine,5-HT)功能低下和大量自主饮酒的特点[1,15]。本实验室于2014年从北京大学药物研究所梁建辉教授实验室引进该先天性嗜酒大鼠,并成功繁殖。本研究通过观察FH/Wjd大鼠和SD大鼠对不同酒的偏好、饮酒行为的昼夜差异性以及剥夺效应,为其在国内乙醇研究领域的应用提供实验依据。
1 材料与方法
1.1试剂与仪器A酒(酱香型,53度)产自贵州仁怀某酒厂;B酒(浓香型,52度)产自四川宜宾某酒厂;分析纯无水乙醇,购自成都市科龙化工试剂厂,批号:0071218,使用时用自来水配制成所需浓度。酒、乙醇、水分别装于定制的50 mL和200 mL大鼠饲养水瓶(苏州君圣实验动物设备有限公司),不锈钢吸管内径分别为1.0 mm(酒、乙醇)和2.0 mm(水)。
1.2实验动物及分组FH/Wjd大鼠和SD大鼠各30只,体质量150~250 g,SPF级,♀♂不拘。FH/Wjd大鼠2014年由北京大学药物依赖研究所梁建辉教授馈赠,并引进繁殖;SD大鼠由重庆第三军医大学大坪医院实验动物中心提供,许可证号:SCXK(渝)2012-0005。随机分为3组:A酒组(Liquor A)、B酒组(Liquor B)、53%乙醇组(Alcohol),每组10只。单笼饲养,自由饮食,光照每天12 h,明暗交替(光照时间8 ∶00~20 ∶00),相对湿度为60%~65%,温度(21~23) ℃。
1.3双瓶自由选择饮酒实验[16]各组大鼠采用双瓶(A酒、B酒、53%乙醇和双蒸水)自由选择的方法喂养4个月,每日于20 ∶00定时称水瓶和酒瓶的重量,并于称量水瓶和酒瓶后,交换水瓶和酒瓶位置,防止形成位置偏爱,连续观察2个月。计算每天FH/Wjd大鼠和SD大鼠的饮酒量、饮水量以及对各酒的偏爱率。并于d 8的8 ∶00和20 ∶00定时称水瓶和酒瓶的重量,分别计算白天和夜间各大鼠的饮酒量、饮水量以及对各酒的偏爱率,比较大鼠对不同酒的饮酒量、饮水量及偏爱率在白天和夜间的差异性。偏爱率/%=mE/(mE+mw)×100%;其中mE为饮酒量,mw为饮水量。
1.4乙醇剥夺实验[16]各组大鼠采用双瓶(A酒、B酒、53%乙醇和双蒸水)自由选择的方法喂养4个月,每日于20 ∶00定时称水瓶和酒瓶的重量,并于称量水瓶和酒瓶后,交换水瓶和酒瓶位置,防止形成位置偏爱。待FH/Wjd大鼠和SD大鼠的饮酒行为稳定后,取出酒瓶24 h,保留水瓶,待24 h后放上酒瓶,再次给予双瓶自由选择。并于放上酒瓶24 h后,称量各酒瓶和水瓶的重量。观察再次给酒24 h后与剥夺前24 h FH/Wjd大鼠和SD大鼠的饮酒量、饮水量及偏爱率的变化。

2 结果
2.1FH/Wjd大鼠对不同酒的饮酒量、饮水量及偏爱率当酒水和饮水开始同时出现时,FH/Wjd大鼠立即主动摄取酒水。通过统计4个月FH/Wjd大鼠对不同酒的饮酒量、饮水量以及偏爱率发现,FH/Wjd大鼠对A酒的摄入量明显高于53%乙醇(P<0.01),对A酒的偏爱率明显高于B酒和53%乙醇(P<0.05),各酒中FH/Wjd大鼠更偏爱A酒,见Tab 1。

Tab 1 The average ethanol and water intake and ethanol preference in FH/Wjd rats for each liquor in four months
#P<0.05,##P<0.01vsalcohol;*P<0.05vsliquor B
通过对第1个月和第2个月FH/Wjd大鼠对不同酒的饮酒量、饮水量以及偏爱率的统计发现(Fig 1),FH/Wjd大鼠对不同酒的饮酒量和偏爱率随着饮酒时间延长而增加,且第2个月对A酒的饮用量明显高于第1个月(P<0.05),偏爱率也高于第1个月,但差异无统计学意义,饮水量变化不明显。第1个月对A酒的饮用量明显高于53%乙醇(P<0.05),第2个月对A酒的饮用量及偏爱率明显高于B酒和53%乙醇(P<0.05)。
2.2SD大鼠不同酒的饮酒量、饮水量及偏爱率当酒水和饮水开始同时出现时,SD大鼠并未主动摄取酒水,但当撤出饮水而只留酒水时,SD大鼠被迫开始摄取酒水,24 h后,当酒水和饮水同时存在时,SD大鼠开始主动摄取酒水。通过统计4个月SD大鼠对不同酒的饮酒量、饮水量以及偏爱率发现,SD大鼠对A酒和B酒的摄入量明显高于53%乙醇(P<0.01),对B酒的偏爱率明显高于A酒和53%乙醇(P<0.01),对A酒的偏爱率明显高于53%乙醇(P<0.05),各酒中SD大鼠更偏爱B酒,见Tab 2。

Tab 2 The average ethanol and water intake and ethanol preference in SD rats for each liquor in four months n=10)
#P<0.05,##P<0.01vsalcohol;**P<0.01vsliquor A

Fig 1 Difference of each liquor in ethanol and water intake and ethanol preference of FH/Wjd rats n=10)
*P<0.05vsfirst month;#P<0.05,##P<0.01vsalcohol;△P<0.05vsliquor A
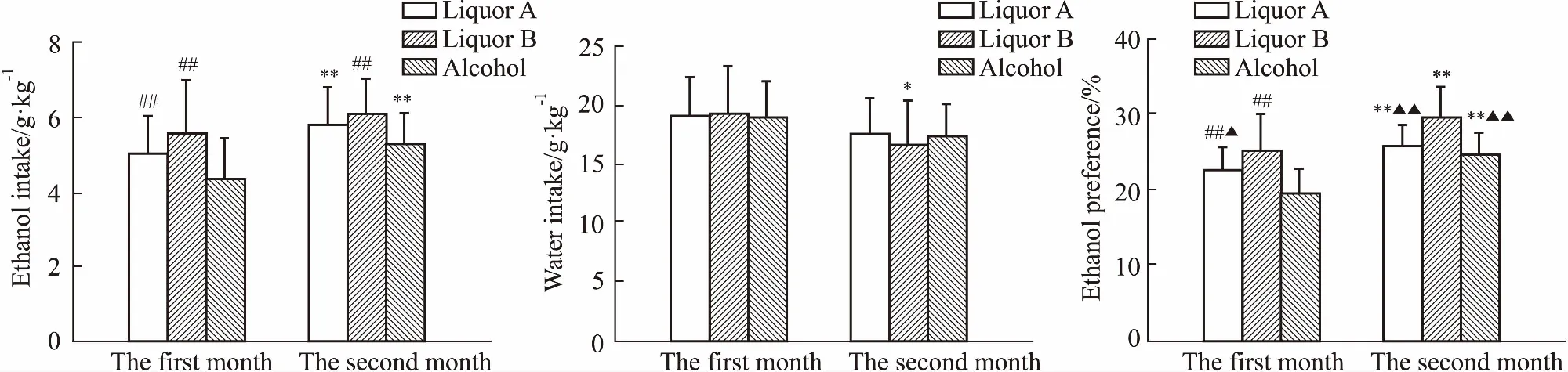
Fig 2 Difference of each liquor in ethanol and water intake and ethanol preference of SD rats n=10)
*P<0.05,**P<0.01vsfirst month;##P<0.01vsalcohol;▲P<0.05,▲▲P<0.01vsliquor B
通过对第1个月和第2个月SD大鼠对不同酒的饮酒量、饮水量以及偏爱率的统计还发现(Fig 2),SD大鼠对不同酒的饮酒量和偏爱率也随着饮酒时间延长而增加,且第2个月对A酒和53%乙醇的饮用量明显高于第1个月(P<0.01),对各酒的偏爱率明显高于第1个月(P<0.01),饮水量变化不大。第1个月对A酒和B酒的饮用量及偏爱率明显高于53%乙醇(P<0.01),第2个月对B酒的饮用量明显高于53%乙醇(P<0.01),对B酒的偏爱率明显高于A酒和53%乙醇(P<0.01)。
2.3FH/Wjd大鼠和SD大鼠对不同酒饮酒行为的昼夜差异Fig 3、4结果显示,给予A酒、B酒和53%乙醇后,FH/Wjd大鼠和SD大鼠夜间饮酒量和饮水量均明显高于白天饮酒量(P<0.01)。FH/Wjd大鼠和SD大鼠对不同酒的饮酒行为均存在明显的昼夜差异,饮酒行为主要发生在夜间(活动期间)。SD大鼠白天对B酒和53%乙醇的饮酒量明显高于A酒(P<0.01)。
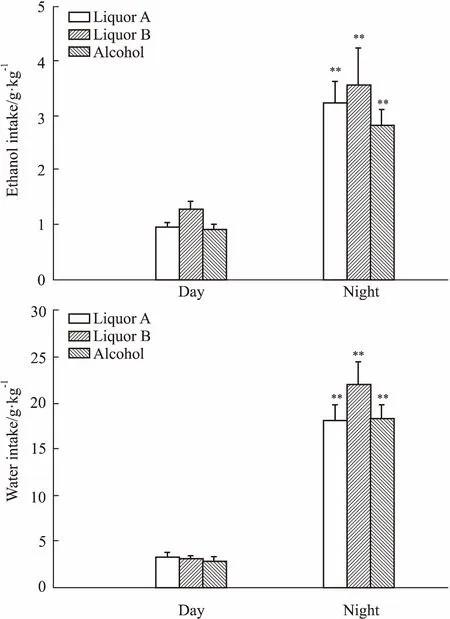
Fig 3 Difference in drinking behavior of FH/Wjd rats between day and night n=10)
**P<0.01vsday

Fig 4 Difference in drinking behavior of SD rats between
**P<0.01vsday;△△P<0.01vsliquor A
2.4不同酒剥夺24h对FH/Wjd大鼠饮酒行为的影响Fig 5结果显示,FH/Wjd大鼠各酒剥夺24 h后,再次给A酒,FH/Wjd大鼠再次给A酒后24 h的饮酒量和偏爱率均比剥夺前一天24 h的饮酒量和偏爱率高,而饮水量则降低,但差异无显著性。再次给B酒和53%乙醇后24 h的偏爱率比剥夺前一天24 h的偏爱率明显增加(P<0.05),饮酒量也增加,但差异无统计学意义,而饮用53%乙醇的饮水量明显降低(P<0.05)。FH/Wjd大鼠对不同酒的饮酒行为存在剥夺效应。
2.5不同酒剥夺24h对SD大鼠饮酒行为的影响Fig 6结果显示,SD大鼠各酒剥夺24 h后,再次给予相应酒后24 h的饮酒量和偏爱率均比剥夺前一天24 h的饮酒量和偏爱率升高,但差异无统计学意义,而饮水量则降低,其中饮用B酒的饮水量明显降低(P<0.05)。SD大鼠对不同酒的饮酒行为也存在剥夺效应。
3 讨论
本研究结果表明,FH/Wjd大鼠对酒类饮品具有天然的嗜好,在实验开始酒水和饮水同时存在时,便主动摄取酒水,的确可以称之为“酒鬼鼠”。然而,SD大鼠则不同,当酒水和饮水开始同时出现时,并未主动摄取酒水,但当撤出饮水而只留酒水时,SD大鼠被迫开始摄取酒水,24 h后,当酒水和饮水同时存在时,产生主动摄取酒水的行为。表明不同动物品系对酒类的摄取行为和人类有相似之处,有的天生能(好)喝酒,而有的则不喜欢喝酒。人类不同个体的饮酒量和对品牌的偏好也有差异,本实验观察到,FH/Wjd大鼠对A酒的饮用量及偏爱率最高,其次是B酒,最后是53%乙醇。而SD大鼠则对B酒的饮用量及偏爱率最高,其次是A酒,最后是53%乙醇。该现象提示,不同大鼠品系可能偏好不同品牌的酒。偏爱率实则是反映了饮酒的不良反应表现,在人们的饮酒过程中会产生严重的口渴,因此会大量喝水,表现为偏爱率低。本实验也发现,FH/Wjd大鼠和SD大鼠也有这种现象。另外,通过对各组大鼠第1个月和第2个月对不同酒的饮酒量、饮水量以及偏爱率的观察发现,FH/Wjd大鼠和SD大鼠对不同酒的饮用量及偏爱率均随饮酒时间延长而增加,饮水量变化不大。到后期,甚至有个别大鼠的饮酒量大于饮水量,偏爱率大于50%。其中FH/Wjd大鼠第2个月对A酒的饮用量明显高于第1个月,SD大鼠第2个月对A酒和53%乙醇的饮用量和偏爱率明显高于第1个月。该现象说明FH/Wjd大鼠长期自发饮酒已对酒精产生耐受和依赖,与文献报道一致[17]。而SD大鼠通过短期强制饮酒训练后,与FH/Wjd大鼠一样具有饮酒量大的特点,且长期自发饮酒也会对酒精产生耐受和依赖。FH/Wjd大鼠和SD大鼠这种饮酒行为与人类的饮酒行为相似。

Fig 5 Effect of liquors deprived on ethanol-drinking behavior of FH/Wjd rats n=10)*P<0.05 vs pre-deprivation; △P<0.05 vs liquor A
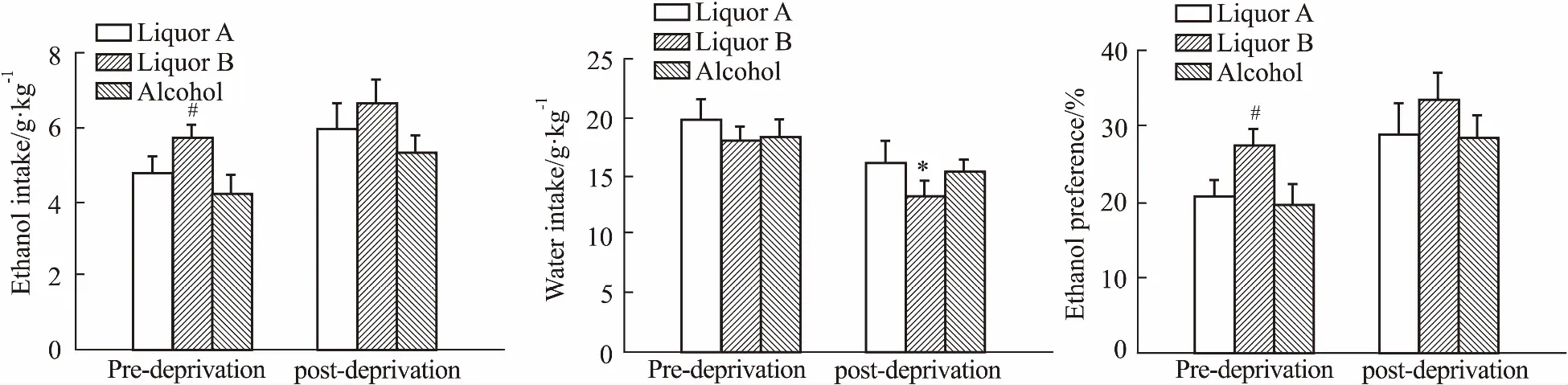
Fig 6 Effect of liquors deprived on drinking behavior of SD rats n=10)
*P<0.05vspre-deprivation;#P<0.05vsalcohol
观察还发现,FH/Wjd大鼠的饮酒行为主要出现在夜间,各酒夜间的饮酒量为白天的2.7~3.6倍,饮水量是白天的5.5~7.1倍。SD大鼠的饮酒行为也主要出现在夜间,各酒夜间的饮酒量为白天的2.8~7.8倍,饮水量是白天的5.0~6.7倍。FH/Wjd大鼠SD大鼠对不同酒的饮酒行为均存在明显的昼夜差异,与人类饮酒主要发生在活动期间的行为相似。而这种饮酒行为的昼夜节律性对于动物给药时间的选择具有重要意义,如对于一些半衰期较短的药物,应选择在饮酒高峰前(熄灯前)给药。
剥夺效应是不同酒剥夺一段时间后,自发对酒的饮用量和偏爱率的暂时性升高。FH/Wjd大鼠各酒剥夺24 h,再次给酒后24 h的饮酒量和偏爱率均较剥夺前24 h升高,与报道一致[16]。与FH/Wjd大鼠相似,SD大鼠各酒剥夺24 h,再次给酒后24 h的饮酒量和偏爱率也均比剥夺前24 h的高,该现象与嗜酒者戒酒复发后饮酒量的增加相似。因此,SD大鼠也可考虑作为一种嗜酒动物模型,用于戒酒药物的药效评价。

