α-硫辛酸抑制炎症信号TLR4和NLRP3的活化在糖尿病大鼠肾组织纤维化中的保护作用
肖 瑛, 袁质平, 彭 灿, 张小欢,张莹莹, 王圆圆, 石明隽,张 帆, 孙 兰, 郭 兵
(贵州医科大学1. 基础医学院病理生理学教研室、2. 贵州省常见慢性疾病发病机制及药物研究重点实验室、3. 大学城医院五官科,贵州 贵阳 550025)
临床上,糖尿病(diabetes mellitus, DM)一旦引起肾脏损害,即使采取综合治疗,将血糖、血压、血脂等指标均控制在理想的范围,亦不能完全阻止糖尿病肾病(diabetic nephropathy, DN)病情的持续恶化,且DN发病隐匿,早期不易被发现。最新研究发现,DN与发生在代谢紊乱与血流动力学异常基础上的炎症反应和激活的免疫系统关系密切。在各种炎症因子相互影响和相互作用的复杂网络中,核因子κB (nuclear factor κB, NF-κB)起着中心调控作用。Toll样受体(Toll-like receptors, TLRs)是NF-κB上游信号调节因子,可激活多种细胞因子,最终引起一系列的免疫和炎症反应[1]。研究表明,TLR4和NF-κB作为炎症反应激活通路中的重要调节因子,在DN发展过程中的表达水平上调及过激化,可能是导致糖尿病肾损伤的重要机制之一[2-3]。也有研究发现,TLR4/NF-κB可靶向激活含pyrin结构域NOD样受体家族3(NLR family pyrin domain containing 3, NLRP3)炎症小体,从而诱导肝脏的炎症反应[4]。对DN患者的研究发现,肾小管上皮细胞NLRP3表达与炎性细胞因子白细胞介素1β(interleukin-1β, IL-1β)水平、肾间质损伤及肾功能改变明显相关,提示NLRP3炎症小体的激活参与DN肾小管氧化应激损伤[5]。近年来研究发现,DN的发生发展过程与Notch有密切关系,Notch信号通路参与肾脏的发育、肾小球病变、肾小管间质纤维化以及微血管病变,进而影响DN的发生、发展。肾小管上皮细胞中Notch信号转导加重肾小管外周炎性细胞的浸润及促进间质纤维细胞增殖,最终导致间质纤维化[6]。但是DN肾小管间质纤维化过程中,TLR4和NLRP3炎症信号的活化是否受到Notch信号通路的调控,未见相关报道。
α-硫辛酸(alpha lipoic acid, ALA)是硫辛酸的氧化形式,能通过清除活性氧和自由基,减轻氧化应激水平,现已用于临床治疗氧化应激、糖尿病及其相关并发症等有关疾病[7]。但是其对于DN抗炎抗纤维化保护作用的研究尚少。本研究从DN炎症反应所涉及的信号通路及其相互作用入手,通过ALA对肾组织Notch2、TLR4、NLRP3及炎性因子表达的影响,探讨ALA改善DN炎症反应和纤维化程度的保护作用及机制,为寻找药物治疗的靶点提供一定的理论和实验基础。
1 材料与方法
1.1材料
1.1.1实验动物 SD大鼠,♂,体质量(180±20) g,24只,清洁级,购于北京华阜康生物科技股份有限公司提供,批号为:SCXK(京)2009-0004。大鼠饲养于本实验室动物房,常规饲料,自由饮水。
1.1.2药物与试剂 链脲佐菌素(streptozotocin, STZ,美国Sigma公司);ALA (中国奥立宝公司);兔抗TLR4多克隆抗体(美国ProteinTech公司);兔抗NLRP3多克隆抗体(中国博奥森生物有限公司);兔抗Notch2多克隆抗体(中国MDL公司);抗Ⅳ型胶原(collagen Ⅳ, Col-Ⅳ)蛋白单克隆抗体(美国Sigma公司);抗β-actin抗体(武汉Boster公司);总抗氧化物酶活性(total antioxidant capacity, T-AOC)、丙二醛(malondialdehyde, MDA)试剂盒(南京建成公司);免疫组织化学链霉亲和素-过氧化物酶(streptavidin-perosidase,SP)两步法检测试剂盒、二氨基联苯胺(diaminobenzidine, DAB)显色液(北京中杉金桥生物技术有限公司);ELISA试剂盒(北京欣博盛生物技术公司)。
1.1.3仪器 血糖仪(美国强生有限公司);全自动生化分析仪(德国Bayer公司);高速低温离心机(美国Beckman公司);核酸蛋白分析仪、电泳系统及电泳移装置(美国Amersham公司);凝胶成像系统(美国Bio-Rad公司)。
1.2方法
1.2.1糖尿病动物模型的建立及分组 造模前4~6 h禁食不禁水,一次性尾静脉注射STZ(55 mg·kg-1) 建立糖尿病大鼠模型。72 h后禁食4 h,尾静脉尖部针刺取血测空腹血糖,血糖≥16.7 mmol·L-1且尿糖阳性为糖尿病模型成功[7]。成模2周后,随机分为糖尿病组(DM组)、ALA组,每组8只,另设空白对照组(NC组)大鼠8只。ALA组每天以150 mg·kg-1灌胃给药,连续6周。空白对照组和DM组给予等量等体积生理盐水。实验期间未使用胰岛素,动物自由进食饮水,至实验结束时未发生动物死亡。
1.2.2标本收集及指标测定 实验8周末,收集大鼠24 h尿量,双缩脲法测尿蛋白浓度,得到的尿蛋白浓度与24 h尿量乘积为24 h尿总蛋白量(24 h urine protein, 24 h UP)。然后,乙醚麻醉行股总动脉采血,葡萄糖氧化酶法检测大鼠血糖(blood glucose, BG),酶分析法检测血总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)。通过左心室注射4 ℃预冷的生理盐水,反复灌洗肾脏后游离,固定于4%多聚甲醛,制成切片进行免疫组化染色。0.1 g肾皮质加入500 μL组织蛋白裂解液进行肾组织匀浆,BCA法测定蛋白浓度,参照T-AOC和MDA试剂盒说明书,进行测定。ELISA试剂盒检测肾组织上清液中白细胞介素6(interleukin-6, IL-6)和肿瘤坏死因子α(tumor necrosis factor α, TNF-α)含量。
1.2.3肾脏HE、Masson染色及免疫组织化学染色 取已固定的大鼠肾脏做成3 μm厚的石蜡切片,HE和Masson染色进行病理学观察。按免疫组化SP二步法进行肾皮质Notch2、NLRP3、TLR4(1 ∶50)染色,经脱蜡、水化、微波炉加热行抗原修复、抗体孵育,DAB溶液显色,光镜下观察表达部位,并拍摄图片。
1.2.4Western blot法检测肾皮质中Notch2、NLRP3、TLR4和Col-Ⅳ的蛋白表达 取各组大鼠肾皮质0.1 g,加入500 μL组织蛋白裂解液进行组织匀浆,离心后提取上清液,按BCA试剂盒说明书操作,检测大鼠肾组织蛋白浓度。加入5×的上样缓冲液,煮沸后,经聚丙烯酰胺凝胶电泳分离蛋白,转膜,5%脱脂牛奶封闭,TBST洗膜后,分别孵育一抗β-actin(1 ∶4 000)、Notch2(1 ∶1 000)、NLRP3(1 ∶1 000)、TLR4(1 ∶1 000)和Col-Ⅳ(1 ∶1 000),4 ℃过夜,二抗常温孵育1 h,用增强化学发光法显色,Bio-Rad凝胶成像系统曝光,经Image Lab 5.1软件处理并分析图像。

2 结果
2.1ALA对DM大鼠生化指标的影响由Tab 1可知,DM组大鼠的血糖、总胆固醇、甘油三酯和24 h尿蛋白量均明显高于对照组(P<0.05)。给予ALA治疗6周后,与DM组比较,除血糖没有明显降低外,总胆固醇、甘油三酯和24 h尿蛋白量均明显低于DM组(P<0.05),且伴随大鼠多饮、多食、多尿现象有所改善。表明ALA可能通过降低血脂,减轻对肾脏的损害,从而减少尿蛋白。

Tab 1 Comparison of BG, 24 h UP, TC,TG levels among three
*P<0.05vsNC;#P<0.05vsDM

Fig 1 The pathological changes in tissues of three groups observed by HE and Masson(×200)
2.2ALA对DM大鼠氧化应激水平的影响通过对T-AOC和MDA的检测发现,与对照组比较,DM组T-AOC活性降低,MDA含量升高(P<0.05);ALA治疗后可明显升高T-AOC活性,降低MDA含量(Tab 2)。表明ALA可减轻氧自由基对肾小球的损害,改善肾小球基底膜的通透性,从而减少尿蛋白。

Tab 2 Comparison of T-AOC and MDA levels among three
*P<0.05vsNC;#P<0.05vsDM
2.3大鼠肾脏组织的病理学变化对照组大鼠HE染色的肾组织中,肾小球轮廓清晰,肾小管上皮细胞排列整齐,基底膜完整;DM组部分肾小管结构破坏,上皮细胞有空泡样变性,可见基底膜明显增厚,而ALA组与DM组相比,肾小球和肾小管病变情况有不同程度的改善。与NC组相比,DM组肾小管间质中Masson染色呈深蓝色,阳性物质明显增多,而ALA组与DM组相比,可见肾小管间质中深蓝色阳性物质较DM组明显减少(Fig 1)。
2.4ALA对DM大鼠肾皮质TLR4蛋白表达的影响免疫组化显示,NC组大鼠的肾组织中TLR4表达量少,DM组可见TLR4表达明显增多,主要表达在肾小管上皮细胞中,呈棕黄色;在ALA组中,TLR4的表达较DM组明显减少,颜色变浅。Western blot实验结果显示,DM组较对照组TLR4表达明显增加;ALA组与DM组相比,TLR4的表达明显降低,差异具有统计学意义(P<0.05)。见Fig 2。
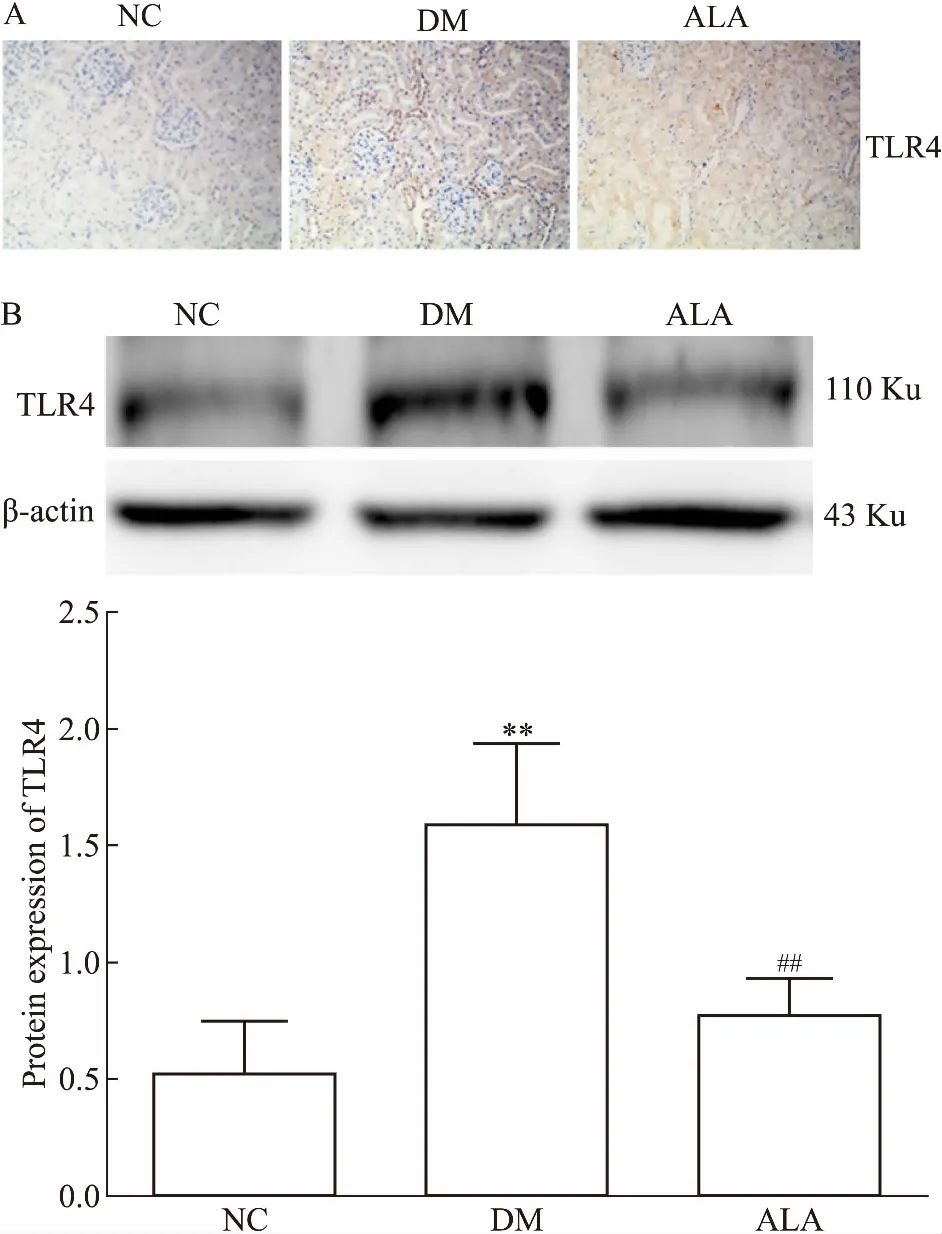
Fig2ComparisonofTLR4proteinexpressionamongthreegroups
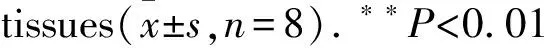
2.5ALA对DM大鼠肾皮质NLRP3蛋白表达的影响免疫组化染色可见,在对照组大鼠的肾组织中几乎不表达NLRP3,但DM组可见NLRP3表达明显增多,主要表达在肾小管上皮细胞中,呈棕黄色;在ALA组中,NLRP3表达较DM组明显减少,颜色变浅。Western blot结果显示,与对照组相比,DM组NLRP3表达明显增加;与DM组相比,ALA组NLRP3的表达明显降低,差异具有统计学意义(P<0.05),见Fig 3。以上结果表明,ALA可以改善DM状态下肾小管-间质的炎症反应,从而延缓肾小管-间质的损伤进程。

Fig 3 Comparison of NLRP3 protein expression among three groups
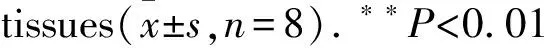
2.5ALA对DM大鼠肾皮质Notch2蛋白表达的影响免疫组化染色可见,在对照组大鼠的肾组织中,Notch2有少量的表达,而在DM组Notch2表达明显增多,肾小球和肾小管均有表达,呈棕黄色;与DM组相比,ALM组Notch2表达明显减少,颜色变浅。Western blot结果显示,与对照组相比,DM组Notch2表达明显增加;与DM组相比,ALA组Notch2的表达明显降低,差异具有统计学意义(P<0.05)。见Fig 4。结果表明,DM状态下大鼠肾皮质Notch2信号通路被激活,ALA可以抑制其激活。

Fig 4 Comparison of Notch2 protein expression among three groups

2.6ALA对DM大鼠肾皮质Col-Ⅳ蛋白表达的影响Western blot评估DM大鼠肾皮质中细胞外基质的水平。与对照组比较,DM组大鼠肾皮质中Col-Ⅳ表达增多(P<0.05),给予ALA6周后,与DM组比较,ALA组大鼠肾皮质Col-Ⅳ表达减少(P<0.05),见Fig 5。此结果表明,ALA可以改善DM所致的大鼠肾纤维化。
2.7ALA对肾组织上清液中炎性因子含量的影响Tab 3 ELISA法检测结果显示,与对照组相比,DM组IL-6、TNF-α含量明显增加(P<0.05);与DM组相比,ALA组IL-6、TNF-α含量明显下降(P<0.05)。

Tab 3 Comparison of IL-6 and TNF-α
**P<0.01vsNC group;##P<0.01vsDM group

Fig 5 Comparison of Col-Ⅳ protein
**P<0.01vsNC group;##P<0.01vsDM group
2.8相关性分析ALA组大鼠的肾组织中Notch2蛋白与TLR4蛋白的表达呈明显正相关,相关系数为0.886(P<0.05);Notch2蛋白和NLRP3蛋白的表达呈明显正相关,相关系数为0.899(P<0.05)。
3 讨论
硫辛酸是一种天然存在的化合物,其氧化形式为ALA,还原形式为二氢硫辛酸,两种形式的硫辛酸都具有较强的抗氧化性。Cho等[8]研究发现,在急性肾损伤时,ALA可阻止肾小管的凋亡、肾脏的炎症反应和氧化应激,而在单侧输尿管梗阻(unilateral ureteral occlusion, UUO)肾间质纤维化肾小管上皮细胞向间充质细胞转分化(epithelial mesenchymal transition, EMT)过程中,ALA可抑制巨噬细胞浸润和间质纤维化的进程,也可以通过减少基质金属蛋白酶的表达,来减慢管基底膜的破坏速度,提示ALA在预防和治疗慢性肾脏疾病的优势作用可进行深入探索。在本实验中,ALA虽没有降低血糖,但是降低血脂的作用减轻了脂血症对肾脏的损害,从而减少24 h尿蛋白,还降低了DM状态下肾组织中的氧化应激水平,抑制炎性因子的分泌,减少了Col-Ⅳ蛋白表达,提示ALA通过抗炎、抗纤维化,发挥了对糖尿病大鼠肾脏的保护作用。其作用是否能像二甲双胍一样[9],通过抗内质网应激、抗炎症、抗纤维化,来发挥非降糖的肾脏保护作用呢?值得深入研究。
DN发病机制十分复杂,但它们的共同规律为:任何因素都要通过细胞内的信号通路,将细胞外信息转导至细胞质和细胞核,引起细胞行为的改变。随着研究的深入,确立了炎症反应在DN中的作用,认为DN是一种自然免疫和慢性低度炎症性疾病。基于此,探讨炎症反应如何促进DM肾脏纤维化的作用,逐渐受到重视。在DM大鼠肾脏,ALA抗炎抗纤维化的保护作用是如何发挥的呢?我们对能够激活天然免疫细胞,最终导致一系列免疫炎症反应的天然免疫受体TLRs家族中的TLR4,以及和TLRs能够相互影响,共同调节机体免疫应答的模式识别受体,如细胞质内的核苷酸结合寡聚结构域样受体(NOD-like receptors, NLRs)中研究最为广泛的NLRP3炎症小体,在糖尿病肾组织中的变化进行了检测。发现高糖状态下TLR4和NLRP3蛋白的表达都明显增多,炎性因子IL-6和TNF-α分泌量增加,提示炎症信号通路被激活,并参与了肾脏损害。这与Garibotto 等[10]研究结果一致。当给予ALA治疗后,TLR4和NLRP3蛋白的表达都明显减少,炎性因子IL-6和TNF-α分泌量降低,表明ALA可能通过抑制TLR4和NLRP3的活化,进而减轻炎症反应,但是其具体的调控机制不清楚。
Notch信号传导通路在胚胎发育、血细胞发育、细胞增殖、分化、调亡、肿瘤发生发展、炎症等生理病理过程中起重要作用。哺乳动物中Notch有4种亚型,分别是Notch 1-4。经典的Notch信号通路转导是Notch受体胞外区与配体结合,被依赖于去整合素-金属蛋白酶(a disintegrin and metalloprotease, ADAM)和分泌酶切割后,细胞内结构域(Notch intracellular domain, NICD)释放,NICD进入细胞可引起Notch信号靶基因如Hes1的转录。近年来研究表明,TLR信号激动剂能够调整Notch受体和配体的表达,来增强TLR信号免疫应答反应,提示Notch信号与TLR介导的炎症方面存在关联[11-13]。但是未见Notch2与TLR4在DM肾组织中的表达关系,也未见Notch2与NLRP3在DM肾组织中的表达研究。本实验结果显示,DM组Notch2、TLR4、NLRP3表达均明显增加,伴随炎性因子的分泌增多、细胞外基质的沉积加重;给予ALA治疗后,Notch2的表达明显降低,并分别与TLR4、NLRP3表达减少呈明显正相关,同时炎性因子和细胞外基质分泌量明显减少,提示ALA可能是通过抑制Notch2蛋白的表达,减轻DN炎症反应和纤维化病变的发生、发展,发挥保护作用,但是具体的调控机制还需要在体外培养的肾小管上皮细胞中使用干预手段进一步验证。

