新内镜中心验收过程发现的问题及对策
李占结,李松琴,李 琳,杨 悦,陈文森,张永祥,刘 波
(南京医科大学第一附属医院感染管理办公室,江苏 南京 210029)
近20 年来,消化内镜在临床应用越来越广泛,如何提高内镜的清洗消毒水平,阻止病原微生物经内镜传播,杜绝医院交叉感染,保证患者安全是消化内镜医务工作者面临和需要解决的重要医学课题[1]。消化内镜作为一种精密度高、结构复杂、材质特殊的器械,使用中易接触患者的血液、分泌物等,清洗消毒难度较大[2]。消化内镜诊疗导致感染的概率极低,仅180万分之一,但内镜处理的许多缺陷和不足可能导致微生物的传播[3]。近年来,多起消化内镜感染暴发事件引起世界范围内的广泛关注。消化内镜内部通道含有107~1010个肠道微生物[4],是感染传播的潜在危险因素,由此可见规范内镜清洗、消毒,杜绝医院交叉感染的重要性[5]。为保障本院新内镜中心正常运行,验收过程中模拟了一系列清洗消毒流程,分析模拟清洗消毒不合格原因及针对性改进,总结新内镜中心投入使用前容易被忽略的潜在危险因素,现报告如下,以资为医疗同仁提供借鉴。
1 对象与方法
1.1 研究对象 首先对新内镜中心终末漂洗用纯水进行检测,分析存在的问题并进行整改,随机选取消化内镜中心日常医疗工作使用后的消化内镜(胃镜、肠镜),进入新内镜中心模拟清洗消毒流程,并监测清洗消毒效果,消毒剂均常规采用邻苯二甲醛(OPA)。对人工清洗工作站和全自动内镜清洗消毒机(automatic endoscope reprocessor, AER)使用的纯水进行微生物检测。新内镜中心AER为新购机型。
1.2 检测方法 检测方法参照GB 15982-2012《医院消毒卫生标准》、WS/T 367-2012 《医疗机构消毒技术规范》、YY 0572-2015《血液透析及治疗相关用水》和WS 507-2016《软式内镜清洗消毒技术规范》等标准执行。该验收模拟研究常规采集消化内镜数量不低于本院消化内镜总量的10%,现场采样后均在2 h内送检。
1.2.1 内镜检测 取人工或AER清洗消毒后内镜,采用无菌注射器抽取灭菌后蓝口瓶中50 mL含相应中和剂的洗脱液,从活检口注入冲洗内镜管路,并全量收集。将洗脱液充分混匀,分别用滤膜过滤法和平板涂布法,将洗脱液接种在直径9 cm的营养琼脂平板上,置36℃恒温箱培养48 h,观察结果。
1.2.2 终末漂洗用纯水检测 人工清洗工作站:将终末漂洗纯水出口的水打开放流1 min后,用灭菌后蓝口瓶接取50 mL纯水;AER:空置运行AER,用灭菌后蓝口瓶接取50 mL机器内部纯水。分别用滤膜过滤法和平板涂布法,将采集后纯水接种在直径9 cm的R2A平板上,置23℃恒温箱培养7 d,观察结果。
1.3 结果判读 内镜消毒监测和终末漂洗用纯水监测结果判定依据为WS 507-2016 《软式内镜清洗消毒技术规范》,内镜消毒微生物监测合格标准为菌落总数<20 CFU/件;消毒后内镜终末漂洗用纯水细菌总数<10 CFU/100 mL。
1.4 统计分析 应用SPSS 22.0版本统计软件对数值进行分析,非正态分布资料采用中位数(四分位数)描述,非正态分布两样本定量资料间比较采用Mann-Whitney U检验,P≤0.05为差异有统计学意义。
2 结果
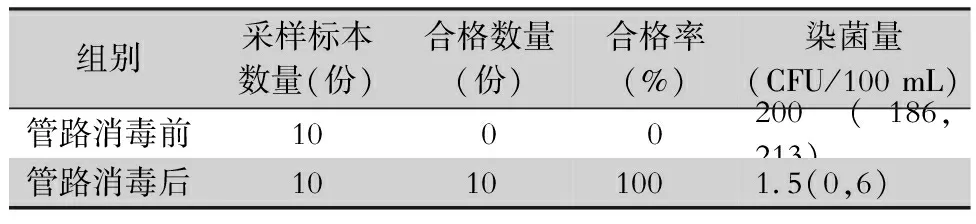
2.1 终末漂洗用纯水监测结果 采集10份内镜清洗工作站终末漂洗用纯水,检测结果均不合格,染菌量最大值为222 CFU/100 mL,中位数(四分位数)为200(186,213) CFU/100 mL。终末漂洗用纯水为医院供水系统集中供应,于是采用过氧乙酸对纯水运行管路进行彻底消毒,一周后再次采集10份内镜终末漂洗用纯水检测均合格,染菌量最大值为8 CFU/100 mL,中位数(四分位数)为1.5(0,6) CFU/100 mL。过氧乙酸消毒管路后终末漂洗用纯水染菌量低于消毒管路前,差异有统计学意义(Z=55.00,P<0.01)。见表1。
表1过氧乙酸消毒纯水运行管路前后终末漂洗用纯水监测结果
Table1Monitoring results of pure water for end-rinse before and after pure water supply pipeline was disinfected by peracetic acid
组别采样标本数量(份)合格数量(份)合格率(%)染菌量(CFU/100 mL)管路消毒前1000200(186,213)管路消毒后10101001.5(0,6)
2.2 清洗环节改进前后内镜监测结果 对纯水运行管路消毒后,再次模拟新内镜中心清洗消毒流程,采集10条清洗消毒内镜,2条内镜未达标,合格率为80.00%。对清洗环节进行逐一排查,发现酶洗过程存在问题,工作站自动化注入酶量比例为1∶668,未达1∶200有效浓度,调整自动化注入酶时间使其达到有效浓度,调整后再次采集12条人工清洗内镜标本,合格率为91.67%。
2.3 AER自身消毒前后空载运行后水标本监测结果 采集10份AER空载运行后水标本,合格率为30.00%,染菌量最大值为200 CFU/100 mL,中位数(四分位数)为97.5(8,175) CFU/100 mL。按照厂家说明书对新AER进行消毒,一周后采集消毒机内纯水10份,合格率为100%,染菌量的最大值为6 CFU/100 mL,中位数(四分位数)为4(1.75,6.00) CFU/100 mL。AER自身消毒前后,清洗消毒机空载运行后水标本染菌量比较,差异有统计学意义(Z=56.50,P<0.01)。见表2。
表2AER自身消毒前后机器空载运行后水标本监测结果
Table2Monitoring results of water specimen from AER at on-load condition before and after disinfection

组别采样标本数量(份)合格数量(份)合格率(%)染菌量(CFU/100 mL)消毒前1033097.5(8,175)消毒后10101004(1.75,6.00)
2.4 内镜清洗消毒方法改进 经过持续改进,依然有1条内镜检测不合格。考虑内镜管腔有生物膜附着,于是采用AER用2 000 mg/L过氧乙酸对内镜进行清洗消毒,改进后先后5次采样,合格率均达100%。
3 讨论
消化内镜是胃肠道疾病诊断和治疗的重要组成部分,作为可重复使用设备,胃肠道内镜不可避免会遇到病原体可能污染后续患者的事件,特别是对高龄或免疫抑制的患者。清洗、消毒、灭菌是控制医院感染的重要措施,昂贵内镜非一次性耗材,其清洗、消毒质量直接关系患者的医疗安全[5]。国内外对内镜清洗消毒不合格原因分析的研究逐年增多,但对新内镜中心启用之前内镜清洗消毒质量研究还较为少见。除内镜日常清洗消毒不合格的原因,如内镜清洗不彻底、消毒剂浓度不够等,新内镜中心启用有需要特别关注的重点。本研究通过分析新内镜中心验收过程中模拟清洗消毒检测不合格的可能原因,从纯水改进、清洗消毒环节改进、自动清洗消毒机改进、内镜清洗消毒方法改进等角度进行逐步分析整改,为新内镜中心后续正常运行奠定基础。
本研究发现,纯水运行管路消毒前人工清洗内镜终末漂洗用纯水检测,合格率为0,染菌量四分位数为200(186,213) CFU/100 mL,考虑内镜终末漂洗用纯水来源存在严重微生物污染可能,之后用过氧乙酸对纯水运行管路进行彻底消毒,检测合格率提高至100.00%,染菌量中位数(四分位数)降低至1.5(0,6)CFU/100 mL,差异有统计学意义(P<0.01),说明内镜终末漂洗用水的微生物污染与纯水供给管道未消毒密切相关。分析原因为新内镜中心纯水供给管道为全新管道,管壁内含有大量微生物,很容易造成内镜清洗消毒过程的二次污染,因此在使用前对其进行全面消毒是必不可少的步骤。医院供水系统是感染来源之一,需要干预与控制[6],软水或纯水易在储存和灌装过程中造成二次污染[7]。消化内镜消毒效果是否合格,不仅与消毒剂有关,还与清洗过程、冲洗用水等多方面因素相关,消化内镜终末漂洗用水不同于治疗用水,虽然与人体不直接接触,但可能导致消毒后的消化内镜再次被污染[8],《2016年软式内镜规范》对软式内镜终末漂洗用水提出了更高要求。有必要将内镜冲洗用水纳入医院消毒质量监控范围,加强医院内镜冲洗用水的管理[9]。本研究提示,对于新启用内镜中心需关注内镜用纯水供给管道的自身消毒。
消化内镜规范清洗是保障消毒质量的前提,消化内镜使用后在管道中残存脂肪、血液以及黏液等成分,如若清洗不充分,在消毒剂浸泡时会引发蛋白凝固,不但阻碍消毒剂有效穿透形成,同时也对孔道造成阻塞,进而影响最终的消毒效果[10]。多酶清洗液具有迅速、有效等特点,能够完全分解人体分泌物,如蛋白质、黏多糖、碳水化合物以及各种脂类等,达到彻底清除污染物,阻断细菌滋生的目的[11]。目前,内镜中心多应用集成内镜清洗设备,酶液注入时间和注入量均自动控制。酶洗环节使用循环清洗,多酶液在内镜各管腔进行重复循环,使内镜表面和管道有机成分得以充分分解,清洗质量得到保障,消毒效果进一步提高[12]。本研究中新内镜中心应用集成内镜清洗设备,酶液每秒注入量固定5 mL,改进前注入时间6 s,酶洗环节注入水量20 L,注入后酶液浓度约1∶668,未达酶液有效浓度(说明书有效浓度需达1∶200);改进后将注入时间改为21 s,使注入后酶液浓度达有效浓度。新内镜中心在纯水供给管道消毒的基础上,调整酶洗环节注酶量,人工清洗内镜微生物检测合格率由83.33%提高至91.67%。对酶洗环节,日常工作关注较多的是酶液一镜一用一更换[13]。本研究结果提示,在新设备启用时也应关注酶液是否达到有效浓度。
目前,AER已成为软式内镜再处理的重要组成部分,与人工清洗处理相比,AER具有标准化水平高、感染危险度低等优点,临床应用日趋广泛[14]。AER采用程序化自动控制,减少必要的人为处理步骤的可能性,消毒效果可靠,同时减少人员暴露于消毒剂的次数,有效节省人力资源[15]。《2016年软式内镜规范》规定内镜清洗消毒机新安装或维修后,应对清洗消毒后内镜进行微生物学监测,检测合格后方可使用。本研究新内镜中心AER均为新购置机器,采样10份空置运行AER内纯水标本,微生物检测合格率为30.00%,染菌量四分位数为97.5(8,175) CFU/100 mL,分析原因,怀疑与新AER在使用前未进行自身消毒有关。按照厂家说明书对新AER消毒后,再次采样10份空置运行AER内纯水标本,合格率提升至100%,染菌量中位数(四分位数)降低至4(1.75,6.00) CFU/100 mL,差异有统计学意义(P<0.01)。说明新启用AER需进行自身消毒且微生物检测合格后方可使用,否则可能导致内镜微生物超标,存在患者感染的隐患。
Nwokediuko等[16]研究认为,病原体形成生物膜结构是抵抗消毒剂穿透,进而造成消毒、灭菌失败的主要原因。幽门螺杆菌、大肠埃希菌等附着在内镜管腔后呈集落状聚集,并在周围被覆黏液物质或细菌碎片包围,形成蘑菇样结构——菌膜,为细菌营养代谢、繁殖以及抵御不良环境提供保护层。即使严格遵照处理规程进行清洗消毒, 仍有2%立即使用的内镜带菌[17],细菌生物膜的形成是导致此种现象的可能原因[18-19]。国内有研究证实,3种消毒剂去除生物膜效率由高至低为2 000 mg/L过氧乙酸、5 500 mg/L邻苯二甲醛、20 g/L戊二醛[20]。验收过程虽经模拟测试多次改进,仍发现1条内镜检测不合格,结合该内镜已使用数年,考虑管腔内有生物膜形成。于是用2 000 mg/L过氧乙酸对该内镜进行清洗消毒,之后先后进行5次采样,合格率均为100%,说明该内镜管腔内确有生物膜附着,是造成反复检测不合格的主要原因。
本研究对新内镜中心验收过程中模拟清洗消毒不合格的原因进行分析,发现新内镜中心纯水供给管道未消毒、内镜清洗环节中酶液浓度错误、AER未进行自身消毒、内镜管腔生物膜形成是此次新内镜中心验收过程中发现的问题,针对性改进后,问题得到解决。影响内镜清洗消毒质量的因素众多,以上仅是本次研究发现的问题,主要是新内镜中心启用前容易忽视的危险因素及解决方法,希望对需要搬迁的新内镜中心起到临床参考作用。本研究也存在一定的局限性,由于是验收过程发现的问题,纳入研究对象的数量相对偏少,未来还需医疗同仁进一步验证。

