HMGB1在呼吸道合胞病毒支气管肺炎患儿中的作用及机制
胡 俊
云南省第二人民医院 儿科(昆明 650000)
呼吸道合胞病毒(respiratory syncytial virus, RSV)是全球婴幼儿和老年人呼吸道感染的主要诱因,其发生机制、治疗手段尚不清楚。高迁移率族蛋白1(high-mobility group box 1, HMGB1)是一种核蛋白,在胰腺炎、脓毒症、肿瘤、风湿免疫等疾病中高表达,并可分泌到细胞外,发挥致炎作用[1-4]。Toll样受体4(toll-like receptor, TLR4)是一种重要的免疫识别受体,与外界微生物、药物等相互作用后,激活核转录因子(nuclear factor kappa B, NFκB),引起下游炎性因子释放[5-6]。Kaumu等[7-8]发现HMGB1在腺病毒感染、葡萄球菌感染致肺炎中具有重要作用。但目前HMGB1在合胞病毒感染肺炎中鲜有报道,且机制尚不清楚。因此,本研究选取合胞病毒肺炎患儿与健康儿童作比较,明确HMGB1是否通过参与某条与炎症相关的通路发挥致炎作用,并从细胞水平确定HMGB1在呼吸道合胞病毒支气管肺炎患儿中的作用及机制。
1 资料与方法
1.1 临床资料
选取2016年6月至2017年6月在云南省第二人民医院就诊的46例呼吸道合胞病毒支气管肺炎患儿作为实验组,其中男23例,女23例,年龄2个月至2岁。选取同期在本院体检的正常儿童46例作为对照组 ,其中男25例,女21例,年龄2个月至2岁。本文所有临床操作均获取知情同意,并经伦理委员会批准。两组儿童年龄、性别一般资料进行比较,差异无统计学意义 (P>0.05) (表1)。
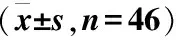
表1 研究对象基线资料比较
1.2 纳入标准与排除标准
纳入标准:1)支气管肺炎患儿:临床表现为发热、咳嗽、气促,肺部固定性的中、细湿啰音,X线检查,早期见肺纹理增粗,以后出现小斑片状阴影; 2)呼吸道合胞病毒感染:根据病毒学及血清学进行合胞病毒感染的快速诊断。排除标准: 1)合并有心肝肾等严重基础疾病的患儿; 2)此前就患有肝炎、肾炎等感染疾病或者患有先天性心肺类病症以及有免疫缺陷病症的患者; 3)患者的体质为过敏性; 4)患者肺部还存在其他病症。
1.3 酶联免疫吸附试验
采集对照组和实验组外周静脉血2 mL于抗凝管,离心分离血浆,置于-80 ℃待测。应用酶联免疫吸附试验 (enzyme linked immunosorbent assay, ELISA)法测定血清中炎性因子IL-1β、IL-6、IL-8、TNF-α、hs-CRP的浓度,实验步骤根据美国eBioscience试剂盒说明书执行。
1.4 流式分析
采集对照组和实验组外周静脉血2 mL于抗凝管,淋巴细胞分离液 (索莱宝)分离单个核细胞。经固定破膜试剂盒 (美国Invitrogen公司)使细胞固定破膜后,用抗TLR4抗体 (英国Abcam公司)和抗NFκB (英国Abcam公司)抗体孵育,流式细胞分析表达TLR4和NFκB的单个核细胞百分比。
1.5 蛋白质免疫印迹
用IP裂解液(thermo fisher scientific)裂解并收集细胞,使用BCA蛋白浓度测定试剂盒 (上海碧云天生物技术有限公司)检测总蛋白浓度。加入适量的SDS-PAGE上样缓冲液 (上海碧云天生物技术有限公司),100 ℃沸水浴10 min后冰上冷却。取20 μg蛋白样品进行SDS-PAGE电泳,在室温下用5% 的脱脂奶粉封闭2 h,然后用HMGB1、TLR4、NFκB的一抗4 ℃孵育过夜。PBST洗涤3次后,用对应的辣根过氧化物酶标记的二抗室温孵育2 h。洗涤3次后,用ECL显色液 (上海碧云天生物技术有限公司)显色,于凝胶成像仪器下曝光和拍照。使用Image J软件测定灰度值。
1.6 人支气管上皮细胞NHBE的培养、RSV的培养和RSV感染
人支气管上皮细胞NHBE的培养:NHBE细胞株购买于中国科学院细胞库,是一株贴壁细胞,使用10%胎牛血清 (美国Gibco公司)的DMEM培养液(美国Gibco公司)培养于37 ℃、5% CO2培养箱中。RSV的培养:将滤菌处理的RSV接种至培养好的Hep-2细胞扩大培养,吸附2 h后于无血清DMEM中加入3%的胎牛血清培养,观察细胞生长情况,待80%细胞出现特征性病变时,收集病毒并测定滴度,将滴度稀释至8~9 log10 PFU/mL,保存于-80 ℃。RSV感染:将NHBE细胞接种于48孔细胞板中,待培养孔中细胞长至80%满时,接种0.1 mL RSV 病毒,吸附1 h后,于无血清DMEM中加入3%的胎牛血清培养。
1.7 shRNA及质粒转染
根据GenBank数据库HMGB1的核苷酸序列,设计合成HMGB1 shRNA序列(shHMGB1)和无义序列 (Scramble),序列合成于上海生工生物工程股份有限公司,构建于pLKO.1质粒上。质粒转染24 h前,接种5×105个细胞至6孔细胞培养板培养,转染30 min前换无血清DMEM培养液培养。将200 μL 无血清DMEM、3 μg质粒、9 μL ViaFect Transfection Reagent (美国Promega)混合,即转染液,室温静置10 min。将转染液加入至6孔板中,轻轻混匀后放置于细胞培养箱中继续培养9 h,转染结束后换用10%胎牛血清的DMEM培养液继续培养24 h。随后,Scramble和shHMGB1转染的细胞即为无义序列组和HMGB1干扰组(表2)。

表2 shRNA序列
1.8 统计学方法

2 结果
2.1 两组儿童血清中炎性因子含量的比较
与对照组相比,试验组外周血中IL-6、IL-8、TNF-α、hs-CRP表达明显较高,差异具有统计学意义 (P<0.05)(表3、图1)。
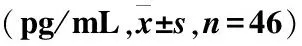
表3 两组儿童血清中炎性因子含量的比较
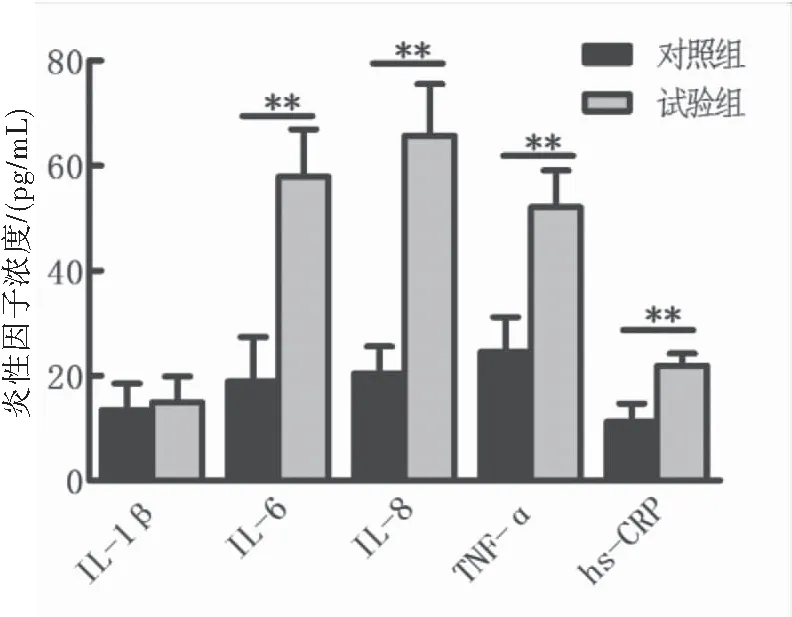
图1ELISA检测两组儿童外周血中促炎细胞因子IL-1β、IL-6、IL-8、TNF-α、hs-CRP的浓度
注:与对照组比较,**P<0.01
2.2 两组儿童血清中HMGB1含量的比较
LISA检测两组儿童血清中HMGB1的浓度,结果显示试验组儿童外周血分泌的HMGB1 (55.75±4.23 pg/mL)明显高于对照组儿童外周血分泌的HMGB1 (15.06±5.68 pg/mL),差异有统计学意义 (P<0.01)(表3、图2)。
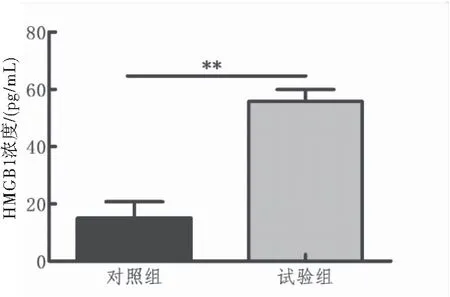
图2ELISA检测两组儿童血清中HMGB1的浓度
注:与对照组比较,**P<0.01
2.3 两组儿童外周血单个核细胞TLR4和NFκB的表达比较
在合胞病毒支气管肺炎患儿外周血中有25%的单个核细胞表达TLR4,是健康儿童组的5倍,差异具有统计学意义(P<0.01)(图3A)。在合胞病毒支气管肺炎患儿外周血中有80%的单个核细胞表达NFκB,是健康儿童组的4倍,差异具有统计学意义(P<0.01)(图3B)。
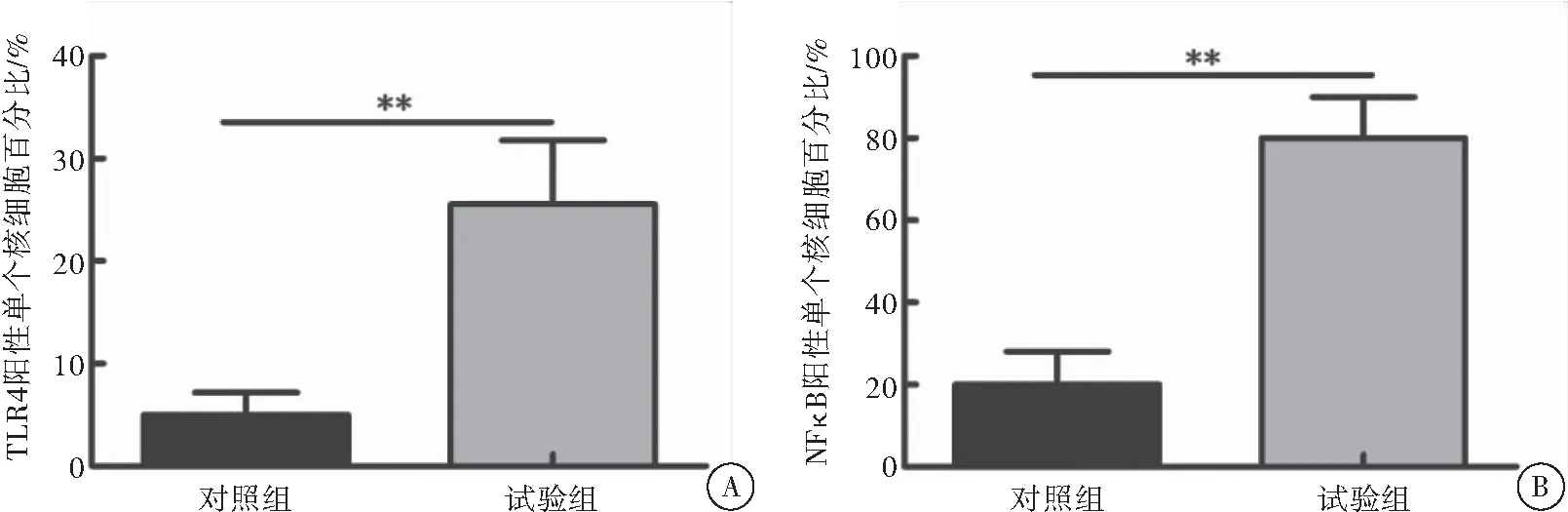
图3 流式细胞分析两组儿童外周血中表达TLR4和NFκB的单个核细胞数量
注:A:TLR4阳性单个核细胞占血浆总细胞百分比,与对照组相比,**P<0.01;B:NFκB阳性单个核细胞占血浆总细胞百分比,与对照组相比,**P<0.01
2.4 HMGB1 shRNA转染对合胞病毒诱导NHBE细胞TLR4和NFκB表达的影响
与合胞病毒感染的无义序列转染组比较,合胞病毒感染的HMGB1干扰组TLR4 (t=17.62,P<0.01)和NFκB (t=14.88,P<0.01)表达明显降低,差异具有统计学意义(图4A~D)。
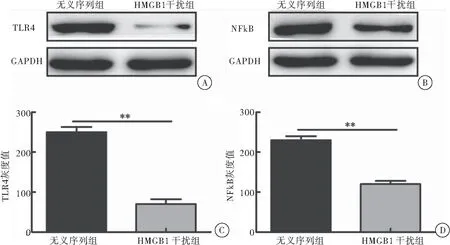
图4 HMGB1干扰组在合胞病毒感染后TLR4和NFκB的表达
注: A:Western blot检测TLR4的表达; B:Western blot检测NFκB的表达; C: 灰度分析TLR4的表达水平,与对照组相比较,**P<0.01; D:灰度分析NFκB的表达水平,与对照组相比较,**P<0.01
2.5 合胞病毒诱导支气管上皮细胞分泌HMGB1和表达TLR4、NFκB
与未用合胞病毒处理的NHBE相比较,合胞病毒感染的NHBE分泌的炎性因子IL-6、IL-8、TNF-α、hs-CRP和HMGB1较高,差异具有统计学意义(表4、图5A~B)。同时与未用合胞病毒感染的NHBE相比较,合胞病毒感染的NHBE的 TLR4(t=26.10,P<0.01)和NFκB(t=27.23,P<0.01)表达较高,差异具有统计学意义(图5C~F)。
表4 两组儿童血清中炎性因子含量的比较
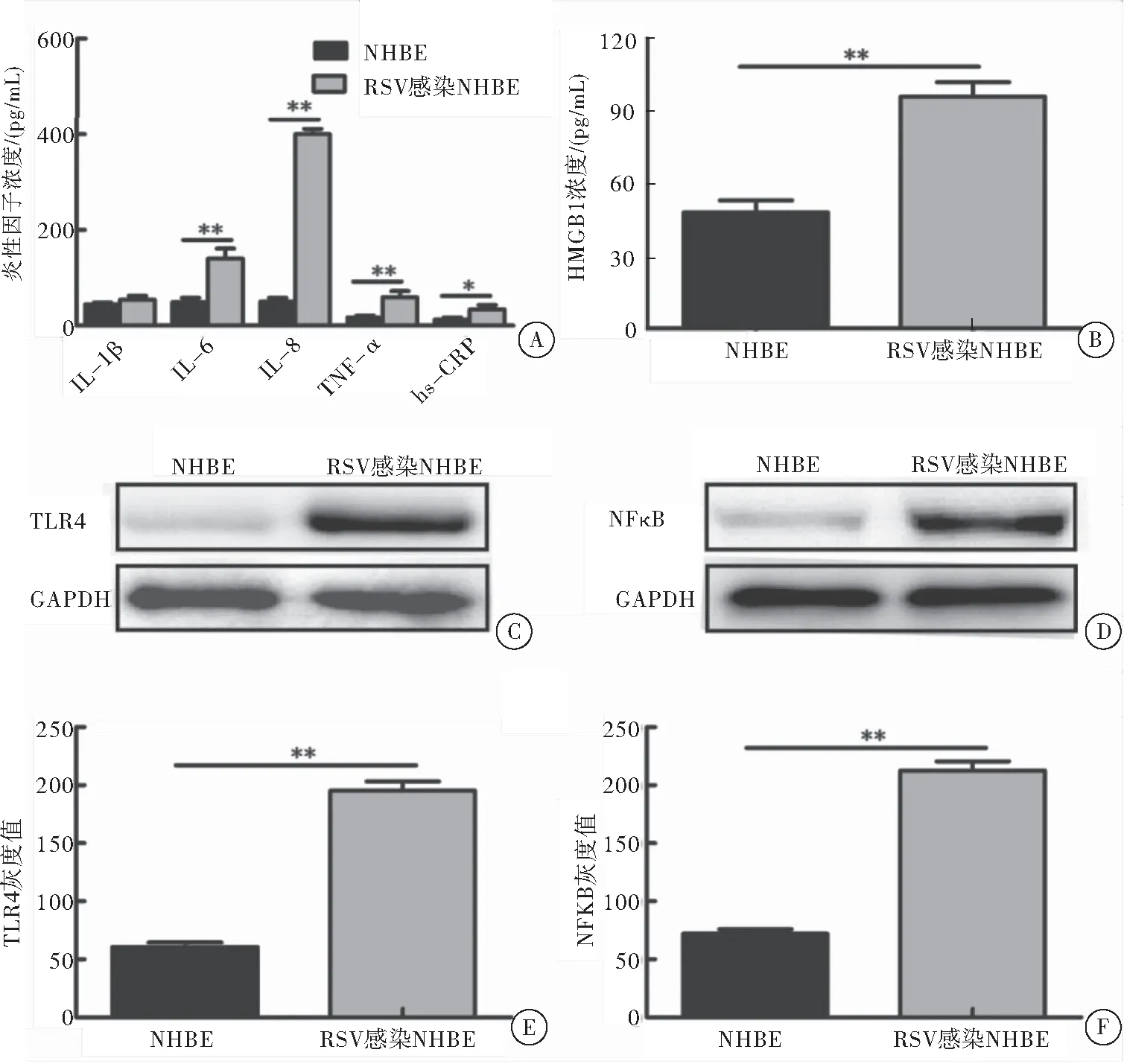
图5RSV支气管上皮细胞NHBE感染合胞病毒后HMGB1和炎性因子的分泌以及TLR4、NFκB的表达
注:A:细胞培养上清炎性因子的浓度,与对照组相比较,**P<0.01,*P<0.05;B:细胞培养上清HMGB1的浓度,与对照组相比较,**P<0.01;C:Western blot检测TLR4的表达;D:Western blot检测NFκB的表达;E:灰度分析TLR4的表达水平,与对照组比较,**P<0.01;F:灰度分析NFκB的表达水平,与对照组相比较,**P<0.01
3 讨论
小儿气道发育不完全,免疫能力较弱,易受细菌、病毒的感染,诱发肺炎疾病发生[9-10]。 RSV 为引起小儿支气管肺炎常见的病原微生物之一,属RNA病毒,可促使Th1/Th2失衡,刺激TNF-α、IL-18等炎性因子的分泌,加重炎症病情,甚至发展成呼吸循环衰竭,导致小儿死亡[10]。
HMGB1是典型的位于细胞核中的25 kDa DNA结合蛋白,但在翻译后修饰(如乙酰化、磷酸化和甲基化)之后,它可以转运到细胞质中,待细胞活化或死亡后被释放到细胞外[11-12]。HMGB1最初被表征为转录因子和生长因子,但后来研究[13-15]发现HMGB1在许多炎症性疾病中扮演着细胞因子调节剂的角色。在各种RNA病毒 (包括流感病毒H5N1、丙型肝炎病毒、西尼罗病毒、登革病毒和HIV-1)[16-17]和DNA病毒(如单纯疱疹病毒2型)[18]的发病机制中,HMGB1的释放发挥了重要的作用。目前关于HMGB1在合胞病毒支气管肺炎中研究很少,且机制尚不明确。最近关于HMGB1在哮喘和COPD的研究[19-21]发现HMGB1参与了肺部炎症的发展过程,为本研究提供了强有力的依据。本研究从生物个体和细胞层面发现,RSV感染诱导HMGB1蛋白从细胞核向细胞质的转运,并诱导其分泌到胞外环境。并且,RSV感染诱导支气管上皮细胞导致HMGB1从细胞核向细胞质易位并随后分泌到细胞外的过程是独立于细胞死亡而发生的。这是因为本研究在病毒感染的24 h内没有看到任何明显增加细胞凋亡、坏死或细胞病变的现象发生。
尽管本研究初步探讨了HMGB1在呼吸道合胞病毒支气管肺炎患儿中的作用及机制,但是仍然有许多不足之处:1)本研究采集了合胞病毒支气管肺炎患儿的外周血,并对其中的HMGB1、TLR4/NFκB、炎性因子的表达量进行了检测。但炎症反应的发生是炎性因子和机体免疫对抗的过程,本研究只涉及了炎性因子的分泌情况,忽略了免疫细胞的浸润和变化的研究;2)本研究只在一株支气管上皮细胞进行机制研究,缺乏普遍性;3)本文仅将HMGB进行干扰以研究后续的生物学效应,而干扰TLR4、NFκB又能否达到相同的效应,以及干扰HMGB1再过表达TLR4是否会恢复下游蛋白的表达;4)本文仅在体外细胞水平探讨TLR4/NFκB信号通路的作用,实验结果的稳定性和可靠性均不如动物实验,因此仍然需要进一步构建体内动物模型以验证结论。
综上所述,在本研究中,本研究通过生物个体即合胞病毒支气管肺炎患儿的外周血样品发现HMGB1、TLR4/NFκB、炎性因子的正相关关系。进一步从细胞层面证明了合胞病毒感染可同时促进HMGB1、TLR4/NFκB、炎性因子的表达与分泌。因此我们推测HMGB1很可能参与了TLR4/NFκB致炎信号通路,促使炎性因子的分泌增加。合胞病毒感染HMGB1干扰细胞株结果发现,合胞病毒感染不再诱导TLR4/NFκB的表达和炎性因子的分泌。综上所述,HMGB1及其介导的TLR4/NFκB信号通路在呼吸道合胞病毒支气管肺炎患儿中高表达,特异性阻断HMGB1可抑制TLR4/NFκB信号通路,缓解呼吸道合胞病毒诱导支气管上皮细胞分泌炎性因子。

