重症急性胰腺炎并发腹腔感染患者预后的影响因素分析*
陈晓华,李代彪,徐茂雨
1.南充市中心医院 重症医学科(南充 637000);2.南充市中心医院 急诊科(南充 637000);3.南充市中心医院 门诊部(南充 637000)
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床常见外科急腹症,病情凶险,病死率高达10%~30%[1]。腹腔感染(abdominal infections complation,AIC)是SAP严重并发症,可降低患者免疫力,加重患者病情,且易诱发或加重多器官功能障碍综合征(multiple organs dysfunction syndrome,MODS),这些都是导致患者病死率高的重要原因[2]。目前,临床治疗SAP多采取补液扩容及营养支持等内科综合治疗,旨在缓解患者胃肠功能障碍。如何提高SAP患者生存率是临床长期致力解决的难题,而影响患者预后的因素至今仍不清晰。为此,本研究回顾性分析2016年2月至2018年2月本院131例SAP并发AIC患者临床资料,探讨影响患者预后的相关因素,以期为临床治疗提供参考。
1 资料与方法
1.1 临床资料
收集2016年2月至2018年2月在南充市中心医院重症医学科收治的SAP并发AIC患者131例。纳入标准:1)符合2013年《中国急性胰腺炎诊治指南》[3]中相关诊断标准;2)年龄≥18岁;3)发病72 h入院;4)入院时急性生理学与慢性健康状况评分(acute physiology andchron ic health evaluationⅡ,APACHEⅡ)≥8分。排除标准:1)恶性肿瘤患者;2)伴其他严重影响预后的疾病(如肝肾衰竭)者;3)临床资料不完整者。其中男77例,女54例;年龄18~74(49.12±12.38)岁;入院时APACHEⅡ评分8~18(11.62±3.71)分。
1.2 方法
入院后收集患者人口学特征、既往史、现病史、实验室检查等资料,包括性别、年龄、病因、是否伴基础疾病、器官障碍数目、膀胱压、CT评分、APACHEⅡ评分、Ranson评分、动脉血气分析、血淀粉酶、血白蛋白、血钙、血糖、血肌酐、白细胞计数(white blood cell,WBC)、红细胞压积(hematocrit,HCT)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplatin time,APTT)。实验室指标均取入院48 h内最差值,并统计患者病情转归情况,以出院时间为观察终点,将患者按预后分为存活组(包括治愈和病情稳定后顺利出院者)和死亡组(包括死亡及因严重器官衰竭而自动出院者),比较两组临床资料的差异。
1.3 统计学方法

2 结果
2.1 临床转归
131例患者,平均住院时间(33.58±10.67)d,入住ICU时间(6.37±4.29)d,存活103例(78.63%)[治愈82例(62.60%),好转21例(16.03%)],死亡28例(21.37%)。
2.2 单因素分析
与存活组相比,死亡组器官障碍数目≥2个、膀胱压>25 mm Hg、WBC、HCT、TC、TG、APACHEⅡ评分、Ranson评分均更高(P<0.05),血氧分压较低(P<0.05)。两组性别、年龄、病因、合并基础疾病情况、CT评分及血淀粉酶、血蛋白、血钙、血糖、血肌酐、LDL-C、PT、APTT水平比较,差异均无统计学意义(P>0.05)(表1)。
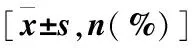
表1 存活组与死亡组临床资料比较
2.3 多因素Logistic回归分析
以是否死亡为因变量,以单因素分析中有统计学意义(P<0.05)的因素为自变量行Logistic回归分析。结果显示,器官障碍数目、膀胱压、血氧分压、WBC、TG、APACHEⅡ评分均为SAP并发AIC患者死亡的影响因素(P<0.05)(表2)。
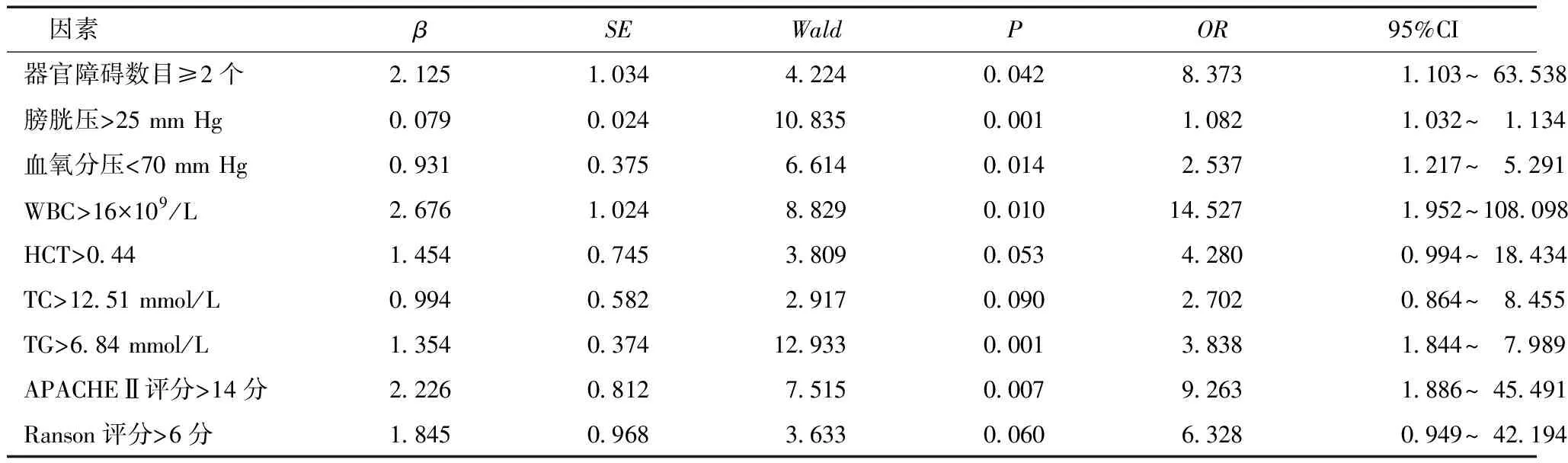
表2 影响SAP并发AIC患者预后的多因素Logistic回归分析
3 讨论
SAP是重症医学科常见危重症,主要特征表现为胰腺弥漫出血及脂肪组织坏死,该病起病急骤、病情进展迅速、凶险、死亡率高[4]。临床上SAP治疗模式经历多次变迁,目前正由早期通过外科手术置入引流管引流的处理方式逐步过渡到补液扩容等内科综合治疗策略,但患者预后仍不理想,病死率仍居高不下[5]。SAP并发AIC患者病程长,病情更为复杂多变,预后不良风险亦增加。本研究显示,131例SAP并发AIC患者总病死率为21.37%。因此,如能总结分析SAP并发AIC患者死亡的影响因素,可为临床治疗提供重要指导,对改善患者预后有重要意义。
本研究中,器官障碍数目≥2个是SAP并发AIC患者死亡的危险因素。MODS是SAP患者常见并发症,以心、肺、肾受累为主,表现为难以纠正的顽固性低氧血症,并累及循环系统。Isenmann等[6]曾将在发病早期即合并复杂器官功能障碍的急性胰腺炎定义为SAP,该类患者死亡率增高。研究[7]发现,SAP发病7 d内出现难治性器官功能衰竭往往预示着极高死亡风险,是评估早期SAP病情严重程度的重要指标,这都从侧面支持了本研究结果。本研究还显示,血氧分压低是患者死亡的危险因素,这与既往报道[8]一致。血氧分压低提示患者早期肺功能可能存在损伤,易致急行呼吸窘迫综合征,从而增加死亡风险[9]。因此,对于入院是有血氧分压低表现者应引起极大重视,积极采取对症治疗。
膀胱压和腹内压密切相关,可很好地反映腹内压水平。膀胱压>25 mm Hg提示患者腹内压较高,此时静脉回流量减少,心输出量及肾血流量降低,并出现通气障碍,多器官功能损伤,从而使得预后恶化[10]。本研究显示,膀胱压>25 mm Hg是患者预后的独立危险因素。有研究[11]认为,SAP急性反应期液体大量渗出,使得后腹腔液体积聚加重,这本身会造成腹压升高,渗出物中炎性因子引起腹腔组织炎性反应加重,进而引起组织水肿;此外,在SAP治疗过程中,大量补液会使水肿进一步加重,从而使得腹压持续增高。但也有报道[12]显示,SAP生存组与死亡组腹内压无统计学差异。
WBC是临床应用广泛的炎症标志物。研究表明,WBC是急性胰腺炎患者发生肺部感染、胸腔积液、腹腔积液、假性囊肿、肝功能异常、肠麻痹等并发症及死亡的危险因素[13]。本研究亦显示,WBC水平增高与SAP并发AIC患者死亡相关。SAP患者胰腺组织损伤严重,巨噬细胞等明显激活,使得内皮细胞和WBC活性增加,炎症因子大量产生,继而出现瀑布效应,炎性介质大量释放,引起炎症级联反应,炎症反应持续加重、扩散,最终诱发一系列并发症,导致死亡[14]。血脂水平能够反映体内脂类代谢的动态变化,高脂血症与SAP发生有密切关联[15]。本研究显示,TG水平增高是SAP并发AIC患者死亡的危险因素。该结果提示可通过降低血脂水平来改善患者预后。
研究[16-17]表明,APACHE II评分增高与SAP患者预后不良相关。本研究同样显示,APACHE II评分增高是患者死亡的危险因素。研究[18]显示,SAP患者APACHE II评分增高、胰腺组织坏死范围增大往往预示着预后不良。APACHE II评分一方面能够反映机体慢性生理状况,另一方面又可反映急性应激程度,此二者均可对患者预后造成一定影响。
综上所述,SAP并发AIC患者病死率较高,器官障碍数目、膀胱压、血氧分压、WBC、TG、APACHEⅡ评分均是影响患者预后的独立危险因素,临床应根据这些因素对疾病做出准确判断。

