高血糖状态下牙龈卟啉单胞菌对大鼠肝脏的影响*
杜 芹,孟 姝,裴心佛,4Δ
1.四川省医学科学院·四川省人民医院 口腔科(成都 610072);2.电子科技大学附属医学院(成都 610054);3.四川大学华西口腔医院 牙周科(成都610041);4.上海交通大学附属新华医院 口腔科(上海 200240)
牙周炎是牙龈的慢性炎症,是口腔内最高发的感染性疾病之一[1]。牙周炎和糖尿病为双向关系,许多研究[2]证明在糖尿病基础上,牙周疾病会加重胰岛素抵抗,但其分子生物学机制目前尚不清楚。牙龈卟啉单胞菌(porphyromonasgingivalis,P.g)是目前公认的主要牙周致病菌。研究[3]显示,在高血糖状态下,牙龈P.g可以通过口腔进入血液循环并远处定植在肝脏内,导致胰岛素抵抗,进一步加重脂糖代谢紊乱,但其机制尚不明确。
在高血糖状态时,晚期糖基化终产物积累,导致机体糖基化终产物受体(receptor for advanced glycation end-products,RAGE)表达上升。高迁移率族蛋白l (high mobility group protein box 1, HMGBl)是真核细胞核内的非组蛋白染色体结合蛋白,在细胞损伤或受到炎症剌激后被释放至细胞外并诱导细胞因子释放和招募白细胞触发和维持炎症反应。HMGB1是RAGE的重要配体,也是一种重要的晚期炎症因子[4]。近年研究[5]表明,HMGBl在肝脏胰岛素抵抗中也起到重要作用。本研究选取大鼠肝脏作为被研究的器官,在高血糖的基础上,多次尾静脉注射P.g模拟牙周致病菌长期微量入血,检测肝细胞形态学改变及肝脏组织中HMGB1、RAGE的表达变化,分析高血糖状态下牙周致病菌入血对肝脏的影响。
1 材料与方法
1.1 实验动物模型
实验选用4~6周龄雄性SD大鼠15只(四川大学华西医学实验动物中心提供) ,实验前适应性饲养1周,观察无明显全身疾患,无失牙及进食异常,纳入本实验。
按照随机数字表法将大鼠分为空白对照组(NC组),糖尿病组(DM组),糖尿病+静脉注射P.g组(DM+i.v.组),每组5只。各组动物均自由饮水,自由摄食,严格控制饲养条件。实验动物和实验条件均符合国家科学技术委员会颁布的《实验动物管理条例》及四川大学实验动物管理条例。DM组、DM+i.v.组自第2周开始,高脂饮食诱导4周+小剂量一次性腹腔注射链脲佐菌素(STZ)(25 mg/kg)建立大鼠糖尿病模型。术后改为普通饲料喂养,观察6周,记录DM组、DM+i.v.组随机血糖变化和体重变化,随机血糖>13.9 mmol/L 即认为达标。DM组和DM+i.v.组建立糖尿病模型后自第7周起,DM+i.v.组尾静脉注射P.g W83(×109CFU/mL)活菌悬液0.1 mL(每周3次,共6周),模拟P.g长期微量入血。DM组尾静脉注射PBS 0.1 mL(每周3次,共6周)。第13周,3组大鼠全麻下处死后取肝脏。
1.2 标本制备
1.2.1 肝脏标本制备 处死大鼠后,横膈膜下方约0.5 cm处作切口暴露腹腔,钝性分离肝包膜后腹主动脉灌流至肝脏呈黄色。取肝脏称重,切取肝门附近组织,4 °C生理盐水冲洗后浸泡于4 ℃多聚甲醛溶液中固定。固定好的肝脏标本,置入梯度酒精慢脱水,常规石蜡包埋。制备切片,涂有黏附剂的玻片上,烘干。
1.2.2 HE染色 取肝切片组织切片,进行常规HE染色,光镜下观察组织病理学变化。
1.2.3 免疫组化染色 按试剂手册步骤操作,染色结果统一曝光时间及亮度,BX53显微镜和照相系统(Olympus,Japan)随机选取400倍高倍镜下的5个视野进行拍摄。Image J 1.51处理图片,统一图片背景、阈值,计算出每个视野面积中阳性表达面积所占百分比(%Area),取平均值。
1.3 统计学方法

2 结果
2.1 大鼠肝脏组织组织形态学观察
NC组、DM组和DM+i.v.组大鼠肝脏组织经HE染色均未见明显的肝细胞脂肪变性或空泡样改变,或者其他明显的肝脏实质病变(图1)。
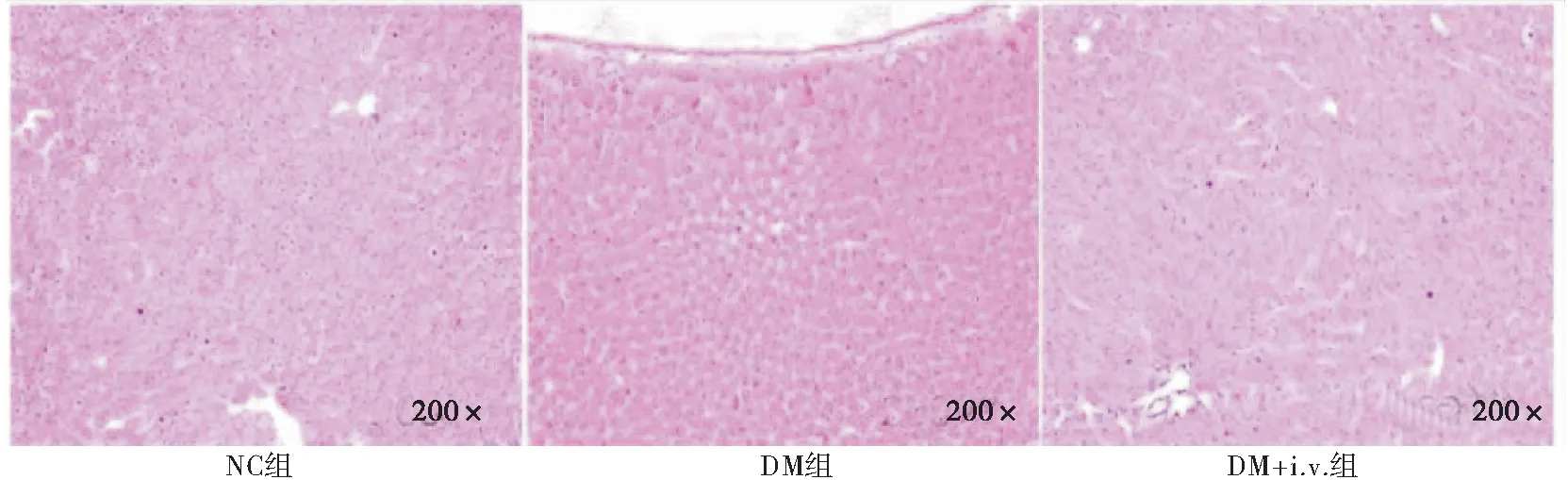
图1 3组大鼠肝脏组织HE染色
2.2 大鼠肝脏组织HMGB1、RAGE免疫组化染色
NC组,DM组,DM+i.v.组HMGB1、RAGE免疫组化阳性染色为棕色颗粒。
NC组HMGB1、RAGE的免疫组化染色基本没有发现阳性细胞;DM组HMGB1免疫组化染色可见细胞核棕染,染色相对DM+i.v.组较浅,RAGE广泛阳性表达,染色深浅与DM+i.v.组类似;DM+i.v.组HMGB1免疫组化染色阳性表达最广泛,染色最深,RAGE也可见广泛阳性表达。HMGB1表达多位于细胞核内,但尚未出现明显胞外表达(图2)。
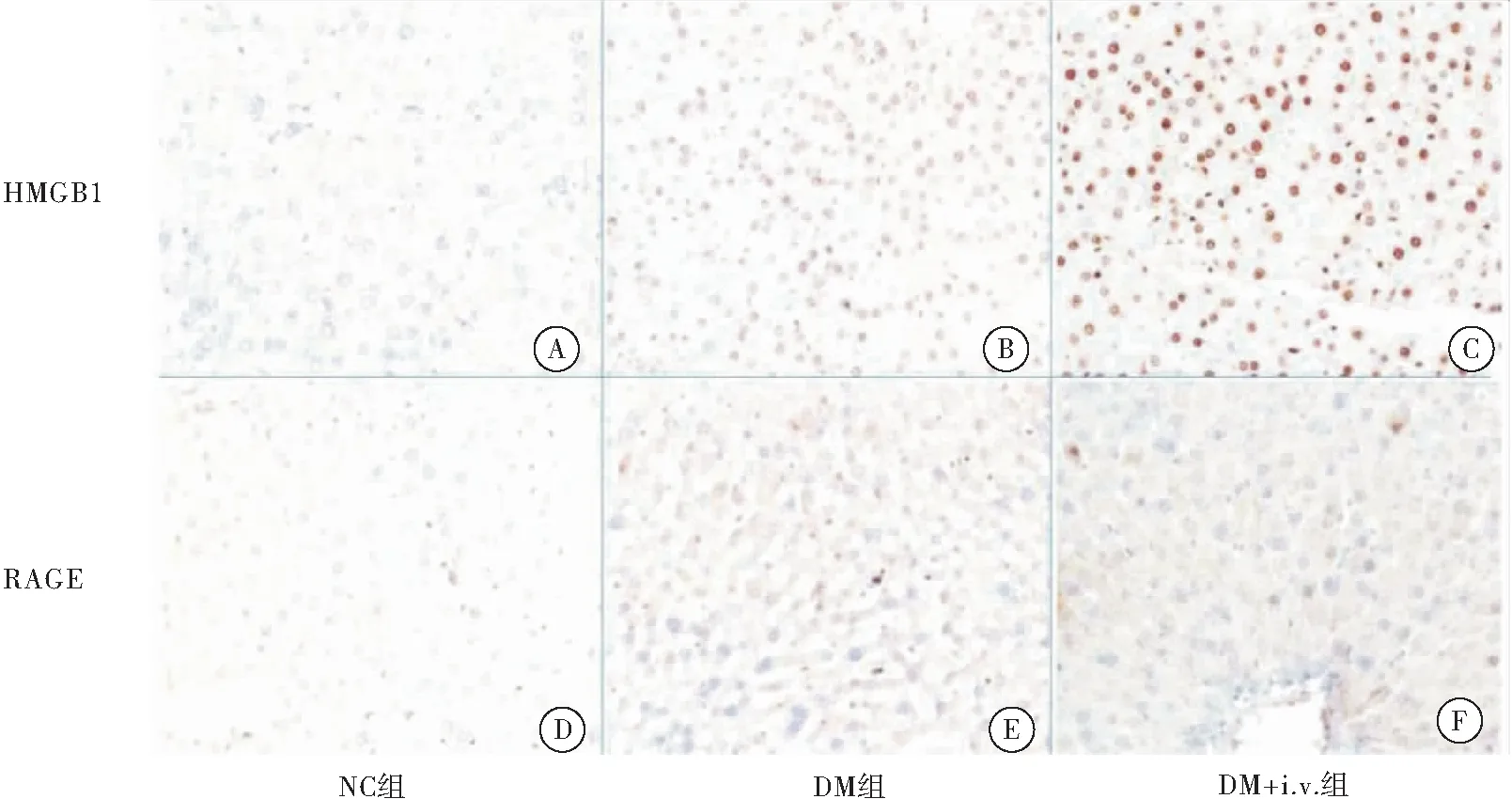
图2 3组大鼠肝脏组织中HMGB1、RAGE的表达
注:A:HMGB1在NC组中表达情况;B:HMGB1在DM组中表达情况;C:HMGB1在DM+i.v.组中表达情况;D:RAGE在NC组中表达情况;E:RAGE在DM组中表达情况;F:RAGE在DM+i.v.组中表达情况
2.3 肝脏组织免疫组化染色HMGB1、RAGE阳性表达面积平均百分比比较
DM+i.v.组 HMGB1阳性表达面积高于DM组(P<0.05),并且显著高于NC组(P<0.01);DM组和NC组比较,差异无统计学意义(P>0.05)。DM+i.v.组和DM组RAGE阳性表达面积百分比组间比较,差异无统计学意义(P>0.05),但均高于NC组,差异有统计学意义(P<0.05)(图3、表1)。
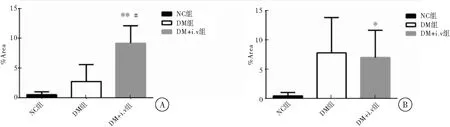
图3大鼠肝脏组织HMGB1,RAGE免疫组化染色平均阳性面积比率直方图。
注:A.肝脏HMGB1阳性面积比率;B:肝脏RAGE阳性面积比率
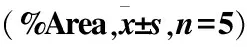
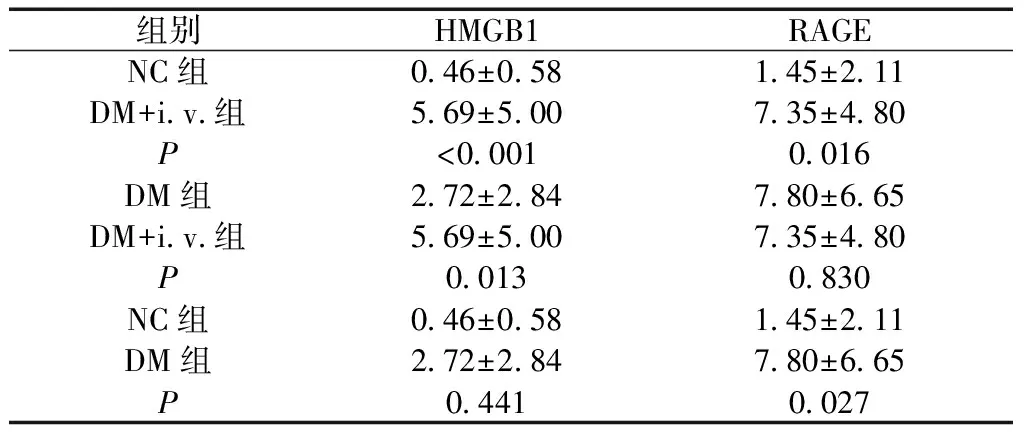
组别HMGB1RAGENC组0.46±0.581.45±2.11DM+i.v.组5.69±5.007.35±4.80P<0.0010.016DM组2.72±2.847.80±6.65DM+i.v.组5.69±5.007.35±4.80P0.013 0.830NC组0.46±0.581.45±2.11DM组2.72±2.847.80±6.65P0.4410.027
3 讨论
许多研究证明牙周疾病是引起胰岛素抵抗及加重糖尿病的危险因素之一,但具体机制尚不明确。牙龈 P.g是牙周炎病变区域或活动部位最主要的优势菌,与牙周炎治疗后复发或病情继续加重有关。目前有许多研究提示口腔内P.g可能会远处转移至肝脏。Ishikawa 等[3]用P.g感染小鼠口腔,在小鼠肝脏细胞中发现P.g的存在,且肝脏中的P.g为活细胞,能够被培养,感染P.g能够调节肝糖原合成,使小鼠血糖升高;其发现高血糖能够促进P.g远处转移至肝细胞中,但原因并不明确。另一项研究[6]发现,在非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)患者中,口腔内P.g的检出率均大大高于正常人,且在感染P.g的NAFLD人群中,糖尿病的发病率增加。同时发现P.g与变异链球菌、血链球菌、唾液链球菌具有独特增加体重和肝脏重量的特点。非酒精性脂肪性肝病为过剩的脂肪酸及脂代谢失衡导致肝组织中脂肪沉积,与糖尿病同为代谢性综合征的重要组分,二者联系密切。在另一项个案[7]报道中,研究者报告一位肥胖的非酒精性脂肪性肝炎合并严重牙周炎患者因败血症死亡后,解剖发现其肝细胞内有牙龈P.g定植。追踪其病史发现严重的牙周感染与其肥胖史时间一致。以上研究提示P.g能够远处转移至肝脏,且更倾向于在脂、糖代谢异常的高脂肪肝脏中聚集,进一步影响肝糖原合成,加重肝脏的胰岛素抵抗。
HMGB1是一种重要的晚期炎症介质[8],在细胞损伤或受到炎症剌激后被释放至细胞外,诱导细胞因子释放和招募白细胞触发和维持炎症反应。HMGBl的主要受体是RAGE[9]和Toll样受体(toll-like receptor, TLR),如TLR-2、 TLR-4和 TLR-9[10-11]。研究[12]表明HMGBl在多种肝损伤疾病中的表达水平升高。如在NAFLD的早期阶段,HMGBI-TLR4-MyD88信号转导通路起重要作用。Alisi等[13]证实在儿童NAFLD患者中HMGB1的循环水平升高,且其升高程度与肝炎和肝纤维化的严重程度密切相关。
本研究发现DM+i.v.组大鼠接受6周P.g菌悬液的微量注射期间,没有观察到大鼠的生活状态下降,无大鼠死亡,说明牙周致病菌入血对机体影响较为温和。肝细胞形态学未发生改变,说明肝脏的炎性状态尚未达到肝脏实质性病理损害的程度。
RAGE表达在DM+i.v.组、DM组间比较,差异无统计学意义,和两组都是糖尿病背景有关。DM+i.v.组在长期静脉注射P.g后,HMGB1组阳性表达面积明显高于NC组(P<0.01),并且在DM+i.v.组和DM组RAGE表达无差异的情况下,DM+i.v.组HMGB1表达也高于DM组(P<0.05),说明牙周致病菌长期微量入血,会刺激肝脏组织中HMGB1表达上调,导致肝脏出现炎症状态。由于RAGE表达在DM和DM+iv两组间比较,差异无统计学意义,推测HMGB1信号通路为其他途径,其具体机制尚需进一步研究。6周P.g菌悬液注射后,发现DM+i.v.组肝组织中HMGB1的高表达多位于细胞核内,还未出现明显的胞外表达,与肝细胞病理切片结果一致,也说明还没有到达病理性肝损伤的地步。
综上所述,本研究表明,在高血糖背景下,静脉注射P.g能够导致大鼠肝脏组织内炎症因子HMGB1异常高表达,其表达显著高于DM组和NC组,说明P.g长期微量入血,可能引起肝脏的炎症状态,但其具体机制尚需进一步研究。

