姜黄素对口腔鳞状细胞癌Tca8113细胞增殖及凋亡的影响
冯儒学,蔡仁刚,解丹丹
1.海南省干部疗养院(海南省老年病医院) 口腔科 (海口 571100);2.文昌市人民医院 口腔科 (文昌 571300);3.海南医学院第一附属医院 营养科(海口 570102)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最常见的口腔恶性肿瘤之一,在头颈癌中约占90%,在所有恶性肿瘤中占2%~4%,是导致头颈部癌症发病和死亡的主要因素[1-2]。OSCC是一种发生于口腔黏膜,以恶性程度高,易发生局部侵袭及颈部淋巴结转移,患者生存率低为特点的鳞状细胞癌。有研究[3]显示,OSCC是世界第八大癌症,5年存活率<60%,严重威胁人类的生命健康。近年来,OSCC虽然在治疗方法上取得了很大进展,但其发病率和病死率并未得到显著改善,且呈年轻化趋势。因此,寻找和发现具有抗口腔鳞状细胞癌的治疗药物具有十分重要的意义。
姜黄素是姜黄的主要活性成分,主要从姜黄的根茎中提取,在中国和印度作为中草药被广泛应用。近年来,姜黄素作为一种很有前景的新型天然化学物质,在化学预防和癌症化疗中得到了广泛的研究,这些研究[4-5]结果表明,姜黄素是一个高效、低毒的药物,可作用于多个分子靶点,选择性杀死具有低内在毒性的肿瘤细胞。大量研究证实,姜黄素对肿瘤细胞具有抑制作用,体外实验[6-8]结果显示,姜黄素对胃腺癌(SGC7901细胞)、前列腺癌(PC-M3细胞)、鼻咽癌(NCE细胞)、结肠癌(SW480细胞)及肺癌(A549细胞)等均有明显的抑制作用。动物体内实验[9]结果显示,姜黄素对S180细胞等移植瘤抑制率较高。进一步研究[10]发现,姜黄素可通过上调Bcl-2以及激活PI3K/AKT信号通路抑制喉癌细胞的增殖和促进凋亡。目前,关于姜黄素对口腔鳞状细胞癌的作用报道较少,因此本研究观察了姜黄素作用OSCC Tca8113细胞后,对其增殖和凋亡、凋亡相关蛋白及PI3K/AKT信号通路表达量的影响,并进一步研究了PI3K抑制剂LY294002、姜黄素单独及联合作用OSCC细胞后,PI3K/AKT信号通路蛋白表达量的变化,旨在探究姜黄素对OSCC细胞的抑制作用及其可能的作用机制。
1.1 材料与方法
1.1 实验材料
细胞株、药物及主要试剂:人OSCC Tca8113细胞购自美国ATCC公司;姜黄素购自美国Sigma公司;LY294002购自美国Selleck公司;胰岛素样生长因子-1(IGF-1)购自北京博奥森生物技术有限公司;胎牛血清、Trizol总RNA抽提试剂盒及RPMI1640培养液购自美国GIBCO公司;逆转录试剂盒购自大连Takara公司;单克隆抗体及辣根过氧化物标记的二抗购自北京博奥森生物技术有限公司;细胞凋亡检测试剂盒购自碧云天生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养 人OSCC Tca8113细胞置于含有10%胎牛血清、100 IU/mL青霉素和100 mg/mL的RPMI1640培养基中,于37 ℃、5%CO2的恒温细胞培养箱中培养。选取处于对数生长期的细胞进行实验。
1.2.2 细胞增殖检测 将对数生长期的Tca8113细胞制成1×104/mL的细胞悬液,以每孔100 μL接种至96孔培养板中进行培养,待细胞贴壁后,分别加入浓度为0、25、50、100 μmol/L的姜黄素及50 μmol/L顺铂各100 μL,每个药物浓度设6个重复孔。0 μmol/L姜黄素组作为空白对照组,顺铂组作为阳性对照组。分别孵育培养24、48 h后,每孔加入浓度为5 g/L的MTT(20 μL),避光孵育4 h后,弃上清,每孔加入DMSO(150 μL),震荡至紫色絮状物完全溶解(约10 min),于490 nm处用酶标仪检测吸光度(OD)值。
1.2.3 细胞凋亡检测 各处理组细胞培养48 h后,收集各组细胞制成细胞悬液, 500 r/min,离心5 min,离心半径10 cm,用磷酸缓冲液(PBS)清洗2次后加入binding buffer (500 μL),再分别加入Annexin V-FITC和Propidium lodide各5 μL混匀,避光室温孵育20 min,利用流式细胞仪检测细胞凋亡。
1.2.4 Western blot法检测细胞PI3K、Akt和p-Akt蛋白表达水平 细胞培养及处理同1.3.2,培养48 h后,进行PI3K、Akt和p-Akt蛋白表达的检测。收集培养后的细胞,使用细胞裂解液(RIPA)进行裂解,12 000 r/min,离心15 min,离心半径13.5 cm,收集上清液,使用BCA试剂盒测定蛋白含量。根据蛋白浓度检测结果,取25 μL 总蛋白进行 Western blot 检测。利用 5% 的脱脂奶粉封闭液封闭 2 h,一抗 4 ℃ 孵育过夜,二抗孵育 1 h,利用 tanon 5200 全自动化学发光 /荧光图像分析系统检验蛋白图像,计算蛋白相对表达量(目的蛋白灰度/β-actin灰度)。
1.2.5 QRT-PCR检测细胞PI3K、Akt和p-Akt mRNA表达水平 根据试剂盒操作步骤,采用Trizol法提取细胞总RNA,并使用反转录试剂盒进行cDNA合成。以cDNA模板进行PCR扩增,所用引物如表1所示。利用Mx3005P荧光定量PCR仪进行荧光定量检测。以 β-actin为内参,以 2-△△Ct 表示mRNA 的相对表达量(表1)。

表1 PCR扩增引物序列
1.2.6 姜黄素、LY294002及IGF-1对Tca8113细胞增殖及凋亡的影响 将对数生长期的Tca8113细胞制成1×104/mL的细胞悬液,以每孔100 μL接种至96孔培养板中进行培养,待细胞贴壁后,分别加入DMSO、姜黄素(100 μmol/L)、LY294002 (20 μmol/L)、IGF-1 (100 μg/L)、姜黄素+IGF-1各100 μL,每个药物浓度设6个重复孔。DMSO组作为空白对照组。分别孵育培养24、48 h后,分别采用MTT及流失细胞术检测细胞增殖及凋亡情况,具体操作如1.2.2和1.2.3。
1.2.7 姜黄素、LY294002及IGF-1对Tca8113细胞PI3K、Akt和p-Akt蛋白和mRNA表达水平的影响 细胞处理及培养同1.2.6,培养48 h后,进行PI3K、Akt和p-Akt蛋白和mRNA表达的检测。分别采用Western blot和RT-PCR检测蛋白和mRNA的表达情况,具体操作如1.2.4和1.2.5。
1.3 统计学方法

2 结果
2.1 姜黄素对Tca8113细胞增殖的影响
姜黄素对Tca8113细胞有明显的活性抑制作用,且呈浓度、时间依赖性,与对照组相比差异具有统计学意义(P>0.05)。25和50 μmol/L姜黄素组与顺铂组相比细胞活性增加,差异具有统计学意义(P<0.05),而100 μmol/L姜黄素组与顺铂组相比差异无统计学意义(P>0.05)(表2)。

表2 姜黄素对Tca8113细胞增殖的影响
注:与对照组相比,*P<0.05;与顺铂组相比,#P<0.05
2.2 姜黄素对Tca8113细胞凋亡的影响
姜黄素组细胞凋亡率明显高于对照组,差异具有统计学意义(P<0.05)。与顺铂组相比,25和50 μmol/L姜黄素组细胞凋亡率明显降低,差异具有统计学意义(P<0.05),而100 μmol/L姜黄素组与顺铂组相比差异无统计学意义(P>0.05)(图1、表3)。
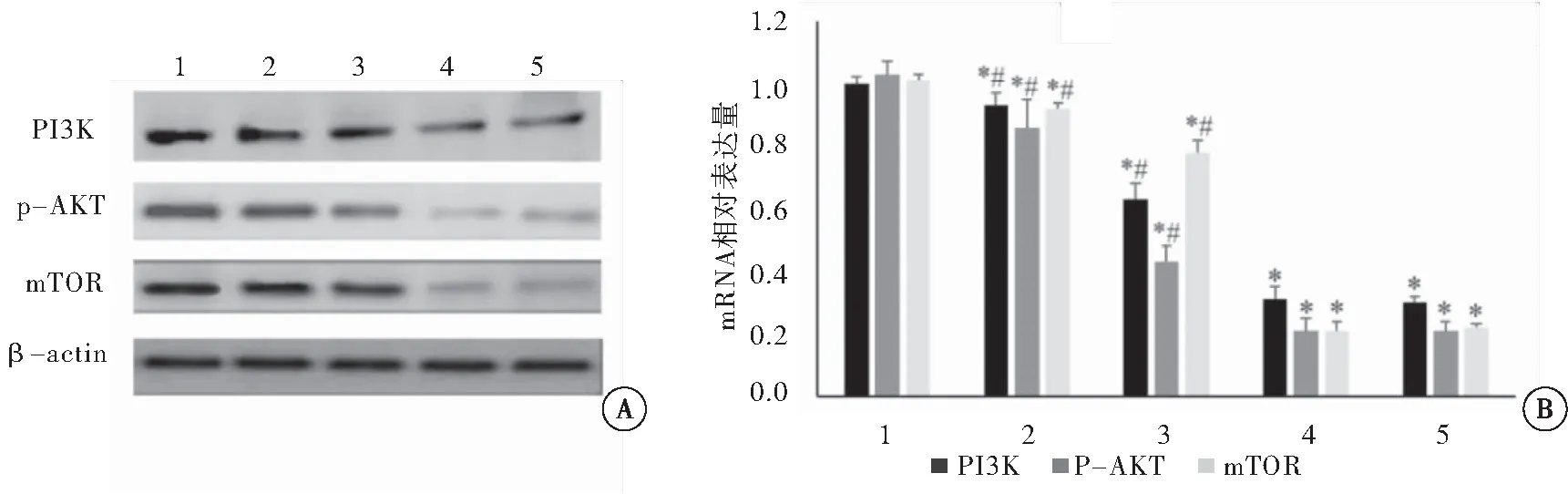
图1 姜黄素对Tca8113细胞PI3K、Akt和p-Akt蛋白和mRNA表达水平的影响
注:A:蛋白表达水平;B:mRNA表达水平。1:对照组;2:25 μmol/L姜黄素组;3:50 μmol/L姜黄素组;4:100 μmol/L姜黄素组;5:顺铂组。与对照组相比,*P<0.05;与顺铂组相比,#P<0.05
表3 不同姜黄素浓度对Tca8133细胞凋亡率的影响
注:与对照组相比,*P<0.05;与顺铂组相比,#P<0.05
2.3 姜黄素对Tca8113细胞PI3K、Akt和p-Akt蛋白和mRNA表达水平的影响。
姜黄素组PI3K、p-Akt和mTOR蛋白和mRNA表达水平明显低于对照组,差异具有统计学意义(P<0.05);同时,25和50 μmol/L姜黄素组PI3K、p-Akt和mTOR蛋白和mRNA表达水平高于顺铂组,差异具有统计学意义(P<0.05),而100 μmol/L姜黄素组与顺铂组相比差异无统计学意义(P>0.05)(图2)。
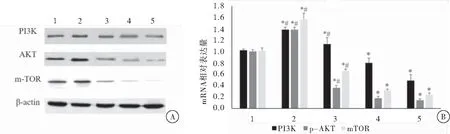
图2姜黄素、LY294002及IGF-1对Tca8113细胞PI3K、Akt和p-Akt蛋白和mRNA表达水平的影响
注:A:蛋白表达水平;B:mRNA表达水平。1:对照组;2:IGF-1组;3:IGF-1+姜黄素组;4:100 μmol/L姜黄素组;5:组LY294002组。与对照组相比,*P<0.05;与IGF-1组相比,#P<0.05
2.4 姜黄素、LY294002及IGF-1对Tca8113细胞增殖的影响
IGF-1组细胞活性明显高于对照组,差异具有统计学意义(P<0.05);且姜黄素组、姜黄素+IGF-1组及LY294002组细胞活性明显低于对照组和IGF-1组,差异具有统计学意义(P<0.05)。姜黄素组与LY-294002组相比差异无统计学意义(P>0.05)(表4)。
表4 姜黄素、LY294002及IGF-1对Tca8113细胞增殖的影响
注:与对照组相比,*P<0.05;与IGF-1组相比,#P<0.05
2.5 姜黄素、LY294002及IGF-1对Tca8113细胞的凋亡影响
IGF-1组细胞凋亡率明显低于对照组,差异具有统计学意义(P<0.05);且姜黄素组、姜黄素+IGF-1组及LY294002组凋亡率明显高于对照组和IGF-1组,差异具有统计学意义(P<0.05)。姜黄素组与LY-294002组相比差异无统计学意义(P>0.05)(表5)。
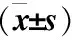
表5 姜黄素、LY294002及IGF-1对Tca8133细胞凋亡率的影响
注:与对照组相比,*P<0.05;与IGF-1组相比,#P<0.05
2.6 姜黄素、LY294002及IGF-1对Tca8113细胞PI3K、Akt和p-Akt蛋白和mRNA表达水平的影响
IGF-1组PI3K、Akt和m-TOR蛋白和mRNA表达水平明显高于对照组,差异具有统计学意义(P<0.05);且姜黄素组、姜黄素+IGF-1组及LY294002组PI3K、Akt和m-TOR蛋白和mRNA表达水平明显低于IGF-1组和对照组,差异具有统计学意义(P<0.05)。姜黄素组与LY294002组相比,差异无统计学意义(P>0.05)(图2)。
3 讨论
OSCC是一种具有不同分化程度、侵袭性强、预后差的肿瘤,烟草和酒精的慢性刺激、慢性炎症、普鲁默-文森综合征、病毒感染及遗传倾向等均是该病的发病因素[11]。近年来,针对OSCC的发生发展分子机制、治疗及预后恢复,进行了大量的研究,研究发现,控制肿瘤恶化的关键分子和开发新型治疗方法比阻断或抑制侵袭和/或转移对于治疗和改善OSCC的预后更重要。
姜黄素主要由类姜黄素(70%)、双去氧基姜黄素(10%~20%)和去甲氧基姜黄素(10%)组成,具有抗炎、抗氧化、降血脂、抗突变、抗肿瘤和抗抑郁等多种药理活性[12-15]。目前,关于姜黄素对细胞因子、激酶、转录因子、生长因子和受体的作用进行了大量的研究,结果显示其具有抗微生物、抗炎、抗氧化、免疫调节、肾脏保护、保肝、抗癌等作用。进一步的体内和体外研究发现,姜黄素主要通过影响肿瘤促进、血管生成和肿瘤生长三个过程抑制癌症的发生[16-17]。姜黄素能够抑制包括人非小细胞肺癌BEAS-2E细胞[18]、喉癌AMC-HN-8细胞[10]、卵巢癌SKOV3细胞[19]、胃癌细胞SGC-701细胞[20]在内的多种癌细胞的体外增殖,但姜黄素对OSCC Tca8113的抑制作用报道较少。本研究结果显示,姜黄素能够有效抑制OSCC细胞的增殖、促进细胞凋亡,并具有浓度与时间依赖性,这与之前姜黄素在其他肿瘤细胞研究中所得的结果一致。
PI3K家族是一类广泛存在于细胞中的特异性催化磷脂酰肌醇物质的激酶,可通过Akt/mTOR细胞内信号通路参与细胞存活、迁移、增殖和分化、血管生成、蛋白质合成和葡萄糖代谢等多种生理过程,此外,该途径被认为与许多致癌过程密切相关[21]。 PI3K / AKT / mTOR是癌症中失调最频繁的信号传导途径之一[22]。AKT是一种丝氨酸/苏氨酸激酶,是PI3K途径的中心介质,AKT的激活进一步磷酸化调节多种细胞反应(包括细胞凋亡、代谢、细胞增殖和细胞生长)的多种蛋白质,激活的AKT通过激活mTOR复合物(mTORC)1促进蛋白质合成和细胞生长。磷酸化的mTORC1激活p70 S6激酶,其增强信使RNA翻译并通过激活核糖体蛋白S6和延伸因子2驱动细胞生长[23]。近年的研究[24-26]发现,PI3K/AKT/mTOR信号通路在胃癌、结直肠癌、乳腺癌、肺癌、胰腺癌、食管鳞状细胞癌等多种肿瘤组织中过表达和活化。大量研究证实,抑制PI3K/AKT/mTOR信号通路的表达可抑制肿瘤细胞的增殖、诱导凋亡。Pontes等[27]研究发现,口腔鳞状细胞癌组织中p-AKT在细胞膜和细胞质均有表达,且随着恶性程度加深表达水平显著升高,提示AKT的活化可能与OSCC的发生、发展有关。本研究结果显示,不同浓度姜黄素作用OSCC Tca8113细胞能够降低PI3K、AKT、mTOR的表达水平,且作用效果呈时间、浓度依赖性,说明姜黄素可能通过抑制PI3K/Akt/mTOR信号通路抑制口腔鳞状细胞癌的增殖并诱导凋亡。
为进一步证实姜黄素通过抑制PI3K/AKT/mTOR信号通路进而抑制OSCC Tca8113细胞增殖和诱导凋亡的作用,本研究进一步探究了姜黄素、PI3K/AKT信号通路抑制剂LY294002和激动剂胰岛素样生长因子-1(insulin like growth factor, IGF-1)单独及联合应用对OSCC细胞抑制增殖、诱导凋亡及PI3K、AKT、mTOR表达的影响。研究结果显示,姜黄素、LY294002及姜黄素与IGF-1联合应用对OSCC Tca8113细胞有显著的抑制作用,IGF-1对OSCC Tca8113细胞有显著的促进增殖作用和抑制凋亡作用,同时姜黄素可减缓IGF-1引起的促进增殖作用和抑制凋亡作用,上述结果说明姜黄素是通过抑制PI3K/AKT/mTOR信号通路进而抑制OSCC Tca8113细胞增殖和诱导凋亡。
综上所述,姜黄素能够诱导OSCC Tca8113细胞的增殖并促进细胞凋亡,其机制可能与抑制PI3K/AKT/mTOR信号通路的表达有关。本研究提示,姜黄素可能对OSCC的发生发展具有抑制作用,这为姜黄素抗肿瘤的临床应用提供理论基础及实验依据。

