基因敲减SOX4对口腔鳞癌细胞体外生长的影响*
刘 奕,周 昊,费 伟Δ
1.四川省医学科学院·四川省人民医院 口腔科(成都 610072) 2.电子科技大学附属医院·四川省人民医院 口腔科(成都 610072)
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是人头颈部最常见的恶性肿瘤之一,占全身肿瘤的3%。每年全球有50万新发病例,而其中只有50%的患者生存率大于5 年,由于其发生机制尚未明确,临床仍很难把握其发生、发展和预后[1-4]。SOX(SRY-related high-mobility-group box)基因是一类重要的转录调控因子,其功能涉及多种早期胚胎发育过程[5-6]。SOX4属于SOX C亚族,表达于细胞核内,SOX4基因的突变、缺失或过表达可导致发育异常或先天性疾病,也与肿瘤的形成和发展密切相关。课题组前期研究采用LC-MS/MS技术分别从口腔扁平苔藓(oral lichen planus, OLP),OLP-OSCC和OSCC的福尔马林固定石蜡包埋(formalin-fixed paraffin-embedded, FFPE)样本中鉴定出了转录调控蛋白SOX4,并对其表达进行了初步的验证,结果发现相比OLP样本,SOX4蛋白在OLP-OSCC和OSCC的FFPE样本中表达升高,在口腔鳞癌细胞UM1中表达也升高,在SOX4基因敲减后,UM1细胞中SOX4表达降低。本研究拟以前期研究为基础,实现SOX4基因敲减,并采用细胞计数法、MTT法、细胞划痕实验和细胞侵袭实验探讨转染后的口腔鳞癌细胞UM1体外生长的变化,从而为进一步研究SOX4的生物学功能提供线索。
1 材料和方法
1.1 实验材料
1.1.1 细胞 舌鳞状细胞癌细胞系(UM1)由中山大学光华口腔医学院陶谦教授惠赠;正常人口腔角质形成细胞 (normal human oral keratinocytes, NHOK)购于上海吉凯基因化学技术有限公司。
1.1.2 主要试剂 人角质形成细胞生长补充剂 和LipofectamineTM3000试剂(Invitrogen公司,美国),双链SOX4 siRNA (sc-38412)和非特异性对照siRNA(Santa Cruz Biotech公司,美国),Vi-cell 细胞计数仪 (Beckman Coulter公司,美国),四甲基偶氮唑蓝(MTT, 5 mg/mL)(Sigma-Aldrich公司,美国),二甲基亚砜(dimethyl sulfoxide, DMSO) (Sigma公司,美国),Synergy HT多功能微孔板酶标仪(BioTek Instruments公司,美国),HEMA 3染色试剂盒(Thermo Fisher Scientifi公司,美国),MedCalc软件 (MedCalc Software公司,比利时)。
1.2 实验方法
1.2.1 实验分组 实验组:转染针对SOX4设计的特异性siRNA的UM1细胞(即 siSOX4细胞,n=5)。对照组:转染非特异性siRNA的siCTRL 细胞(阴性对照,n=5);空白对照组(未处理的UM1,n=5)。
1.2.2 细胞培养 NHOK细胞在EpiLife培养基+人角质形成细胞生长补充剂中培养,UM1在DMEM (dulbecco's modified eagle medium)+10%胎牛血清(fetal bovine serum,FBS)+青霉素(100 U/mL)+链霉素(100 U/mL)中培养。培养条件为37 ℃、5%CO2培养箱,细胞90%~95%汇合后经0.25%胰蛋白酶消化传代。参照LipofectamineTM3000试剂说明书指示:取对数生长期UM1细胞,调整细胞浓度为2×105/mL接种至六孔培养板过夜,培养。取双链SOX4 siRNA (sc-38412)和非特异性对照siRNA分别与稀释后的转染试剂混合,加入培养基孵育,过夜,更换新鲜的生长培养基,继续培养48 h。Western blotting检测结果显示:UM1细胞转染前,SOX4蛋白在UM1细胞中的表达明显高于NHOK细胞,UM1细胞被成功转染siSOX4后,siSOX4在UM1细胞中的表达明显低于对照组siCTRL在UM1中的表达。
1.2.3 细胞计数法检测细胞生长情况 分别从培养皿中收集实验组siSOX4细胞和对照组细胞,0.25%胰蛋白酶处理,制备单细胞混悬液,将细胞以每孔1×105浓度接种于12孔板中孵育,分别在24、48、72 h收集细胞并重悬于500 μL培养液,Vi-cell 细胞计数仪计数。
1.2.4 MTT法检测细胞增殖水平 siSOX4 细胞无血清饥饿培养24 h,以每孔4 000个细胞/100 μL培养液接种于96孔板中,置于37 ℃培养。在每个观察时间点,每孔加入20 μL MTT(5 mg/mL),37 ℃继续孵育4 h,终止培养,弃孔内上清液,每孔加入200 μL DMSO,振荡10 min,使结晶物充分溶解。在Synergy HT多功能微孔板酶标仪上490 nm波长检测各孔吸收值。
1.2.5 细胞划痕实验 该实验用于评估SOX4敲减后UM1细胞的迁移能力。6孔板接种细胞之前先用marker笔在背面画横线标记,每孔划4条线,将浓度为5×105的细胞消化后接种于6孔板,数量以贴壁后铺满板底为宜。细胞铺满板底后,用1 mL枪头垂直于孔板制造细胞划痕,尽量保证各个划痕宽度一致,吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。加入无血清培养基,拍照记录。将培养板放入培养箱培养,8 d后取出拍照,使用NIH Image J 软件分析实验结果。
1.2.6 细胞侵袭实验 该实验用于评估SOX4敲减后UM1细胞的侵袭能力。UM1/siRNA细胞无血清饥饿培养24 h,收集消化细胞,重悬于100 μL含0.1%FBS的DEME培养液中,调整细胞浓度为5×104加入上室,下室加入500 μL含10%FBS的DEME培养基,培养24 h后棉签轻拭小室内的Matrigel和细胞,用HEMA 3染色试剂盒固定染色穿过膜的细胞,显微镜下随机取4个高倍视野并照相,记录穿膜细胞数。
1.3 统计学方法

2 结果
2.1 SOX4基因敲减后对UM1细胞生长和增殖的影响
在不同时间点(24、48、72 h)使用细胞计数法和MTT法分别检测转染siSOX4后UM1细胞的生长和增殖能力,结果显示,与siCTRL对照组相比,SOX4基因敲减后,UM1细胞在48、72 h的生长和增殖能力明显下降,差异具有统计学意义(F=41.770,P<0.01)(图1)。
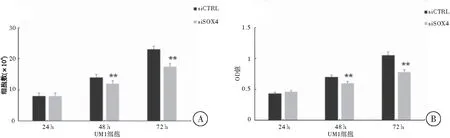
图1 SOX4基因敲减后对UM1细胞生长和增殖的影响注:A :细胞计数法,与对照组相比较,**P<0.01;B:MTT法,与对照组相比较,**P<0.01
2.2 SOX4基因敲减后对UM1细胞迁移能力的影响
细胞培养8 h后,与siCTRL对照组比较,实验组siSOX4细胞处理后,培养板中细胞空白区域更宽,证明SOX4基因敲减后,UM1细胞的迁移能力下降,差异具有统计学意义(P<0.01)(图2)。
2.3 SOX4基因敲减后对UM1细胞侵袭能力的影响
与对照组比较,siSOX4实验组过膜细胞数量减少68%(P<0.01),证明SOX4基因敲减后,UM1细胞的侵袭能力下降,差异具有统计学意义(t=16.253,P<0.01)(图3)。
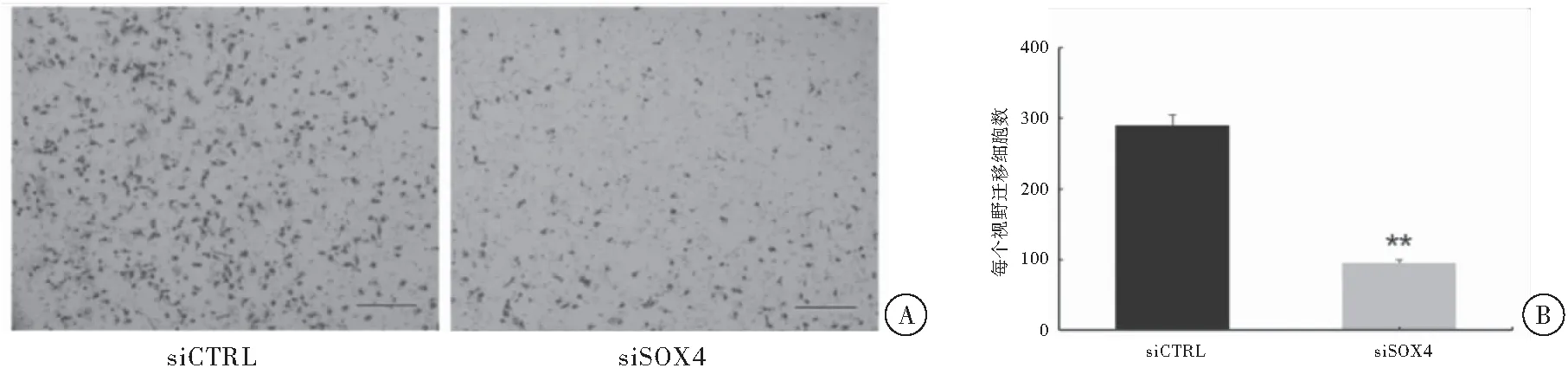
图3 SOX4基因敲减后对UM1细胞侵袭能力的影响 注:A :细胞侵袭实验结果图,Scale bar 100 μm;B: 细胞侵袭实验结果灰度值分析,与对照组比较,**P<0.01
3 讨论
SOX4基因在不同类型肿瘤中的具体作用机制研究未得到统一结论,作为转录因子,SOX4在基因表达复杂的调节网络中,其功能也许不是单一的,肿瘤的类别、分级以及SOX4蛋白与其他调节蛋白的相互作用等因素共同决定着该基因在肿瘤中的确切作用[7]。Yoon 等[8]研究者发现相较,周围正常黏膜组织,SOX4在OSCC组织中的表达明显上调,且促进了肿瘤细胞的存活能力,增强其对放化疗药物的抵抗能力。但是,有研究[9]发现SOX4在某些肿瘤的发生发展过程中起到抑制作用,这可能与SOX4影响p53活化而引起DNA损伤有关。有研究[10]发现,在组织学分级较好,及TMN分期早期的原发性胆囊癌中,SOX4表达升高。
SOX4 mRNA在人类多种肿瘤中是最为常见的一种上调基因,已被确认为是64种肿瘤标志基因中的一种。近年来对SOX4基因的研究逐步从其生理功能转向了在疾病中的作用分析,研究[7]认为SOX4在肿瘤发生发展中的机制有以下几种:1) 对细胞信号通路的调节;SOX4在Wnt、Hedgehog、Notch通路中对细胞的信号传导起到复杂的调节作用。2)对细胞凋亡的调控:在前列腺癌细胞中抑制SOX4基因的表达后导致其下游靶基因p53正向细胞凋亡调控因子水平降低,间接抑制肿瘤细胞凋亡;沉默SOX4基因的表达后可导致肿瘤细胞中NF-κB的激活因子Bcl10水平降低,凋亡抑制因子表达丢失,肿瘤凋亡增加。3)对miRNA的表达调控:在子宫内膜癌患者,SOX4的上游调控基因miRNA-129-2的过度甲基化而使其功能难以发挥,从而使SOX4过表达。4)对细胞增殖转移及分化的调控:SOX4可通过上调各类生长因子受体的表达而刺激细胞的增殖。到目前为止,对SOX4基因在不同类型肿瘤中的具体作用机制研究未得到统一的结论,作为转录因子,在基因表达复杂的调节网络中,其功能也许不是单一的,肿瘤的类别、分级以及SOX4蛋白与其他调节蛋白的相互作用等因素共同决定着该基因在肿瘤中的确切作用。
课题组在SOX4的表达验证前期实验中发现SOX4蛋白在OLP-OSCC和OSCC的FFPE样本中较OLP样本表达升高,在口腔鳞癌细胞UM1中SOX4的表达也升高,在SOX4基因敲减后,UM1细胞中SOX4表达降低。在前期研究基础上,课题组继续深入研究SOX4基因,结果显示在UM1细胞中SOX4基因敲减后,UM1细胞的生长、增殖能力,以及细胞迁移和侵袭能力均下降。课题组的研究结果均提示SOX4蛋白在OLP向口腔鳞癌转变的过程中可能具有促进其发生发展的作用。此外,课题组正在进一步研究SOX4基因敲减后,在OLP癌变过程中,SOX4对部分炎症相关肿瘤启动子信号通路的影响,以期能通过初步了解OLP癌变的机制而进一步探索口腔黏膜慢性炎症转化为口腔鳞癌的内在机制。

