Cu2O/CNTs复合材料的制备及其光催化性能
刘 钦 姚 巡 张博健 刘 飞 刘 洋 李 鹏 薛睿庭 范希梅*,
(1西南交通大学材料科学与工程学院,材料先进技术教育部重点实验室,成都 610031)(2成都京东方光电科技有限公司,成都 611731)
0 引 言
Cu2O是一种环境友好的窄带隙p型半导体,禁带宽度为2.17 eV[1],在可见光范围内可以被激发。由于其来源广、价格低廉、无毒、稳定和无二次污染等优 点[2-3],目前已广泛应用于光催化领域[4]。尽管氧化亚铜光催化性能较为优异,但单相纳米Cu2O的光生电子空穴复合率高,量子效率低[5-6]、回收困难,这极大地限制了其大规模应用。
CNTs具有中空管状结构、高比表面积、一定的导电性、良好的化学稳定性及良好的吸附性等特点,可作为光催化剂载体与纳米金属氧化物进行复合[7-9]。因此,Cu2O与CNTs复合,有望降低Cu2O光生电子空穴的复合率,提高Cu2O的光催化活性;同时,将Cu2O负载于CNTs上能大大提高其比表面积,并且载体能在某种程度防止Cu2O聚集长大,使Cu2O催化活性的保持能力大大提高[10]。
本实验首先对CNTs进行表面酸化处理,然后在高温条件下,用硝酸铜(Cu(NO3)2H2O)和CNTs为前驱体,乙二醇作为溶剂与还原剂,聚乙烯吡咯烷酮(PVP)作为保护剂和表面活性剂,采用溶剂热法制备Cu2O/CNTs复合材料,并通过改变CNTs含量对Cu2O/CNTs作进一步研究。该方法操作简单,形貌易于控制,制备的Cu2O/CNTs催化性能良好,循环利用率高。 采用 XRD、SEM、FTIR、EDS、N2吸附-脱附、DRS对其结构、形貌以及性能等进行表征,并以甲基橙(MO)为目标污染物,通过紫外分光光度计(UVVis)与有机总碳量测定仪研究其在可见光下的光催化性能。
1 实验部分
1.1 CNTs酸化
原始CNTs在800℃管式炉中烧结4 h,然后置于混酸(98%(w/w)H2SO4,68%(w/w)HNO3,VH2SO4/VHNO3=3∶1)中超声20 min后在60℃水浴中搅拌4 h,再冰浴冷却,抽滤洗涤至中性,最后60℃干燥24 h得到酸化CNTs。
1.2 Cu2O/CNTs复合材料的制备
Cu2O/CNTs制备过程如下:酸化CNTs与10 mL水混合于40℃搅拌2 h后超声30 min,记作溶液A;10 mL 1.863 mol·L-1Cu(NO3)2·3H2O 溶液加入 A中搅拌 30 min得到溶液 B;90 mL 5.556 mg·mL-1PVP乙二醇(EG)溶液记为C;B与C混合后升温至180℃反应30 min,最后冷却至室温。离心后60℃干燥12 h得到Cu2O/CNTs样品。各样品的制备工艺参数如表1所示。
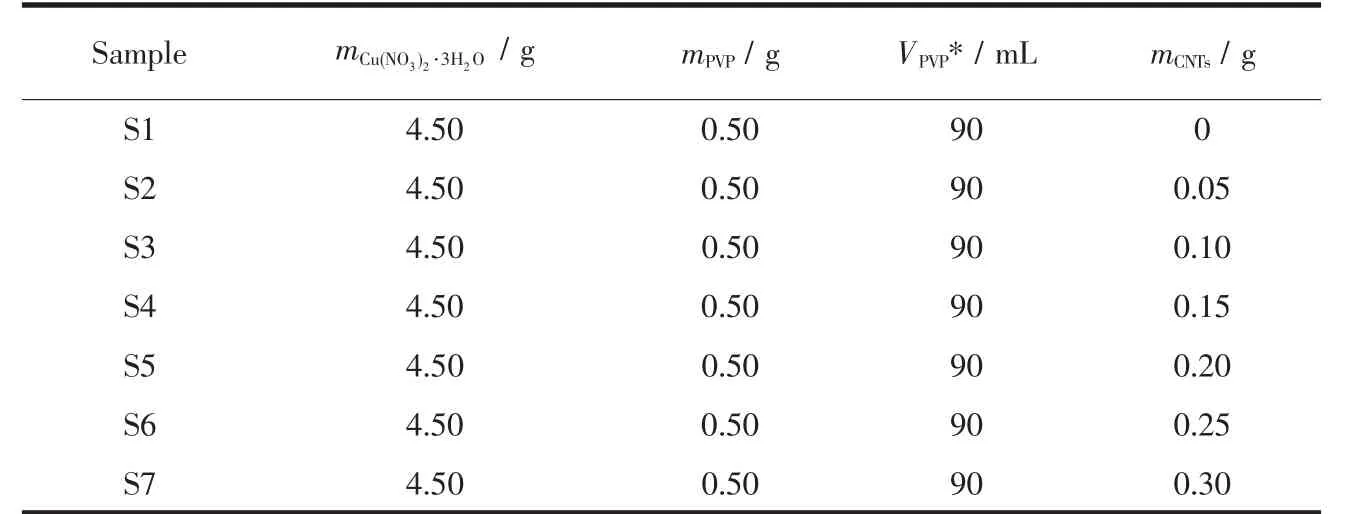
表1 Cu2O/CNTs复合材料制备工艺参数Table 1 Parameters of the preparation of Cu2O/CNTs composite materials
1.3 Cu2O/CNTs表征
样品在德国DX-2500型XRD衍射仪上测试XRD,掠入角为 0.5°,步宽为 0.03°,Cu Kα 辐射,波长λ=0.154 06 nm,工作电压40 kV,电流40 mA,扫描范围为10°~90°;采用美国FEI公司Quanta 200型环境扫描电子显微镜(SEM)观察样品的形貌,检测前喷金,工作电压20 kV;采用日本岛津公司Shimadzu2550型紫外可见漫反射仪(UV-Vis DRS)检测样品的紫外可见漫反射光谱,扫描步长为0.5 nm,入射光波长范围为190~900 nm;采用日本岛津公司Shimadzu2550型紫外分光光度计(UV-Vis)来检测阵列的透射率,扫描步长为0.5 nm,波长范围为300~800 nm;采用德国Element公司有机总碳测定仪(vario TOC)检测样品的TOC,检测范围 1~3 000 mg·L-1;采用美国麦克ASAP2020型比表面积与孔径分析仪测定样品的N2吸附-脱附性能,工作温度为77 K,测试前将待测样品于120℃下脱气3 h;采用美国Thermo Fisher Scientific公司Nicolet 6700型红外光谱仪测试样品的官能团,KBr压片制样,扫描范围为400~4 000 cm-1;采用英国 Malvern公司 ζ电位分析仪进行样品的ζ电位分析。
1.4 光催化性能测试
将 50 mg催化剂加入到 10 mg·L-1的 50 mL MO溶液中,在无光下搅拌5 min,实现光催化剂表面MO分子的吸附脱附平衡。以40 W的钨灯为可见光源,固定液面与光源之间14 cm的距离,保持磁力搅拌。每隔10 min取部分液体于离心管中,在8 000 r·min-1的离心机中离心5 min后取上清液,通过UV-Vis分光光度计测试上清液的吸收光谱,根据MO溶液在466 nm特征吸收峰的吸光度,通过朗伯比尔定律(式(1))计算MO的降解率。
D=[(A0-At)/A0]×100% (1)其中A0和At分别为暗反应后MO溶液特征吸收峰处的初始强度值和反应t时刻后的强度值[11]。
1.5 有机总碳量测试
光催化实验中所取的上层清液,通过总有机碳测定仪测定反应过程中总有机碳值(TOC),通过公式(2)计算MO中TOC去除率及无机化程度[12]:
TOC removed rate=[(TOC0-TOCt)/TOC0]×100%(2)式(2)中TOC0和TOCt分别为暗反应后MO溶液的初始TOC值和反应t时刻后的TOC值。
2 结果与讨论
2.1 FTIR分析
为研究酸化对CNTs官能团的影响,对酸化前后CNTs进行FTIR表征(图1)。酸化前后CNTs在1 632 cm-1处均有特征吸收峰,此峰代表碳环平面的C=C伸缩振动峰。酸化前后CNTs在3 430 cm-1均出现O-H伸缩振动峰,其源于CNTs中无定型碳上吸收的水分子[13],而酸化CNTs由于引入大量的羟基(-OH)官能团,使得O-H伸缩振动峰强度较酸化前有明显增强。酸化CNTs在1 737cm-1出现明显吸收峰,对应C=O伸缩振动峰,这是酸化处理过程产生氧自由基与碳原子结合形成C=O基团的缘故,如果C=O基团与O-H官能团结合在同一碳原子上就会形成羧基(-COOH)官能团[14]。1 168 cm-1对应C-O伸缩振动峰随着酸化处理也明显增强。说明酸化处理在碳纳米管表面成功地引入了羧基和羟基等具有化学反应活性的基团[15-16],引入的羟基和羧基均是亲水基,这些基团的存在都将改善CNTs的亲水性和其在水溶液中的分散性。
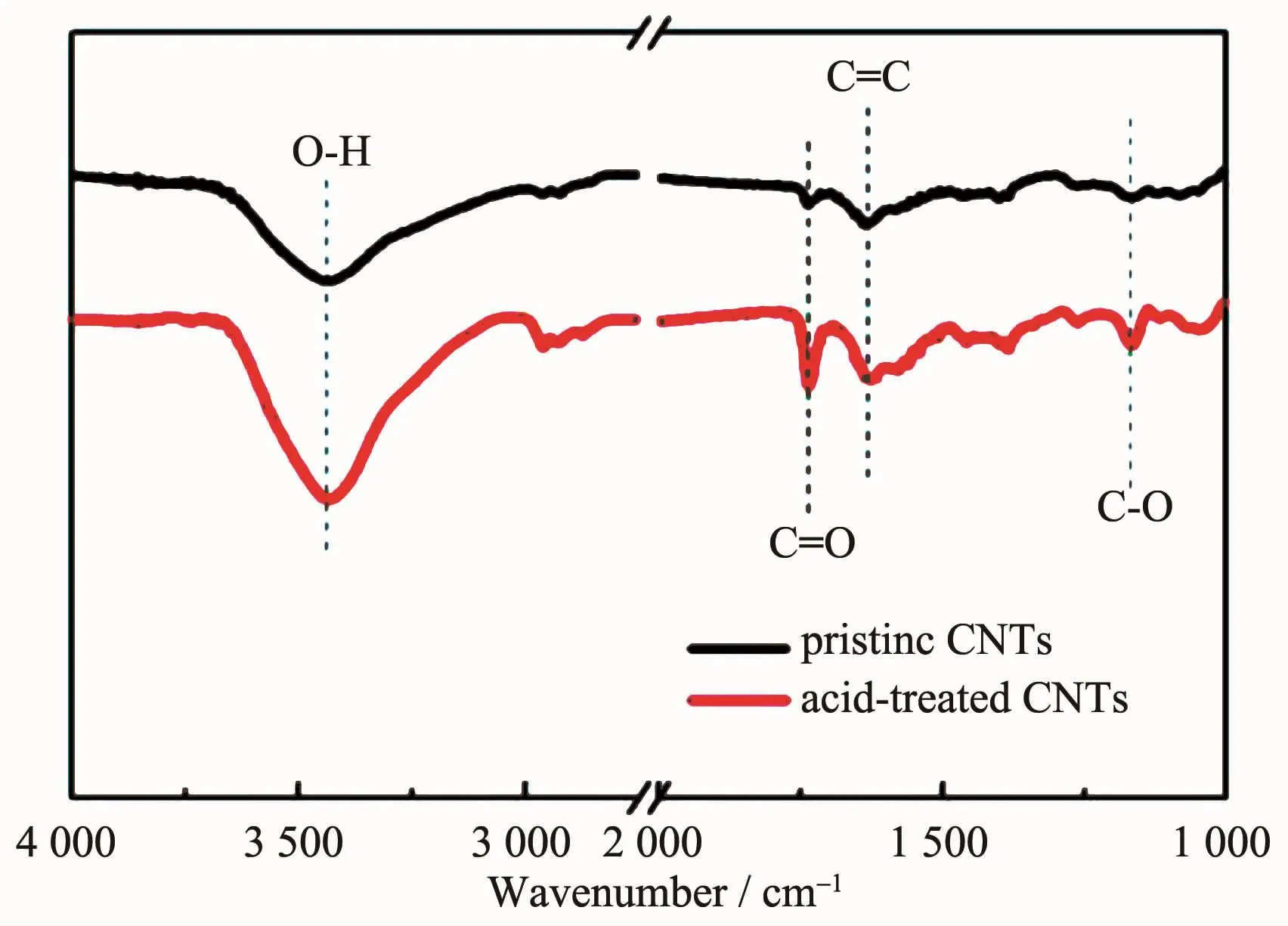
图1 原始CNTs和酸化CNTs的红外光谱图Fig.1 FTIR spectra of pristine CNTs and acid-treated CNTs
2.2 Cu2O/CNTs XRD分析
图2 为不同 CNTs含量的Cu2O/CNTs的 XRD图。其中,26.287°是石墨特征峰,对应CNTs的(002)晶面。29.647°、36.521°、42.423°、61.552°和 73.739°分别对应 Cu2O 的(110)、(111)、(200)、(220)和(311)五个晶面,所有衍射峰与PDF标准卡片(PDF No.00-005-0667)一致,且没有杂峰出现,说明样品中只含有CNTs与Cu2O。随着CNTs含量逐渐增加,CNTs的(002)晶面衍射峰强度逐渐增强,而Cu2O的晶面衍射峰强度逐渐降低。
2.3 SEM分析
图3 (a,b)分别为原始 CNTs与酸化 CNTs的微观形貌。从图3(a)可知,原始CNTs呈弯曲束线状,具有较大的长径比,呈松散缠绕团聚状。酸化去除杂质后,使CNTs的表面更加干净(图3(b)),混酸的强氧化性使CNTs断裂,管长变短。稳定性较差的五元环及七元环、碳纳米管表面的缺陷处以及两端口被侵蚀[17],从而在碳纳米管表面形成羟基、羧基等基团,亲水基团数目增多[16],使CNTs在水溶液中的分散更加均匀。
图3(c)为纯Cu2O的微观形貌。Cu2O为球形颗粒,直径约为1~2 μm,表面由尺寸为几十纳米的纳米粒子构成。图 3(d~i)为 Cu2O/CNTs(S2~S7)的微观形貌。Cu2O/CNTs由球形Cu2O颗粒与线状CNTs形成复合球,线状CNTs的长径比较大并附着在球形Cu2O表面或镶嵌在球形Cu2O内部。随着CNTs含量的增加,球形Cu2O颗粒表面附着或镶嵌的CNTs数量越多,甚至球形Cu2O颗粒表面被CNTs所包覆。
图3(j)为S5红色标记处的EDS测试结果。从图中可知,样品中只有Au、Cu、O、C四种元素,其中Au元素是喷涂到样品表面起导电作用的金粉,Cu、O、C来源于制备的样品中,即样品仅含有这3种元素,这与XRD测试结果一致。从内插表格可知,Cu与O的原子个数比接近2∶1,与Cu2O原子个数比基本相符合。
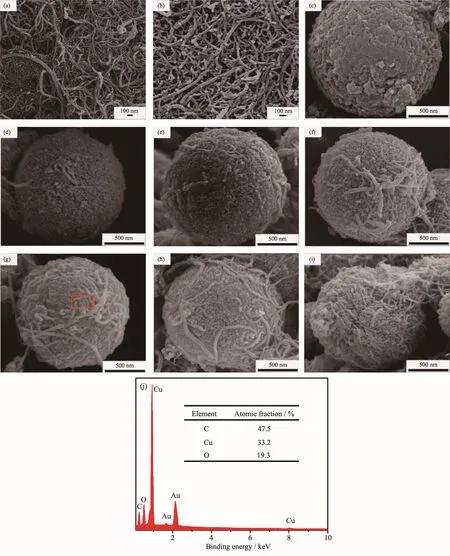
图3 酸化前后CNTs(a,b)和样品S1~S7(c~i)的SEM图;样品S5的EDS图谱 (j)Fig.3 SEM images of the sample(a)pristine CNTs,(b)acid-treated CNTs and(c~i)Cu2O/CNTs composites synthesized at different content of CNTs;(j)EDS diagram of sample S5
2.4 生长机理
根据Cu2O/CNTs的形貌分析我们提出了Cu2O/CNTs的生长机理,如图4所示。酸化CNTs表面含有羧基与羟基等官能团,使CNTs在水溶液中的分散性提高。CNTs表面酸根离子的离解增加了CNTs的负电荷[15],同时PVP降低了CNTs表面能量壁障[7],而 Cu(NO3)2离解后 Cu2+带正电荷,因此 Cu2+与CNTs之间存在静电力作用,使得Cu2+被吸附到酸化CNTs表面。通过ζ位测试可知:酸化CNTs的ζ电位为-25.58 mV,Cu(NO3)2·3H2O溶液的 ζ电位为 5.62 mV。酸化CNTs与Cu(NO3)2·3H2O存在明显电位差,这种电位差有助于诱导Cu2+附着于酸化CNTs的带电表面[18]。
酸化CNTs表面的Cu2+被乙二醇还原为Cu2O,PVP使Cu2O所有晶面等轴生长,形成微小球形颗粒;由于溶液中Cu2+含量较多,剩余的Cu2+被乙二醇进一步还原使Cu2O晶核继续长大[19-20],最后在CNTs外表面由球形小颗粒聚集形成Cu2O球体,从而得到CNTs埋嵌于Cu2O球内或镶嵌在其表面的Cu2O/CNTs复合材料。
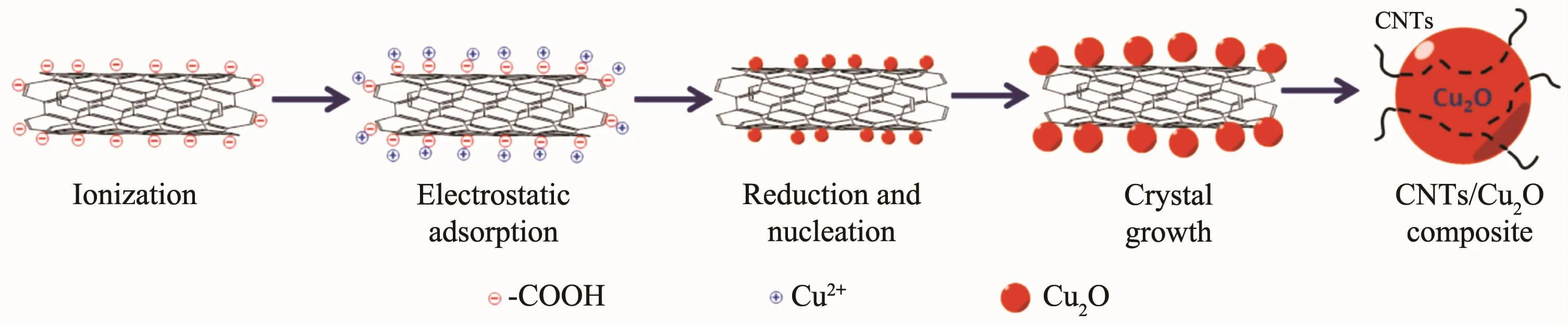
图4 Cu2O/CNTs复合材料生长机理示意图Fig.4 Growth mechanism of Cu2O/CNTscomposite
2.5 比表面积与孔径分析
光催化剂的比表面积影响其催化活性,比表面积越大,活性位点越多,催化性能越好。图5(a,b)分别为纯 Cu2O(S1)和 Cu2O/CNTs(S5)的 N2吸附-脱附等温线和孔径分布图。S1、S5的等温线呈Ⅳ型,滞后环为H3型,说明样品含有介孔结构。从孔径分布(图5内插图)可知S1和S5的孔径主要分布在3~20 nm,但S1的孔径分布比S5更加均一。通过孔径测试可知,Cu2O/CNTs的平均孔径为6.63 nm,Cu2O的平均孔径为5.78 nm,说明添加CNTs能扩大Cu2O/CNTs的孔径。通过N2吸附-脱附测试可知,Cu2O/CNTs的比表面积为48 m2·g-1,大于纯Cu2O的31 m2·g-1,说明利用 CNTs的高比表面积可以提高Cu2O/CNTs复合材料的比表面积。

图5 (a)Cu2O和(b)Cu2O/CNTs的N2吸附-脱附等温线和孔径分布曲线Fig.5 N2adsorption-desorption isotherms and corresponding pore-size distribution curve(inset)of(a)Cu2O and(b)Cu2O/CNTs
2.6 紫外可见漫反射分析
为研究CNTs对Cu2O可见光吸收性能的影响,对S1和S5进行紫外可见漫反射吸收光谱测试(图6)。图6(a)的漫反射光谱经过Kubelka-Munk算法转换变为吸收光谱图6(b)。从图6(b)可知,Cu2O/CNTs与Cu2O在可见光范围内均有明显的吸收,但掺杂CNTs后的Cu2O/CNTs的光吸收强度明显强于Cu2O,这是因为CNTs的强吸光性以及全谱吸收特性提高了Cu2O/CNTs在可见光区域的吸收,同时CNTs与Cu2O的电子相互作用[21]使Cu2O/CNTs发生红移现象,向可见光方向移动,进一步增强Cu2O/CNTs的光吸收强度,因此Cu2O/CNTs在可见光范围内的吸收有很大提高[22]。根据Tauc plot公式(3)计算样品的禁带宽度:
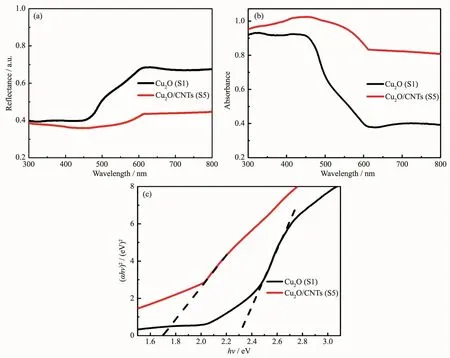
图6 样品S1,S5的(a)漫反射谱,(b)吸收谱和(c)禁带宽度Fig.6 Diffuse reflectancespectra(a),absorption spectra(b)and energy gap(c)of S1 and S5

其中,α为吸收系数,h为普朗克常数,A为常数,ν为光的的频率,Eg为禁带宽度[23]。样品的禁带宽度可通过延长 hν~(αhν)2曲线中线性部分与 hν轴的交点得出(图 6(c)),可知 S1、S5的禁带宽度分别为 2.3、1.7 eV[7]。Cu2O/CNTs的吸光性越强,禁带宽度越小,电子空穴对跃迁所需要的能量也越低,电子空穴对亦更容易被激发,使得Cu2O/CNTs具有更好的光学吸收能力[12]。因此,引入CNTs能促进Cu2O/CNTs的可见光响应,提高Cu2O/CNTs的光催化性能。
2.7 Cu2O/CNTs光催化性能分析

图7 (a)样品S1~S7在可见光辐照下对MO溶液的降解效率图;(b)样品S5在可见光下对MO溶液的TOC去除效率图Fig.7 (a)Photocatalytic degradation rate of the sample S1~S7 for MO;(b)TOC removal rate of S5 for MO
图7 (a)为不同CNTs含量的Cu2O/CNTs在可见光照射60 min对MO的光催化降解效率图。从图中可知,样品(S1~S7)对MO溶液的降解效率均随光照时间的延长而增加。在可见光照射60 min后,Cu2O/CNTs复合材料(S2~S7)对MO的降解效率分别可达84.1%、87.5%、90.2%、92.1%、89.4%、88.1%,与纯Cu2O的77.8%相比,降解性能均有明显提高。为确定Cu2O/CNTs光催化反应过程是一般脱色反应还是深度无机化,对样品S5进行TOC测试,测试结果如图7(b)所示,在可见光照射60 min后,TOC的去除率为73.2%。TOC虽然也有较好的去除效果,但远远小于甲基橙的脱色率92.1%,这是因为甲基橙脱色效率相对无机化效率较快[12]。
CNTs含量对Cu2O/CNTs降解MO效率的实验结果如图8所示。随着CNTs含量的增加,Cu2O/CNTs的降解效率先提高再降低。当CNTs含量为0.2 g(S5)时,降解效率最佳,在60 min的光照时间下达到92.1%。当进一步增加CNTs含量,Cu2O/CNTs的降解效率逐渐降低。通过N2吸附-脱附测试与UV-DRS分析可知,CNTs的添加可以增加光催化剂的比表面积和吸光强度,因此含有CNTs的复合光催化剂降解性能明显优于纯Cu2O。此外,由于光催化剂添加量为固定值,随着CNTs含量增加,Cu2O占光催化剂的相对比例逐渐降低,因而CNTs含量影响着复合光催化剂的降解性能。
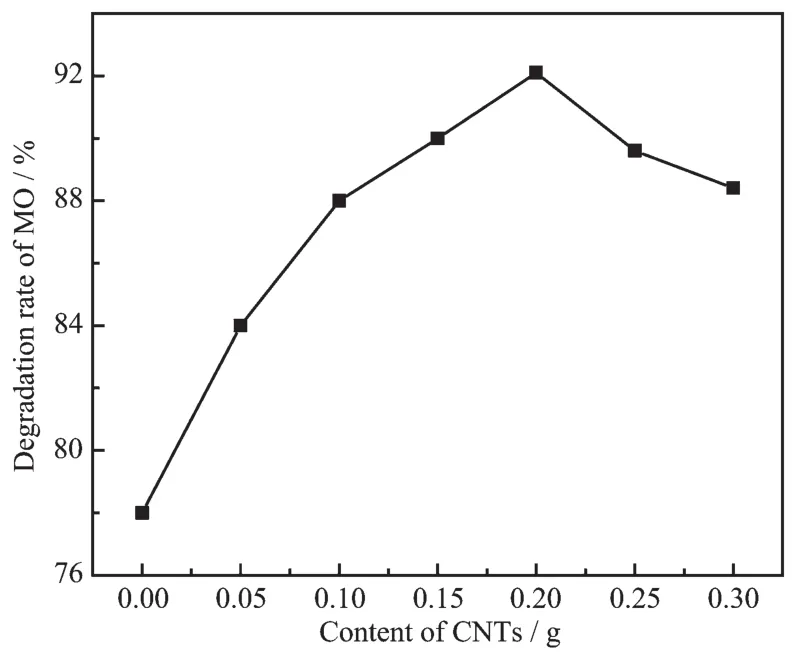
图8 CNTs含量与MO降解效率关系图Fig.8 Relationship between CNTs content and efficiency photodegradation rate of MO
为检测Cu2O/CNTs在催化过程中的循环利用率,对样品S5降解MO进行了5个周期的循环实验,实验结果如图9所示。从图中可以看出,第5次的降解效率在60 min后依然达到84.6%,相比于第一次的92.1%仅下降7.5%。因此说明Cu2O/CNTs在光催化过程中具有较好的可重复利用率,是良好的光催化材料。

图9 S5降解MO的循环测试Fig.9 Recycle test of photocatalytic degradation rate of S5 for MO
2.8 光催化机理
如图10所示,在可见光照射下,Cu2O价带中的电子被激发到导带,形成电子(e-)和空穴(h+)对,e-与溶液中O2结合产生超氧自由基(·O2-),h+将H2O氧化成羟基自由基(·OH)。由于CNTs具有较强的吸附性,MO被吸附到复合材料上,具有强氧化性的·O2-和·OH把MO氧化成CO2和H2O,从而达到降解效果。

图10 光催化机理Fig.10 Photocatalytic mechanism
3 结 论
采用溶剂热法,通过控制酸化CNTs负载量制备Cu2O/CNTs复合材料,并研究复合材料的结构、形貌、比表面积、吸光特性及光催化性能。结果表明掺杂CNTs能增强Cu2O/CNTs的比表面积和吸光能力,提高其的光催化性能。在CNTs负载量为0.2 g时,Cu2O/CNTs的光催化性能最佳,在可见光照射60 min下,MO的降解效率达到92.1%;在重复利用5次后,降解效率仍达到84.6%。
通过控制PVP的浓度还可合成不同形貌的Cu2O[5,24-28],所以可以进一步研究PVP浓度对Cu2O/CNTs形貌及性能的影响。此外,鉴于Cu2O/CNTs对有机污染物优异的降解性能,可以考虑其对其他污染物的降解。

