胎牛血清不同组分对昆虫杆状病毒复制的影响
李长路
(广州蕊特生物科技有限公司,广州510000)
目前,在动物疫苗生产中,为了降低生产成本,减少生物制品纯化损失,减少由于不确定蛋白或血清组分带来干扰或差异的风险,提高生物制品的安全性,大多数采用无血清培养基[1-2]。但在使用过程中,有些病毒,如口蹄疫病毒有时会出现细胞生长良好,但病毒产量不高的问题。为了克服这一问题,许多厂家在病毒生产过程中,还是要加入1%~3%的低浓度血清。为了研究胎牛血清中的哪些组分对病毒复制起促进作用,我们采用亲和凝胶层析方法分离出四个血清组分,分别配制成培养基,培养SF9细胞,接种昆虫杆状病毒,进行空斑测定病毒滴度、流式检测等实验[3]。如果能把血清中不同组分对病毒复制的影响分析清楚,即哪些组分对病毒复制起促进作用,哪些组分起抑制作用,从而在疫苗生产中,加入对病毒复制起促进作用的血清组分,去除那些对病毒复制有抑制作用的组分,可以有效提高疫苗产量。目前,提高病毒复制的方法主要集中在细胞驯化和病毒自身改造,血清中不同组分对病毒复制的影响,还未有报道。本实验从胎牛血清中分离出五个混合组分,培养昆虫杆状病毒,观察不同组分对病毒复制效率的影响。
1 材料与方法
1.1 材料 胎牛血清FBS:广州蕊特生物科技有限公司,批号 20180318;胎牛血清样本 S1、S2、S3、S4:用welchrom 4B填料,分别从上述同一批号胎牛血清FBS中分离获得的混合组分,广州蕊特生物科技有限公司提供;培养基:Grace's培养液,批号20150709;细胞:ATCCSF-9,批号 20180810,代次41;病毒:BAC-GFP V6,滴度 1.08×107PFU/mL,由广东华南疫苗股份有限公司提供;流式细胞仪:C6、BD Bioscience。
1.2 方法 在6孔板上接种SF9细胞,培养24 h,接种 0.01MOI的 BAC-GFP 病毒;按照 0、0.3%、0.6%、1.3%、2.5%、5%的 FBS 组分的浓度梯度加入6孔板中进行病毒培养,原胎牛血清FBS做对照;分别在 24 h、48 h、72 h、96 h 进行荧光拍照(40×),观察病毒复制情况;96 h收集病毒上清,进行空斑形成实验测定病毒滴度(稀释度=10-4),收集的病毒感染SF9细胞,72 h流式细胞术检测病毒的复制情况。
2 实验结果
2.1 空斑实验观察病毒复制结果 通过空斑测定实验发现,与FBS对比,S1样本浓度在1.3%以上时,空斑数显著增加。S2样本的空斑数没有增加,反而降低。S3样本浓度在2.5%以上时,空斑数显著增加,没有S1显著。S4样本的空斑数变化无显著差异。结果见表1、图1-图5。
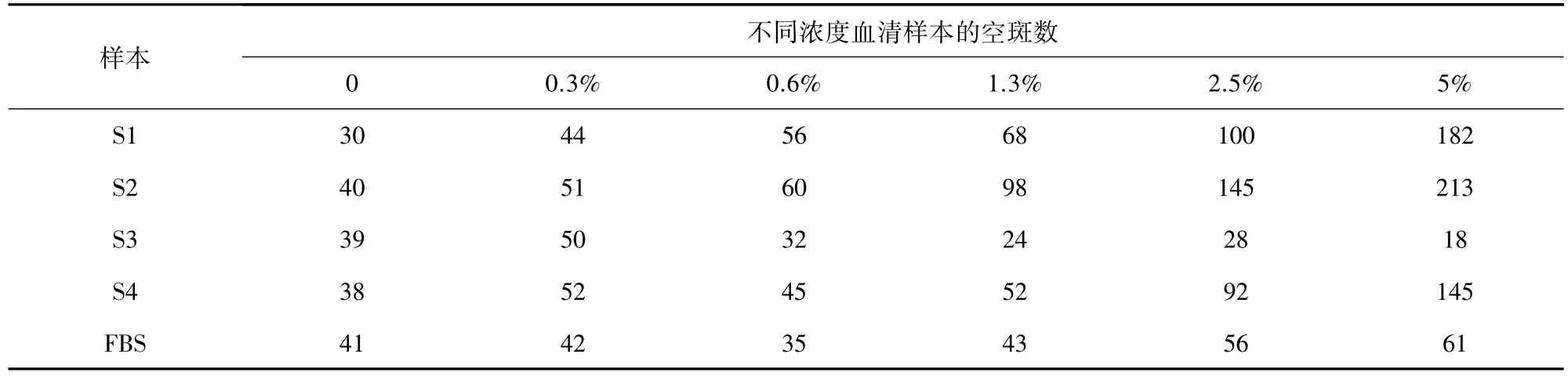
表1 不同浓度血清样本的空斑数Tab 1 Plaque assay of different concentration
2.2 荧光强度观察病毒复制结果 通过肉眼观察荧光强度发现,与FBS对比,S1样本随着浓度升高,荧光强度显著增强。S2样本的荧光强度没有增加。S3样本浓度在2.5%以上时,荧光强度显著增强。S4样本的荧光强度没有明显变化。结果见图 6-图 10。

图1 空斑数比较图(0.3%)Fig 1 BAC Plaque(0.3%)

图2 空斑数比较图(0.6%)Fig 2 BAC Plaque(0.6%)
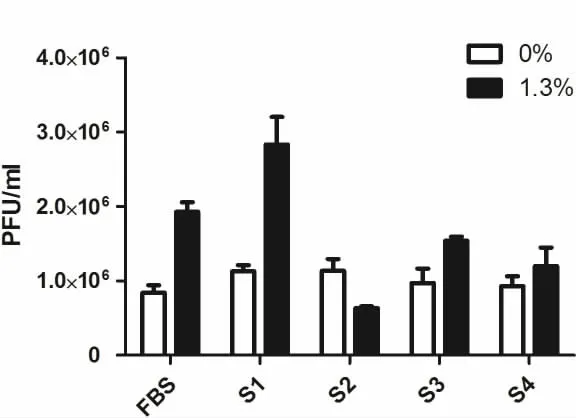
图3 空斑数比较图(1.3%)Fig 3 BAC Plaque(1.3%)

图4 空斑数比较图(2.5%)Fig 4 BAC Plaque(2.5%)

图5 空斑数比较图(5%)Fig 5 BAC Plaque(5%)
2.3 流式细胞术检测结果病毒复制结果 通过流式细胞术检测发现,与FBS对比,S1样本浓度在1.3%以上时,病毒数量显著增多。S2样本的病毒数量没有显著增加。S3样本浓度在2.5%以上时,荧光强度显著增多。上述实验证实S4对病毒复制没有明显促进作用,故没有进行流式检测。结果见图 11-图 13。
3 讨论
昆虫杆状病毒是一种共价闭合环状双链DNA病毒,其特有的Bac-to-Bac表达系统具有翻译后加工修饰功能和高效表达外源蛋白的功能。本文选择病毒培养96 h,滴度达到最大值,可以收集病毒上清,感染细胞后,72 h病毒滴度达到最大值,进行流式细胞术检测。
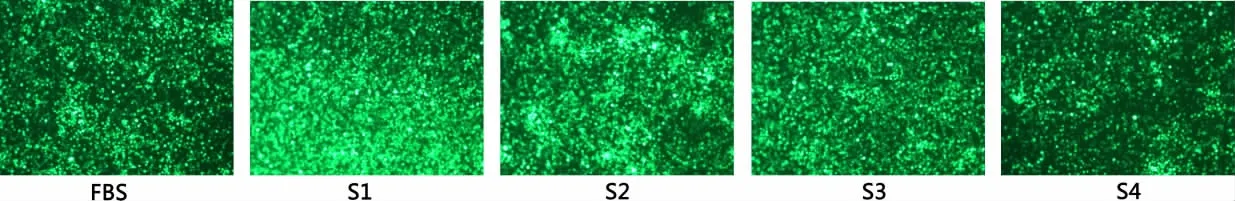
图6 添加血清或组分浓度为0.3%,培养病毒96 h的荧光强度Fig 6 The fluorescence intensity of Five samples with serum or components at 0.3%,at 96 h

图7 添加血清或组分浓度为0.6%,培养病毒96 h的荧光强度Fig 7 The fluorescence intensity of Five samples with serum or components at 0.6%,at 96 h

图8 添加血清或组分浓度为1.3%,培养病毒96 h的荧光强度Fig 8 The fluorescence intensity of Five samples with serum or components at 1.3%,at 96 h

图9 添加血清或组分浓度为2.5%,培养病毒96 h的荧光强度Fig 9 The fluorescence intensity of Five samples with serum or components at 2.5%,at 96 h

图10 添加血清或组分浓度为5%,培养病毒96h的荧光强度Fig 10 The fluorescence intensity of Five samples with serum or components at 5%,at 96 h

图11 S1的流式检测Fig 11 The FC of S1

图12 S2的流式检测Fig 12 The FC of S2

图13 S3的流式检测Fig 13 The FC of S3
综合蚀斑实验、荧光拍照以及流式检测结果,血清样本 S1、S2、S3、S4中,S1与 S3对BAC增殖的促进作用最为明显,而S2对BAC增殖存在抑制,S4存在微弱的促进效果。结果表明,血清中的有些组分对病毒复制起促进作用,有些组分反而抑制病毒复制。在病毒培养过程中,添加S1组分,同时去除血清中的S2组分,可以有效提高病毒复制效率,提高病毒产量,这对疫苗生产有帮助。
在生物制品中,使用无血清培养基,可提高生物制品的质量、纯度,方便产物的分离纯化,减少由血清带来的污染机会,减少过敏原,同时也减少了成本,也便于在生物反应器中进行代谢流分析,实现在线监控,精准投料。对于生产抗体用的CHO细胞、vero 细胞和杂交瘤细胞,确实有优势[4-5]。但是对于多数病毒性疫苗来说,会出现病毒产量低的情况。
对于如何在减少或不用血清的情况下,细胞生长良好,病毒产量高,是目前研究的热点,主要集中在对细胞进行驯化和对病毒自身进行改造两方面。通过对贴壁细胞进行低血清或无血清驯化,获得可以稳定传代的悬浮细胞,用于细胞反应罐生产。田波等[6]对BHK21细胞悬浮驯化,筛选出驯化的参数条件。张良艳等[7]对MDCK细胞进行驯化,用于流感病毒发酵罐培养。通过对病毒的启动子进行改造,提高病毒复制能力。刘言等[8]用HBV病毒启动子内的基因片段替换土拨鼠肝炎病毒的同源序列,来提高病毒复制能力。袁天罡[9]把口蹄疫病毒的2C蛋白的T135I突变,从而提高O/YS/CHA/05的复制。魏南南、徐守兴等[10]利用分子生物学技术研究了内源性TPL2基因对口蹄疫病毒复制的影响,发现FMDV感染BHK-21细胞后,TPL2转录水平显著上调;过表达TPL2能够促进FMDV在BHK-21细胞中复制,而下调表达内源性TPL2后FMDV的复制受到抑制,表明TPL2促进FMDV在BHK-21细胞中进行复制。谢佳汛[11]使用p53特异性抑制剂PFTɑ提前处理PK-15细胞,抑制p53的表达,然后用PRV分别感染p53抑制表达细胞与对照细胞,收集不同时间点细胞培养物,检测PRVgB基因和PRV滴度,结果表明p53抑制表达细胞内的PRVgB基因及病毒TCID50均显著低于对照组,说明抑制p53的表达对PRV在细胞内的复制具有抑制作用。王涛[12]通过实验证实,COPⅡ蛋白复合体促进CSFV复制的过程,COPⅡ介导的蛋白运输途径促进CSFV的组装或释放,为进一步探索COPⅡ在CSFV复制中的作用奠定了基础,为全面了解CSFV复制机制和生命周期提供了新的科学依据。本文研究从胎牛血清中分离不同组分对病毒复制的影响,初步证实分离出的组分S1对昆虫杆状病毒复制有明显的促进作用。至于该组分是否对其它病毒复制有同等的促进作用,后续会进一步去验证。

