无创呼吸机治疗阻塞性睡眠呼吸暂停低通气综合征中缺氧诱导因子-1α的改变
周雨田,李小惠,陈 果,刘杨渝,郭姝瑾
(四川省医学科学院·四川省人民医院老年呼吸科,四川 成都 610072)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是我国的一个常见病、多发病,其发病率高、危险性大、易被人群忽略,其本质是一种睡眠呼吸紊乱相关的全身性疾病[1],在我国较为常见,发病率呈逐年上升的趋势,睡眠时由于上气道的堵塞导致的反复通气气流减少甚至停止,从而引起机体的间歇性低氧、反复觉醒、睡眠片段化等,严重的OSAHS可引起心脑血管疾病、认知功能障碍等疾病,既往的研究提示我国的老年人的发病率为20%~40%[2]。患者常常由于长期的缺氧及CO2的潴留导致一系列的并发症甚至是慢性肺源性心脏病。目前OSAHS的治疗主要是通过减肥、呼吸机辅助通气甚至是手术来进行治疗[3]。缺氧诱导因子-1 (hypoxia inducible factors-1,HIF-1) 是由于组织缺氧从而诱导细胞产生的一种调节氧平衡以及缺氧反应基因表达的核转录因子,它的表达水平由细胞感知的氧浓度来调节。HIF-1由两部分组成,一部分是进行低氧调控的α亚基(HIF-1α),另一部分是固定结构的β亚基(HIF-1β)[4]。本研究希望通过对OSAHS患者的HIF-1α水平研究,以及通过无创呼吸机辅助通气治疗后的HIF-1α水平研究来揭示其与OSAHS的关系及其与缺氧的机制,现报道如下。
1 资料与方法
1.1一般资料选择2016年4月至2017年12月在四川省人民医院老年呼吸科门诊及老年呼吸科病房就诊且诊断为OSAHS的患者60例为OSAHS组,均经多导睡眠监测仪(PSG)诊断,且符合2012年中华医学会《阻塞性睡眠呼吸暂停低通气综合征诊治指南》诊断标准[5],排除标准:①合并其他严重呼吸系统疾病如慢性阻塞性肺部(chronic obstructive pulmonary disease,COPD)、支气管扩张、肺结核等等;②严重炎症、自身免疫性疾病;③高血压、糖尿病、甲亢等疾病未得到控制者;④严重心、肝、肺、肾疾病;同期在我院进行健康体检的60岁以上健康老年人40例为对照组,均行PSG检查排除睡眠疾患。OSAHS组体重指数高于对照组,两组其他一般情况比较,差异无统计学意义(P> 0.05)。
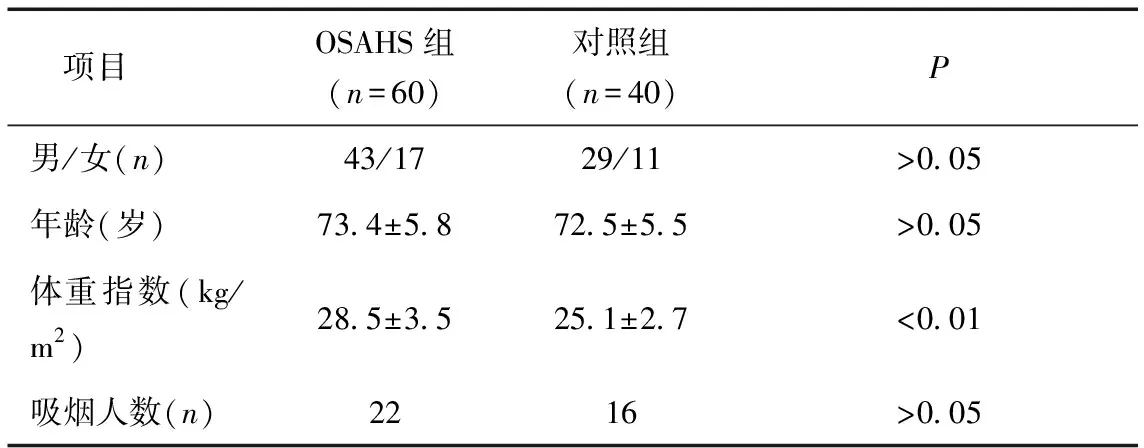
表1 两组患者基本情况
1.2方法使用美国泰科Sandman Elite 9.0多导睡眠监测仪进行睡眠分析,OSAHS患者给予飞利浦V60无创呼吸机持续气道正压通气模式(CPAP)进行辅助通气治疗。OSAHS患者分别于开始呼吸机治疗前及治疗14天后上午8时空腹抽取静脉血5 ml,使用ELISA法检测HIF-1α、丙二醛(MDA)、超氧化物歧化酶(SOD)的水平,分别于开始呼吸机治疗前及治疗第14天夜晚睡眠时采集多导睡眠图、监测睡眠时平均脉搏血氧饱和度(MSpO2)、呼吸暂停低通气指数(apneahypopnea index,AHI),分别于开始呼吸机治疗前及治疗14天后上午8时测指尖血氧饱和度(SpO2)。每天治疗时间于睡前开始进行至第二天上午8时,对照组也进行相同检查。检查前12小时禁服安眠药物以及酒、咖啡等影响睡眠的饮食,14天内无呼吸道感染病史。HIF-1α试剂盒购自武汉博士德生物工程有限公司,MDA、SOD试剂盒购自南京建成生物工程研究所,均严格按照说明书操作,计算样本结果。
1.3统计学方法使用SPSS 18.0软件进行统计分析。计量资料以均数±标准差表示,统计方法采用ANOVA法,组间两两比较采用q检验。P< 0.05为差异有统计学意义。
2 结果
2.1两组间HIF-1α、MDA、SOD的水平比较治疗前OSAHS组HIF-1α水平明显高于对照组及治疗后 (P< 0.01),治疗后OSAHS组与对照组比较差异无统计学意义(P> 0.05);OSAHS组治疗前后的MDA水平均明显高于对照组,SOD水平明显低于对照组,差异有统计学意义(P< 0.01),见表2。

表2 两组HIF-1α、MDA、SOD比较
*与对照组比较,P< 0.01;#与OSAHS组治疗前比较,P< 0.01
2.2两组AHI、SpO2、MSpO2的水平比较OSAHS组治疗前后AHI明显高于对照组,MSpO2明显低于对照组,SpO2水平明显低于对照组,差异有统计学意义 (P< 0.01);OSAHS组治疗前后SpO2水平比较,差异无统计学意义(P> 0.05),见表3。

表3 两组AHI、MSpO2、SpO2比较
*与对照组比较,P< 0.01;#与OSAHS组治疗前比较,P< 0.01
3 讨论
OSAHS是现实生活中常见的一种睡眠障碍疾病,上呼吸道阻塞性改变导致在睡眠时反复出现的呼吸暂停和或低通气状态,其表现主要以夜间低氧血症、高碳酸血症、睡眠结构紊乱等为主的一种临床综合征。OSAHS为肺源性心脏病、高血压、冠心病、中风等疾病的高危险因素,其发病率呈现逐年增高,发病人群分布广。
OSAHS的基本特点就是睡眠时存在的上呼吸道气流受限在睡眠时会出现低氧血症、高碳酸血症、睡眠结构紊乱等症状,因此,对OSAHS缺氧后的补偿机制的研究就显得极其重要。缺氧作为一个关键的因素左右了OSAHS的进展、发病及预后,OSAHS发病机制目前尚未完全清楚,目前研究比较认可的可能发病机制包括慢性间歇性低氧(chronic intermittent hypoxic,CIH)、炎症反应、睡眠结构片段化、内皮功能损伤、激素变化等等[6~8]。CIH引起的OSAHS最主要的病生理机制可能是慢性间断性缺氧所导致的一系列氧化应激及系统性炎症反应[9,10]。既往的研究提示:OSAHS患者长期体内间断低氧刺激了活性氧的产生,进而引起HIF-1 a的基因上调表达,从而导致合成增加,血清HIF-1α水平增高[11]。HIF-1α是Semenza等在1992年在研究缺氧诱导的促红细胞生成素基因表达过程中首先发现并报道[12]。不论什么情况下引起缺氧,即会导致HIF-1α表达上调且进入到细胞核内与缺氧反应元件相结合,通过靶基因转录进行调控[13],OSAHS患者长期体内间断低氧产生活性氧致使体内HIF-la的表达水平增加及系统性炎症的发生。MDA体现了机体脂质过氧化的程度,根据其水平可反应机体受自由基损害的严重程度。SOD是自由基的重要清除酶之一,其活力越高,机体的清除氧自由基的能力越强[14]。本研究结果提示,呼吸机治疗前的OSAHS患者的血HIF-1α、MDA水平明显增高,经过呼吸机辅助通气治疗的患者血HIF-1α、MDA水平明显降低,而SOD则有所上升,我们的结果和以往的研究结果类似[15]。我们考虑OSAHS的发展过程中,HIF-1α作为一个关键性因素,在缺氧时得到激活,上调一系列缺氧基因水平,从而使机体适应缺氧环境,同时其可以上调多种炎症因子如血管内皮生长因子、转化生长因子等等,参与全身炎症,反过来炎症因子又可以引起低氧的加重,导致HIF-1α的合成增多,降解减少[16],缺氧导致氧自由基生成增多,致使机体细胞的脂质过氧化损伤增加,从而消耗大量SOD,在急性缺氧或慢性缺氧早期,HIF-1α生成增加可减少氧自由基的生成,从而减少SOD的消耗[17],然而随着缺氧时间的延长,HIF-1α生成增加已不能抑制氧自由基的生成,我们的结果提示SOD明显减少,经过呼吸机治疗后,则HIF-1α和SOD的水平都得到恢复,考虑为经呼吸机治疗后慢性间断低氧得到纠正,氧化应激系统性炎症受到抑制,HIF-1α水平随之下降,由此,我们考虑OSAHS患者HIF-1α的增高是慢性间断缺氧激发了氧化应激及炎症反应所致,而纠正OSAHS患者睡眠时的低氧状态,可以减轻机体的氧化应激反应及炎症反应,就有可能阻断OSAHS所衍生的相关并发症的发展进程。
综上所述,本研究结果表明慢性间断性低氧导致OSAHS患者血中HIF-1α水平明显升高,通过呼吸机辅助通气治疗有可能减缓该过程。

