miR-30b在膀胱癌中表达的临床意义及对膀胱癌细胞生物学特性影响研究
李利军,邱明星,马志伟,龚百生
(四川省医学科学院·四川省人民医院泌尿外科,四川 成都 610072)
膀胱癌是最常见的泌尿生殖系统癌症,是影响患者健康及生命安全的恶性疾病,发病率及死亡率均较高。目前临床对于此类疾病主要采用手术切除为主,化疗、放疗等综合治疗为辅,但疗效均不理想[1,2]。寻找膀胱癌的发病基因,从遗传学途径了解膀胱癌的发生机制,是膀胱癌诊疗的基础[3]。MicroRNA是一种内源性的具有调控功能的小分子RNA,通常在转录后表达,研究表明[4,5],miRNA能够参与癌细胞的各项生物学过程,如增殖、分化、凋亡等,miRNA具有组织特异性、时序性及保守性的特点,因此有学者认为miRNA属于新层次上的基因表达调控,miRNA的表达可能作为肿瘤预后的重要指标。miR-30b是近年来发现在肿瘤细胞中出现异常表达的一类miRNA,研究显示,miR-30b具有一定的抑癌基因功能[6]。但国内对于miR-30b在膀胱癌中的表达尚缺少研究。本文就miR-30b与膀胱癌的相关性,及miR-30b对膀胱癌细胞生物学特性的影响进行了研究分析,现报道如下。
1 资料与方法
1.1一般资料2012年7月至2015年9月我院泌尿外科32例膀胱癌手术患者,男21例,女11例,年龄42~76岁[(61.3±4.9)岁]。均行膀胱切除术治疗,病理检验证实为膀胱尿路上皮癌,取标本前均未进行过放化疗或免疫治疗。除取患者的肿瘤组织标本外,同时取距离肿瘤边缘3~5 cm的正常组织作为对照标本,每份标本分别置于液氮罐及福尔马林溶液中进行保存,固定后石蜡包埋送病理诊断。临床分期标准参照国际抗癌联盟2002年的TNM分期法[7],病理分期标准参照WHO1973分级标准[8]。
1.2方法
1.2.1细胞及试剂来源 膀胱癌细胞T24、5637来自于中南大学湘雅医学院细胞中心,肿瘤系,肿瘤细胞采用10%胎牛血清培养,培养基为DMEM培养基,置于37 ℃培养箱。培养基及胎牛血清由美国GIBCO公司生产,试剂盒由Qiagen公司生产。
1.2.2试验方法 采用实时荧光定量检验。组织和细胞置入700 μlQIAzol混匀,室温5 min;加入140 μl氯仿,震荡摇匀,室温放置2 min后于12000r/min下离心15 min,取上清液,加入500 μl无水乙醇,混匀,10000r/min下离心15 s,去穿流液并再次重复该步骤,洗柱,取BufferRPE500 μl置于室温下10000r/min下离心2 min,转移至1.5 ml收集管,加入RNase-free water 50 μl至内膜,震荡摇匀,置于-70 ℃下保存。依次加入1ug total RNA,1 μl 10×reaction buffer,0.25 μl RiboLock Ribonuclease,0.25 μl Inhibitor,8 μl DEPC-treated water,1 μl DNase I,置于37 ℃下孵育30 min,加入1 μl EDTA并置于65 ℃下孵育10 min,添加至PCR管中,短暂离心混匀,95 ℃预变性5 min,扩增40各Cycling,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 s。取培养液加入96孔板,每孔100 μl,置于37 ℃条件下培养24 h,加入受试化合物,采用Dilution Buffer稀释1/5,每孔加入50 μl 1×MTT,37 ℃下孵育4 h,吸出上清液,每孔加入150 μl DMSO,摇匀,采用酶标仪测量570 nm波长时的每孔光密度,细胞存活率=(加药细胞OD-本底OD/对照细胞OD-本底OD)×100%。消化细胞,离心,去培养液,PBS洗1~2次,采用BSA无血清培养基重悬,调节密度为5×104ml。加入6孔板,加入1 mlFBS培养基,在Transwell上室加入细胞悬2 ml,常规培养24 h,95%酒精固定20 min,苏木素染色10 min,200×电镜下观察随机5各视野的计数。取1×107个细胞在4 ℃下离心5 min,吸去上清,PBS洗1次,取样品细胞加入裂解液100 μl重悬,冰浴裂解15 min,4 ℃下离心10 min,将上清液转入离心管,取少量样品测定蛋白浓度,绘制caspase-3酶活性标准曲线图。
1.3统计学方法采用SPSS 19.0进行数据统计。计量资料以均数±标准差表示,组间比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1miR-30b的表达膀胱癌细胞中的miR-30b表达为(1.096±0.449),与癌旁组织的(8.617±1.856)比较,显著降低(t=-6.822,P< 0.05)。
2.2临床分期各组中miR-30b的表达本组患者包括II期19例,III~IV期13例,其中miR-30b在II期患者的癌症组织中表达量为(1.092±0.437),在III~IV期患者中表达量为(1.104±0.456),差异无统计学意义(P> 0.05)。
2.3病理分期各组中miR-30b的表达本组患者包括中低分化21例,高分化11例,miR-30b在中低分化患者中的表达量为(0.741±0.209),在高分化患者中的表达量为(1.690±0.479),差异有统计学意义(t=-3.145,P< 0.05)。
2.4转染效率采用绿色荧光标记6 h,在荧光倒置显微镜下观察细胞胞浆表达情况,评价转染效率。结果显示miR-30b的细胞转染率达到80%以上,证明本次转染能够有效将miR-30b转染于T24肿瘤细胞。见图1、图2。

图1 转染目的miR-30b mimics组转染效率检测
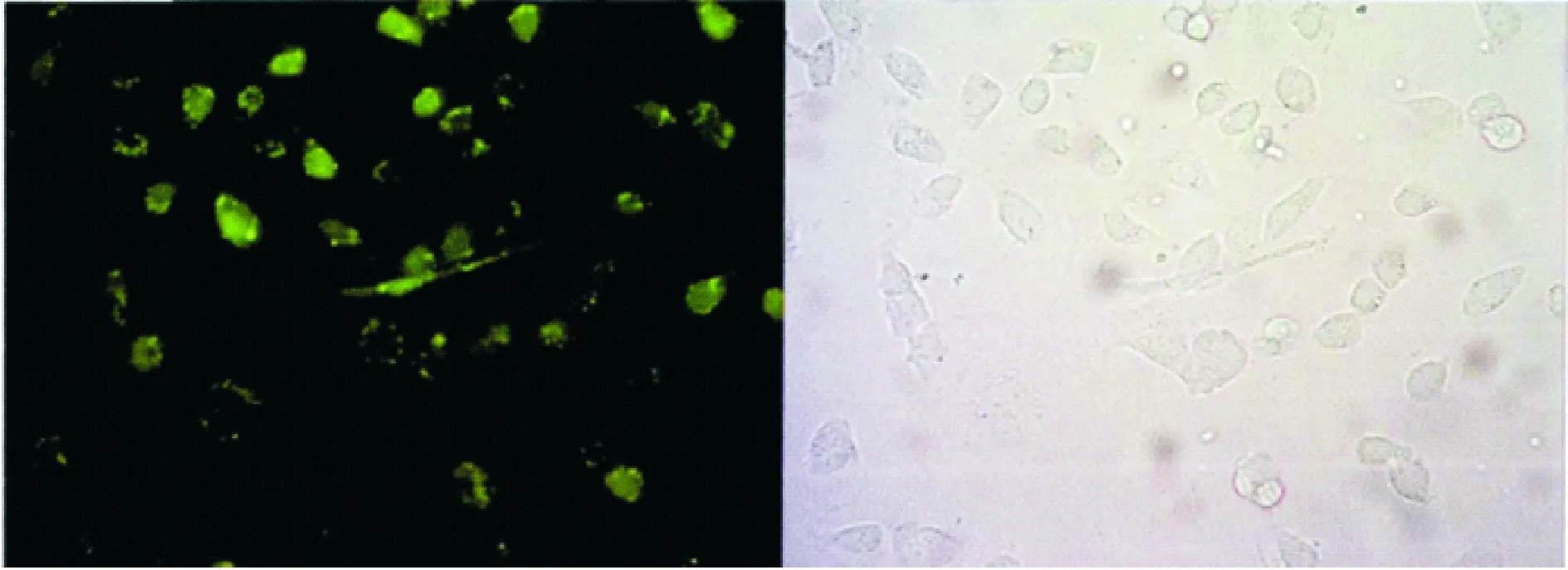
图2 阴性对照组转染效率检测
2.5miR-30b对癌细胞侵袭能力的的影响将Transwell小室置入培养板,用聚碳酸酯膜隔离上下室,将T24肿瘤细胞置入上室,统计进入下室的T24数量,以此来评价癌细胞的侵袭能力。结果显示,转染miR-30b组T24细胞的侵袭数量为(19.43±2.06),阴性对照组的侵染数量为(45.49±3.56),差异有统计学意义(t=-10.974,P< 0.05)。
2.6miR-30b对癌细胞凋亡的影响采用标准曲线公式计算各组中的caspase-3酶活性,阴性对照组酶活性为(15.437±1.594)U/mg,转染miR-30b组的酶活性为(46.019±6.004)U/mg,差异有统计学意义(t=-8.527,P< 0.05)。
3 讨论
膀胱癌属于泌尿生殖系统的常见肿瘤,目前尚无特效治疗方案,研究膀胱癌的发病机制,对于预防、治疗膀胱癌均有着重要的意义。既往的研究主要集中在膀胱癌细胞基因的改变上,但目前尚未有突破性进展。目前已知与膀胱癌相关的基因型较多,Derfoul等[9]的研究指出bcl-2的异常表达是导致膀胱癌辐射治疗效果降低的独立因素;Catto等[10]的研究发现膀胱癌中C-myc蛋白的表达与癌细胞的增殖、侵袭能力有显著相关。
miRNA属于一种小型非编码RNA分组,这些小型的RNA实在转录后水平调控基因表达,属于更高层次上的调控。CNS将miNRA的研究进展列为十大科技突破之一,肯定了miRNA在癌细胞机制研究中的意义[11]。肿瘤细胞与正常组织miRNA的表达存在显著差异,且大多数miRNA都处于相对脆弱的基因位点上,这提示miRNA可能在肿瘤的行程中有着重要的作用。Feng等[12]对412个哺乳动物的样本中的miRNA表达谱进行了分析,研究显示miRNA的表达能提供多种有用信息,可以反映出肿瘤的分化状态及发展谱系。Li等[13]对174例膀胱癌患者组织标本和52例正常膀胱标本进行了miRNA检测,结果发现若干表达差异的miRNA,其中miR-145下调最为显著,miR-21上调最为显著,该研究指出miR-129、miR-133b等属于具有预测肿瘤进展潜能的重要miRNA。本次研究中利用实时荧光定量检验对膀胱癌标本和癌旁组织进行了miR-30b的表达检测,结果发现miR-30b在膀胱癌组织中的表达显著低于正常组织,这提示miR-30b可能与膀胱癌的发生有所相关。
Nagaraja等[14]研究认为不同分级的膀胱癌的发生、发展途径有所不同。有相关研究显示,不同分级的膀胱癌的miRNA表达谱也存在显著差异,例如miR-125b在肌层浸润性膀胱癌中的表达最高,而miR-10则在浅表性膀胱癌中的表达最高。从本次研究情况来看,miR-30b在不同临床分期患者中的表达并无差异,考虑原因主要是本次选择标本均为浸润性膀胱癌。但从病理分级来看,miR-30b的表达与肿瘤组织的分化程度有所相关,高分化的癌症组织中miR-30b的表达相对较高,中低分化组织中的表达则相对较低,提示miR-30b可能具有抑癌基因的特点。
研究表明[15,16],miRNA能够广泛的参与到基因表达的各种生物学调控中,包括细胞的增殖、侵袭、转移及凋亡等。有研究表明[17],miRNA是肿瘤细胞发生发展的重要因素,与肿瘤的转归也有密切相关,miRNA能够参与到肿瘤细胞的周期调控、转录、血管生成、浸润及凋亡等环节中,正常细胞与癌细胞中的多种miRNA表达均存在显著差异,这说明miRNA可能在肿瘤中扮演中癌基因或抑癌基因的角色。Goebell等[18]的报道指出,包括miR-221、miR-223、miR-23b、miR-26b在内的多种miRNA均能够在膀胱上皮癌中异常表达。Guertin等[19]的研究发现了miR-200家族,并指出miR-205在膀胱癌组织中的表达显著降低。
细胞增殖是细胞生命活动的最基本特征。本次研究结果显示,miR-30b在膀胱癌T24细胞中的增值速度与阴性对照组相比明显降低,提示miR-30b能够抑制T24细胞的增殖,发挥了抑癌基因的效果。
侵袭能力是导致癌性肿瘤患者死亡的重要因素,属于一个复杂的动态性过程。近年来的研究显示miRNA的表达能够影响肿瘤细胞的侵袭性,Castedo等[20]的研究显示miRNA200家族在未分化甲状腺癌中的表达显著低于高分化甲状腺癌,推测此类miRNA的表达降低能够促进未分化甲状腺癌的潜在侵袭性。从本次侵袭转移研究来看,miR-30b转染组的T24细胞的侵袭能力相较于阴性对照组而言明显减弱,这提示miR-30b具有抑制膀胱癌细胞侵袭能力的作用。
肿瘤细胞的凋亡与增殖功能相反,同样决定着肿瘤的消长能力。越来越多的研究显示miRNA属于调控癌症细胞增殖和凋亡的重要因素。Hansel等[21]的研究显示miR-21在乳腺癌组织中的表达显著增高,利用抗肿瘤ASO片段抑制乳腺癌细胞miR-21的表达后,乳腺癌细胞的生长明显受到抑制,细胞的凋亡率增加,这个研究显示miR-21的表达降低能够促进乳腺癌组织的凋亡。Caspase属于半胱氨酸蛋白酶家族,在细胞凋亡过程中有着重要的作用,caspase通常以酶原形式存在,在正常组织和肿瘤组织中均有表达,一旦caspase被激活并执行致命性切割指令,即会引起细胞的凋亡[22]。本次研究检测T24癌细胞的凋亡即是基于caspase的特性,利用测定吸光度来检测caspase-3的活性。本次研究显示,miR-30b转染组的凋亡率显著高于阴性对照组,提示miR-30b的表达越低,细胞的凋亡率也就越低。
综上所述,膀胱癌组织中的miR-30b表达水平显著低于癌旁组织,提示miR-30b的水平与膀胱癌的发生发展有所相关,miR-30b的表达与临床分期无关,但与病理分期显著相关,miR-30b导入膀胱癌细胞后,能够显著抑制癌细胞的侵袭能力,加速癌细胞的凋亡。

