DNA羟甲基化酶TET1对良性前列腺增生细胞的增殖调控作用及其机制
徐成党, 黄盛松, 钱多成, 吴登龙
(同济大学附属同济医院泌尿外科,上海 200065)
良性前列腺增生(benign prostatic hyperplasia, BPH)常被称为前列腺增生,多见于中老年男性患者,是最为常见的导致排尿障碍的良性疾病,主要是前列腺中异常增生的组织造成膀胱出口的机械性梗阻(bladder outlet obstruction, BOO),引起下尿路症状(lower urinary tract symptoms, LUTS)并伴随不同程度的排尿困难,排尿费力等主要临床症状[1]。前列腺增生不是弥漫性增生,而是移行带区域的过度增生[2]。前列腺增生的发病机制仍未完全清楚,目前认为老龄和雄激素是发病的必要条件。有报道前列腺体积大小和体内双氢睾酮(DHT)水平呈正比,而与睾酮(T)无关。DHT在体内Ⅱ型5α-还原酶的作用下由睾酮转化而来[3],而Ⅱ型5α-还原酶的表达受其调控基因SRD5A2启动子区域甲基化水平的影响[4]。甲基化是一个动态可调控的过程,其受去甲基化酶的影响,DNA羟甲基化酶TET1能够发挥调控SRD5A2表达的作用[5-6]。本研究拟探讨TET1在前列腺增生过程中的作用及机制。
1 材料与方法
1.1 标本来源
选取2016年5月至2017年9月期间就诊于同济大学附属同济医院泌尿外科因前列腺特异性抗原(PSA)升高行前列腺穿刺、因前列腺增生行前列腺电切、因膀胱癌行根治术患者,收集其前列腺标本,按前列腺大小分为A、B和C三组[7]: A组(前列腺体积V<30mL)11例,前列腺体积(21±5) mL,其中膀胱癌根治术6例,因PSA升高行前列腺穿刺5例;B组(30mL≤V≤70mL)34例,前列腺体积(47±11) mL,其中前列腺穿刺24例,前列腺增生行电切10例;C组(V>70mL)27例,前列腺体积(96±13) mL,其中前列腺穿刺10例,前列腺电切17例。所有病例均在直肠B超引导下经会阴前列腺穿刺分别取外周带和移行带组织各3条,分别用来进行免疫组化和定量聚合酶链反应(qPCR)检测外周带和移行带TET1和SRD5A2的表达,酶联免疫吸附实验(ELISA)检测组织中DHT水平。本研究中涉及到的所有病例标本来源均获得同济大学附属同济医院伦理委员会批准和患者及家属知情同意。
1.2 病例入组标准和排除标准
入组标准: 所有病例取材均经病理证实为前列腺增生和不增生组织,排除前列腺炎和前列腺癌,膀胱癌根治标本证实无前列腺侵犯转移,所有病例随访6个月无前列腺癌。排除标准: 取样前6个月内服用过5α-还原酶抑制剂及其他激素类药物,近期有泌尿道感染、尿常规异常、留置导尿病史者。
1.3 材料及主要试剂
人正常前列腺上皮细胞RWPE-1购自北纳科技有限公司,KSFM细胞培养基购自美国Hyclone公司。抗体TET1、SRD5A2、5-MC购自美国Abcam公司,细胞凋亡检测试剂盒和细胞增殖CCK-8检测试剂购自美国Sigma公司,ELISA检测DHT试剂盒购自上海同进生物科技有限公司,其他试剂及材料来自同济大学附属同济医院中心实验室。TET1基因功能区序列上游引物5′-AGCTGGATTGAAGGAACAGG-3′,下游引物5′-GTCTCCATGAGCTCC-CTGAC-3′。
1.4 组织免疫组化、qPCR检测
所有病例穿刺后外周带和移行带标本各取2条,其中1条送至病理科,进行免疫组化检测TET1、Ⅱ型5α-还原酶和甲基化状态(5-mc)。另外1条利用TRIzol法提取RNA进行PCR检测TET1和SRD5A2的mRNA表达量。
1.5 前列腺组织免疫组化染色结果判定方法
免疫组化染色后,观察TET1及Ⅱ型5α-还原酶在不同区带及不同类型细胞中的分布差异,同时比较相应部位的甲基化状态。染色结果由2位病理科医生双盲阅片判定,光镜下观察细胞染色程度和范围,读片后按细胞显色强度及比例评分,每张切片随机读取5个视野(×400)。评分标准: 不着色为0分(-),浅黄色为1分(+),棕黄色为2分(++),棕褐色为3分(+++);阳性细胞百分比<5%为0分,5%~25%为1分,25%~50%为2分,>50%为3分,两者乘积的积分>3分为阳性,见表1。
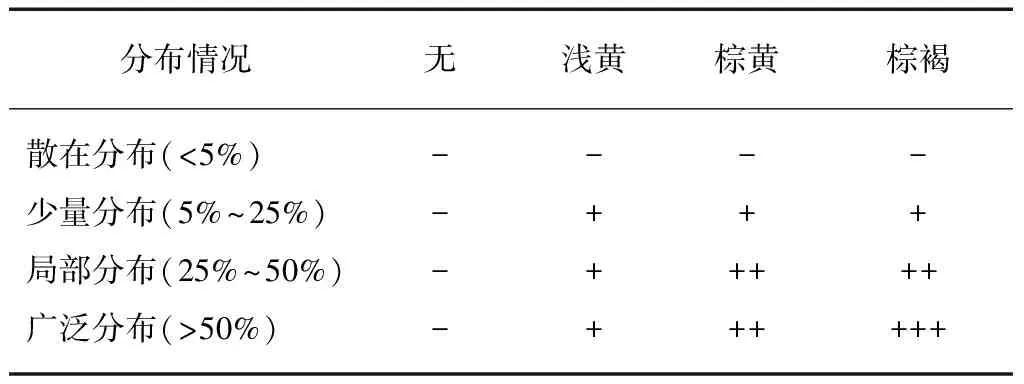
表1 免疫组化染色
1.6 ELISA法检测组织中DHT含量
收集到的标本立刻存入-80℃冰箱防止DHT降解。样本解冻后磨成匀浆,离心半径4cm,2000r/min,离心10min后收集上清液,用试剂盒进行检测(重复3次),检测过程中稀释5倍。
1.7 细胞培养
Rwpe-1细胞生长于KSFM培养液,置37℃、100%饱和湿度、5% CO2的培养箱中培养。细胞呈单层贴壁生长,融合度达80%~90%时进行常规传代。
1.8 利用转染干扰和过表达Rwpe-1细胞TET1基因
转染前1d收集融合度为80%的Rwpe-1细胞,用KSFM培养液调整其密度为1×105/mL,将细胞以1×105/孔接种于6孔板(2mL/孔)中,当细胞在24h内融合达60%~80%时进行转染。采用阳离子脂质体Lipofectamine 6000,按试剂盒说明书进行转染。实验分3组: 对照组(Ctrl组),过表达组(TET1-OE组),敲减组(TET1-KD组)。转染的细胞用于后续的CCK-8法细胞增殖、周期、凋亡、蛋白印迹和qPCR检测。
1.9 转染后TET1和SRD5A2基因mRNA表达及蛋白质水平检测
转染24h后TRIzol法提取总RNA,反转录得到cDNA,再进行PCR扩增,反应条件如下。95℃预变性1min,95℃ 15s,60℃ 30s,72℃ 45s,40个循环,72℃ 5min。计算各组间TET1和SRD5A2的mRNA表达水平的相对比值。
转染48h后,抽提总蛋白,行蛋白定量、电泳、转膜、封闭。4℃条件下TET1和SRD5A2抗体(1∶1000)孵育过夜,荧光二抗(1∶1000)孵育后,用Odyseey数字显像系统采集信号(以GADPH为内参)。应用QuantityOne软件进行分析,以目的蛋白条带的灰度值与内参照GADPH蛋白条带灰度值的比值表示目的蛋白的相对表达水平(实验重复3次)。
1.10 CCK-8法检测转染后对细胞增殖的影响
收集6孔板中转染Ctrl组、TET1-OE组、TET1-KD组0、24、48、72h后的Rwpe-1细胞检测,细胞增殖活性,每孔加入20μL CCK-8,孵育4h,用酶标仪检测波长450nm处光密度(D450),各组求均值,描绘总的生长曲线。每组设6个复孔(实验重复3次)。
1.11 流式细胞术检测各组细胞凋亡率
用Annexin V-FITC和PI标记流式细胞技术对转染后的Rwpe-1细胞系进行检测。消化并收集转染48h后的Rwpe-1细胞,将试剂盒中10× Annexin V结合液以蒸馏水稀释10倍。用1× Annexin V结合液悬浮细胞,使其密度为1×106/mL。取100μL上述步骤的细胞悬液,加入新的管中。向细胞悬液中加入5μL Annexin V-FITC结合物,再加5μL碘化丙啶溶液。避光条件下常温继续培养细胞15min,加入400μL 1×Annexin V结合液,Tube管置于流式细胞仪中,尽快检测(最好在1h内)以免细胞活性下降。实验重复3次,结果取平均值。
1.12 统计学处理
应用SPSS 21.00软件对数据进行统计学分析。免疫组化结果分析采用卡方检验。两组间的比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组化检测组织中TET1、5-mc和SRD5A2表达差异
在BPH移行带及外周带组织中,TET1表达于上皮及间质细胞,胞质阳性,移行带中显色强度高于外周带,阳性细胞数目增多,阳性率明显升高(P<0.05);组织甲基化染色呈细胞核阳性,移行带中显色强度及阳性细胞数目低于外周带,阳性率明显降低(P<0.05);Ⅱ型5α-还原酶表达于上皮及间质细胞,以上皮细胞表达占优,细胞核及胞质均可呈阳性,移行带中显色强度及阳性细胞数目高于外周带,阳性率明显升高(P<0.05)。
A组中TET1、5-mc、Ⅱ型5α-还原酶的表达量在外周带和移行带中无明显差异(P>0.05);B组和C组中TET1、Ⅱ型5α-还原酶在移行带中的表达高于外周带,移行带中5-mc的表达低于外周带,甲基化状态降低,见图1~3。
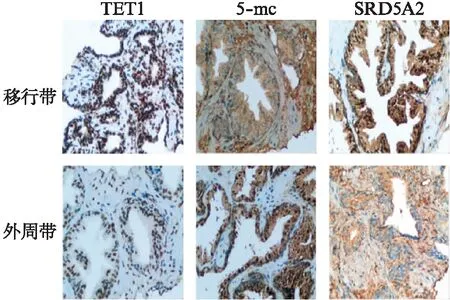
图1 前列腺组织免疫组化染色结果Fig.1 The immunohistochemical staining of the prostate tissue
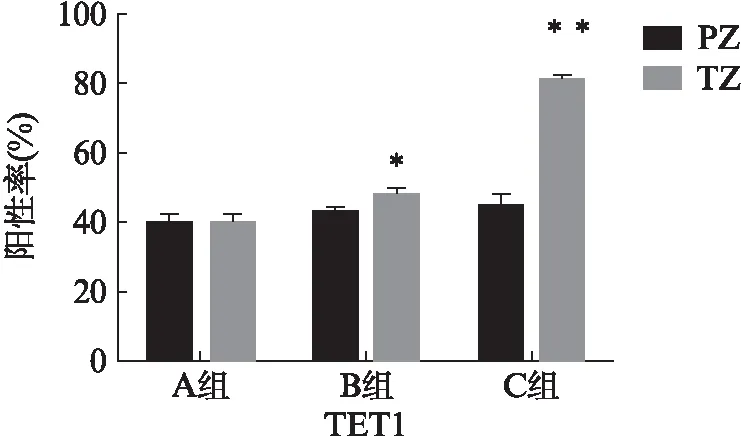
图2 前列腺组织免疫组化TET1阳性率Fig.2 TET1 positive rate of immunohistochemistry of the prostate tissuePZ: 外周带,TZ: 移行带;与外周带相比,**P<0.01

图3 前列腺组织免疫组化甲基化状态、Ⅱ型5α-还原酶阳性率Fig.3 Methylation status and 5 α-reductase Ⅱ positive rate of immunohistochemical methylation in prostate tissue与外周带相比,*P<0.05,**P<0.01
2.2 各组前列腺组织TET1和SRD5A2基因表达
qRT-PCR显示A组中外周带和移行带相比TET1和SRD5A2的mRNA表达量差异无统计学意义(P>0.05);而在B和C组中,移行带中TET1和SRD5A2的mRNA表达量高于外周带,见图4。
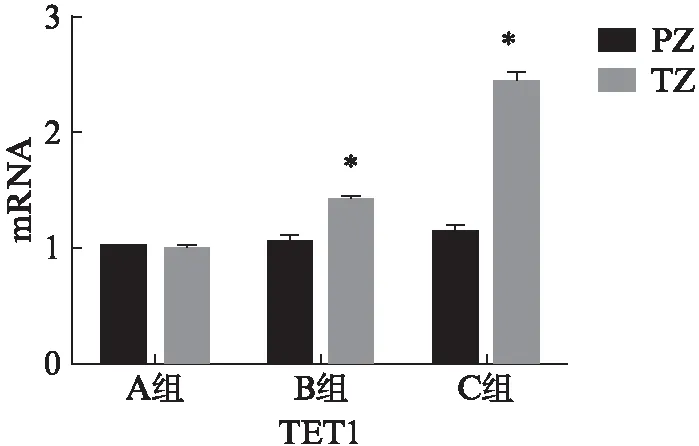
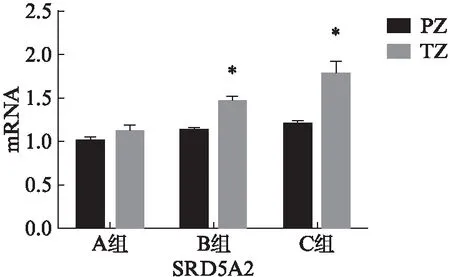
图4 三组样本中TET1和SRD5A2 mRNA表达Fig.4 Expression of TET1 and SRD5A2 mRNA in three groups of sample与外周带和移行带相比,*P<0.05
2.3 各组前列腺组织中DHT水平
A组外周带和移行带中DHT含量差异无统计学意义(P>0.05),B组和C组移行带中DHT含量高于外周带,差异具有统计学意义(P<0.05),见图5。
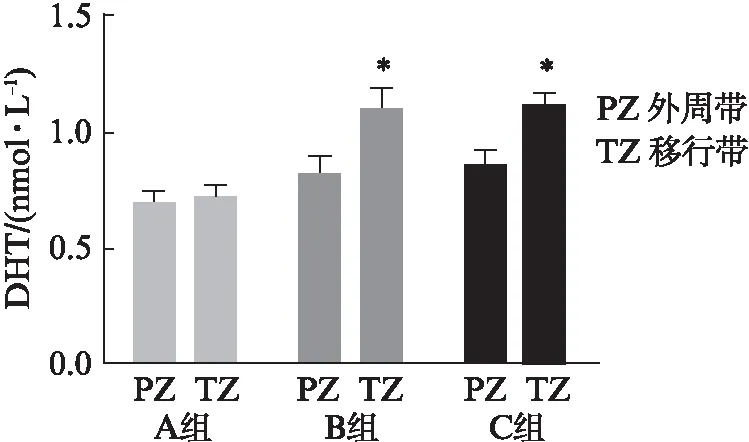
图5 三组样本外周带和移行带中DHT含量Fig.5 Expression of DHT in three groups of sample与外周带相比,*P<0.05
2.4 各组细胞增殖速度比较
TET1-OE组细胞增殖速度大于对照组,差异具有统计学意义(P<0.05)。与对照组相比,TET1-KD组细胞增殖速度慢(P<0.05),差异具有统计学意义,见图6。
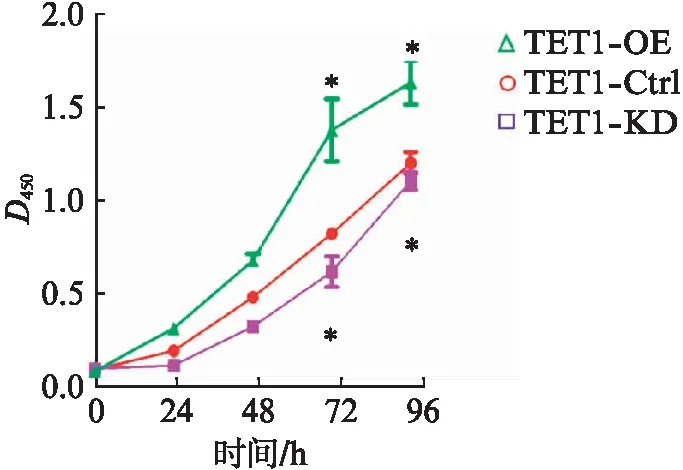
图6 Rwpe-1细胞增殖实验Fig.6 The proliferation assay of Rwpe-1 cell
2.5 各组细胞Ⅱ型5α-还原酶蛋白表达
与对照组TET1-Ctrl(0.98±0.22)比较,TET1-OE组(1.52±0.34)Ⅱ型5α-还原酶蛋白表达量增加(P<0.05),TET1-KD组(0.52±0.18)表达量下降,差异具有统计学意义(P<0.05),见图7。
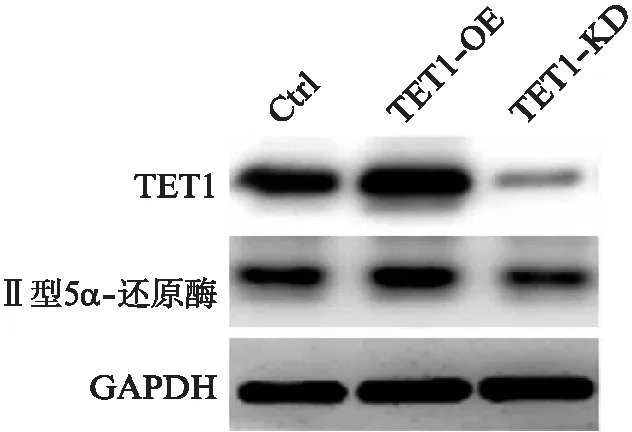
图7 Western印迹法检测各组TET1和SRD5A2蛋白表达结果Fig.7 The protein expression of TET1 and SRD5A2 in each group with Western blotting
2.6 qPCR检测各组细胞mRNA水平变化
与对照组(0.99±0.18)相比,TET1-OE组(40.12±4.62)细胞SRD5A2基因mRNA水平量上升(P<0.05),TET1-KD组(0.64±0.22)细胞SRD5A2基因mRNA水平量下降,差异具有统计学意义(P<0.05)。
2.7 敲减或过表达TET1对Rwpe-1细胞凋亡的影响
流式细胞术结果(图8)显示,TET1-OE组(3.61%±0.26)细胞凋亡率较阴性对照组TET1-Ctrl(7.00%±0.23)降低,TET1-KD组(11.10%±0.48)增加(P<0.05)。

图8 流式细胞术检测各组细胞48h凋亡图Fig.8 The cell apoptosis in each group under flow cytometry
3 讨 论
BPH是常见的引起中老年男性排尿障碍的原因,主要表现为下尿路梗阻症状,随着年龄增长发病率增高[8]。目前临床上主要采用观察等待、药物治疗和手术治疗三级策略[9],这其中要与前列腺癌治疗相区别[10]。药物治疗主要有5α-还原酶抑制剂等,但仍有20%~30%的患者无效,手术治疗也因其手术适应证和并发症而只适用于部分群体[11-13]。研究报道先天性缺乏Ⅱ型5α还原酶的人群及青春期前去势的人群均不会发生BPH,BPH组织中Ⅱ型5α还原酶表达高于正常前列腺组织,且表达强度与BPH体积呈正比关系。Ⅱ型5α还原酶基因SRD5A2启动子区域的DNA甲基化状态可影响Ⅱ型5α还原酶蛋白的表达,DNA甲基转移酶1(DNMT1)通过甲基化SRD5A2启动子使Ⅱ型5α还原酶表达明显下降;SRD5A2基因位于2p23的染色体上,DNA甲基化修饰受到DNA羟甲基化酶TET1的调控,TET1可发挥羟化酶活性去除5-甲基胞嘧啶的甲基化修饰,使得DNA甲基化的作用被移除[4-6]。DNA甲基化是DNA分子中的胞嘧啶处于甲基化状态,CpG岛可抑制所在基因的表达,与疾病的发生和发展有着密切关系,甲基化修饰不像转录因子调控那样快速,其只是基因表达调控过程中的一种中间形式,也无永久性的遗传改变的特点,甲基化仅影响核酸链中的胞嘧啶,其中约有50%的基因在启动子区域有集中分布的岛的存在,长度0.5~2kb[14]。因此推测在前列腺增生过程中,可能是移行带中TET1选择性过表达发挥去甲基化作用降低Ⅱ型5α-还原酶基因SRD5A2启动子区域的甲基化水平,Ⅱ型5α-还原酶表达增多促进睾酮转化为DHT的水平增加,打破前列腺细胞的增殖凋亡平衡,使细胞过度增殖而导致增生。
本研究分别通过临床病例和细胞水平来验证和探究该机制。临床病例结果显示,前列腺增生病例移行带中TET1和Ⅱ型5α还原酶的表达量高于外周带,甲基化水平低于外周带,DHT的水平高于外周带。利用慢病毒转染系统分别过表达和敲减人前列腺上皮细胞Rwpe-1的TET1基因,检测细胞的增殖凋亡水平,发现过表达组细胞的增殖能力高于敲减组,凋亡水平低于敲减组,且Ⅱ型5α还原酶SRD5A2的表达水平明显高于敲减组。结果提示TET1很可能是通过发挥去甲基化作用降低SRD5A2启动子的甲基化水平促进Ⅱ型5α还原酶表达,促进细胞增殖导致过度增生。更进一步的研究有待于运用染色质免疫共沉淀技术,利用特定的抗体结合染色体并使其片段沉淀,随后通过实时PCR方法检测目标片段中DNA的富集比例来检测SRD5A2启动子区域CPG岛的甲基化状态水平。TET1在前列腺移行带增生中的特异性作用的机制研究将有助于为治疗前列腺增生提供新的理论依据和靶标。

