缺血性卒中患者左心室质量指数与颅内、外动脉狭窄的相关性
赵敏,李顺,王猛猛,徐格林
在全球范围内,卒中是人类死亡的第二大原因,每年约有670万人死于卒中,占总死亡人数的11.9%[1]。缺血性卒中占所有卒中病例的80%~90%,动脉粥样硬化是缺血性卒中最主要的病因[2-3]。左心室质量(left ventricular mass,LVM)及左心室质量指数(left ventricular mass index,LVMI)可以独立于其他传统血管危险因素来预测心血管事件的风险[4]。LVM与LVMI是用来确定及诊断左心室肥厚的心脏超声检查指标,其中LVMI是通过校正LVM来消除人群因性别与BMI产生的偏移后的指标[5]。目前研究发现LVM、LVMI与发生缺血性卒中的风险相关并且与高血压患者的死亡率相关[6-7]。一项针对非洲裔美国人群的大型研究发现,LVM及LVMI是独立于传统风险因素的缺血性卒中的预测指标[8]。在大样本人群研究中发现,LVM及LVMI与卒中风险的相关性不受血压影响,降低LVM及LVMI可逆转心血管事件的发生风险[9]。目前关于LVM及LVMI与脑动脉粥样硬化性狭窄程度的相关性研究尚未见报道。本研究旨在探究LVM及LVMI与脑动脉粥样硬化狭窄程度的相关性。
1 研究对象与方法
1.1 研究对象 本研究是回顾性研究,纳入东部战区总医院南京卒中登记系统中2017年1-10月入院的缺血性卒中患者。
入组标准:①年龄>18岁;②发病2周内的缺血性卒中患者,包括由大血管狭窄或闭塞引起的缺血性卒中、腔隙性梗死、多发性缺血性卒中及TIA患者;③经DSA检查发现存在颅内或颅外动脉粥样硬化;④进行了心脏超声检查,并有LVM和LVMI指标数据。排除标准:①未行DSA造影检查者;②同时合并颅内和颅外动脉狭窄;③脑血管畸形、动脉夹层;④血管炎;⑤心源性卒中;⑥静脉性卒中。
1.2 临床资料收集 记录患者性别、年龄等一般资料;收集病历中记载的患者的血管危险因素,包括高血压、糖尿病、冠状动脉粥样硬化性心脏病等[10]。患者入院24 h内采集空腹静脉血样,使用Sysmex CHEMIX-180全自动生化分析仪测量总胆固醇、三酰甘油等生化指标。
1.3 LVMI测定 对入组患者实施经胸超声心动图检查。测量的指标包括左室舒张末期直径、室间隔厚度和舒张末期左心室后壁厚度。测量方法参考美国超声心电图学会制定的标准[11]。根据美国超声心动图学会制定的简化方程,对LVM进行校正得到LVMI,计算公式为:LVMI=LVM/身高(m)2.7[12-13]。
1.4 血管狭窄程度测定 遵循知情同意和获益的原则,征得患者及其家属同意后进行DSA检查。目前,颈动脉狭窄程度分级方法参照北美颈动脉外科学会狭窄率计算公式:动脉狭窄率=[(狭窄病变远端正常颈内动脉直径-颈动脉最窄处直径)/狭窄病变远端正常颈内动脉直径)]×100%[14]。根据巴塞罗那无症状性颅内动脉粥样硬化研究的分组设计,将患者分为颅外动脉狭窄组和颅内动脉狭窄组,每一组进一步分为动脉轻度狭窄组和中重度狭窄组。动脉狭窄率<50%为轻度狭窄,狭窄率≥50%为中重度狭窄[15]。
在进行LVMI与颅内外动脉狭窄率间的相关分析时,以颅内外动脉狭窄程度最严重的部分计算该患者脑动脉狭窄率。
1.5 统计分析 采用SPSS 22.0软件包进行统计分析。统计学显著差异设置为P<0.05。连续变量符合正态分布,采用表示,分类变量用频数和百分比表示。两组间比较连续变量采用t检验,分类变量采用卡方检验或Fisher精确检验。患者脑动脉狭窄率与LVMI两连续变量间的相关性采用Spearman相关分析。采用二元回归分析,对颅外组和颅内组分别进行回归分析,单变量分析中P<0.05的因素纳入模型,分析动脉粥样硬化狭窄程度的独立危险因素。
2 结果
2.1 一般资料 本研究共入组169例缺血性卒中患者。其中85例(50.3%)有颅外动脉狭窄,年龄范围为18~84岁,平均(60.6±13.3)岁,其中64例(75.3%)为男性。84例(49.7%)患者有颅内动脉狭窄,年龄范围为23~78岁,平均(56.2±13.0)岁,其中为52例(63.1%)为男性。
2.2 颅内、外动脉狭窄单因素分析 在颅外动脉狭窄的患者中,与轻度狭窄患者相比,中重度狭窄者年龄较大[(64.3±12.4)岁vs(56.0±13.2)岁,P=0.001],患冠状动脉粥样硬化性心脏病较多(27.7%vs7.9%,P=0.020),中重度狭窄者有较高的LVM[(179.1±39.2)gvs(148.5±33.6)g,P<0.001],LVMI也高于轻度狭窄组[(43.6±10.3)g/m2.7vs(36.6±7.2)g/m2.7,P<0.001](表1)。
在颅内动脉狭窄的患者中,与轻度狭窄患者相比,中重度狭窄者的LV M 较高[(184.5±66.0)gvs(147.5±34.4)g,P<0.0 0 1],LV M I 也高于轻 度狭窄患者[(46.1±13.6)g/m2.7vs(36.5±7.2)g/m2.7,P<0.001](表2)。
2.3 相关性分析结果 Spearman相关分析结果表明LVMI与颅内外动脉狭窄率呈正相关(r=0.553,P<0.001)。

表1 影响颅外动脉狭窄的因素
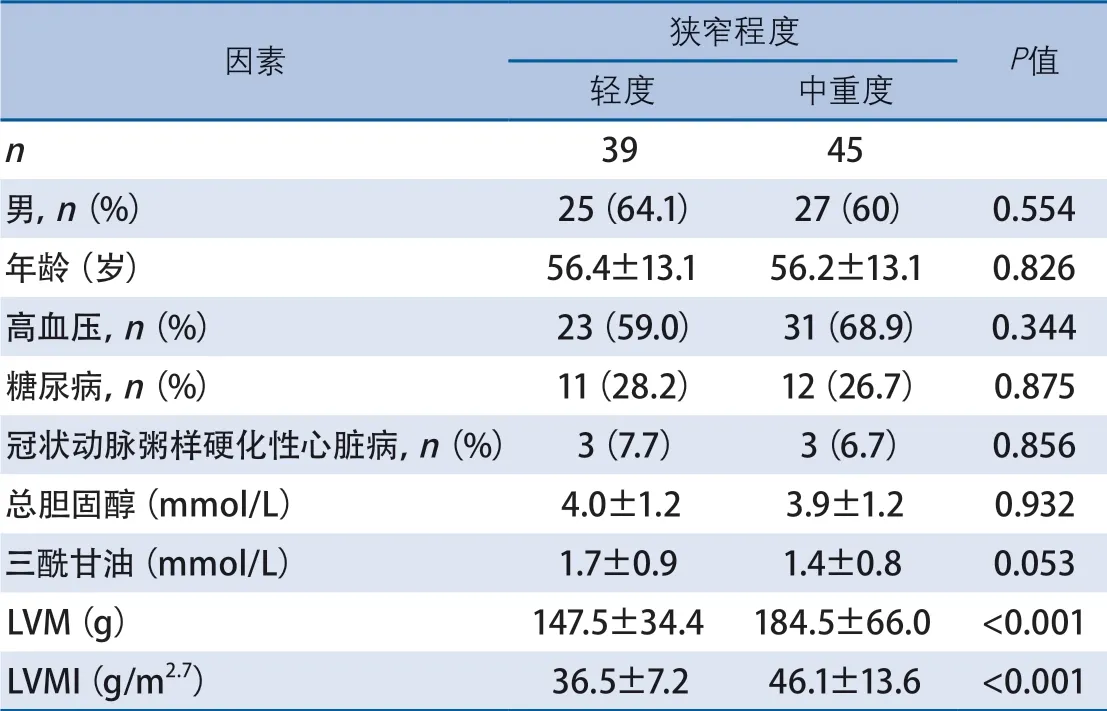
表2 影响颅内动脉狭窄的因素
2.4 多因素分析 二元回归分析发现LVMI和年龄是颅外动脉粥样硬化性狭窄程度的独立危险因素(表3)。
3 讨论
动脉粥样硬化是一种多因素、进行性的全身性疾病。虽然颅外和颅内动脉粥样硬化形成过程中涉及相似的血管危险因素和分子通路,但颅外动脉和颅内动脉之间的血流动力学、组织学特征的差异可能导致对同样有害刺激的不同反应。传统血管危险因素,如性别、年龄、高血压、糖尿病等对颅内、外动脉粥样硬化的影响也有所不同[16]。为明确颅内外动脉粥样硬化的危险因素,本研究对颅外、颅内动脉粥样硬化分别进行分析。
本研究中的相关性分析结果提示LVMI与颅内外动脉粥样硬化狭窄率呈正相关,意味着LVMI越高脑动脉狭窄率越高。弗雷明汉研究已经证实LVMI是心血管事件的独立危险因素,此后有研究也显示LVMI增加可导致心房颤动及其他心律失常事件发生,进而引起缺血性卒中事件发生[17]。此前已有研究发现LVMI与主动脉粥样硬化斑块及颈动脉粥样硬化斑块以及冠状动脉粥样硬化存在相关性[18-19]。在高血压、肥胖、老龄人群中,LVMI会显著增高,而这些因素又是促进动脉粥样硬化发生发展的重要危险因素,因此,共同的危险因素可能是LVMI与颅内外动脉粥样硬化二者存在关联的原因之一[20-21]。有研究显示,左心室肥厚与无症状性脑血管损伤如腔隙性梗死、脑白质病变相关,这些研究结果反映了LVMI对大脑微血管的损害[22]。同时LVMI反映了高血压状态的持续时间,高血压状态持续时间越长对靶器官及血管内皮造成的危害越大[22]。与周围血压相比,中心动脉压升高是动脉粥样硬化更敏感的危险因素[23]。在一项健康无高血压非洲裔美国青少年调查研究中发现,高LVMI人群会有更高的中心动脉压和外周血压[24]。更高的外周血压、中心动脉压会促进动脉粥样硬化发生发展。
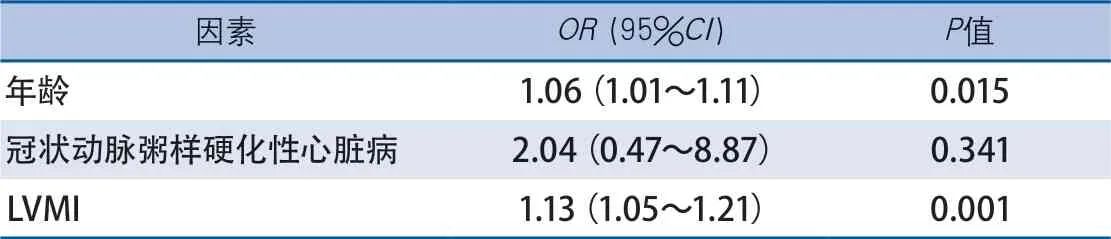
表3 多因素回归分析:颅外动脉粥样硬化狭窄的独立危险因素
许多靶器官与动脉粥样硬化的研究中提示LVMI与脑动脉粥样硬化可能有关。慢性肾脏病是心血管动脉粥样硬化的危险因素之一,它可以反映心血管疾病的严重程度[25]。而在一项大型社区动脉粥样硬化风险的队列研究中发现慢性肾脏病与高LVMI相关,在慢性肾脏病和LVMI呈阳性联系的背后有几个看似合理的机制,比如容积超载、肾素-血管紧张素系统激活、贫血和尿毒症等的影响。不论何种机制,这二者之间的联系提示LVMI与脑动脉粥样硬化可能存在联系[26]。
在动物实验中观察到在LV M I 增长过程中,体内的血管内皮生长因子(vascular endothelial growth factor,VEGF)浓度也会增长[27]。在动脉粥样硬化发展的分子机制上,血管内皮生长因子通过参与内皮细胞内的一系列信号通路,影响血管内皮功能,促进动脉粥样硬化的发展[28]。另外,在LVMI增长的过程中,体内的肾素-血管紧张素-醛固酮系统(reninangiotensin-aldosterone system,RAAS)会被过度激活,促进动脉粥样硬化的发生发展[29]。
在颅内外动脉粥样硬化狭窄程度危险因素分析中,糖尿病、胆固醇、三酰甘油等传统危险因素在单因素分析中没有显示出阳性预测价值,原因是因为第一样本数量偏小,第二是在分析胆固醇、三酰甘油时,因为研究人群的特殊,较多患者在服用降脂药,这可能是胆固醇、三酰甘油失去预测价值的主要原因。
本研究纳入的所有患者都进行了脑血管DSA检查,更精确地评价脑血管的狭窄程度,其次超声心动图对左室质量的估计比心电图的估计更具有敏感性和特异性。本研究还存在一定的局限性。首先,本研究纳入对象局限于急性缺血性卒中患者,病例数较少,且为回顾性研究,结果可能存在偏移。下一步需要前瞻性、更大规模的研究以及长期的随访来分析LVMI与脑动脉粥样硬化狭窄程度的关系。
【点睛】本研究通过对急性缺血性卒中患者资料的回顾性分析显示,左心室质量和左心室质量指数与缺血性卒中患者颅内和颅外动脉粥样硬化性狭窄均有相关性。

