红提葡萄灰霉病病原菌分离及拮抗真菌的筛选鉴定
赵海霞, 马岩涛, 李 涛
(银川能源学院 化学与生物工程学院, 宁夏 永宁 750010)
葡萄灰霉病是葡萄的主要病害之一,导致葡萄产量损失较重[1]。目前,葡萄灰霉病的防治方法主要是农业和化学防治,但这2种方法均存在一定的局限性[2]。采用拮抗微生物进行生物防治,可以有效减少化学农药的使用,解决其残留问题,同时延缓病菌产生耐药性。尤其对已经产生抗药性的病菌使用拮抗微生物防治,是一项有效治理抗药性的措施[3]。为此,笔者于2017年从宁夏红提葡萄发病的果实中分离出病原菌灰葡萄孢菌,利用其根际表面土壤,采用对峙生长法对红提葡萄灰霉病病原菌的拮抗菌株进行初步筛选,得到1株拮抗效果较好的拮抗菌,并对其进行菌种鉴定,以期为红提葡萄灰霉病的生物防治奠定基础。
1材料与方法
1.1材料
1.1.1红提葡萄灰霉病病果与土样均采自宁夏银川市永宁县小任果业种植基地6个不同区域,用无菌塑料袋带回实验室。
1.1.2培养基病原菌培养基PDA:去皮马铃薯200 g,琼脂18 g,葡萄糖20 g,自来水1 000 mL,pH自然。拮抗菌培养基YPD:酵母浸膏10 g,葡萄糖20 g,蛋白胨20 g,琼脂18 g,自来水1 000 mL,pH 7.2。拮抗菌发酵培养基YPD:酵母浸膏10 g,葡萄糖20 g,蛋白胨20 g,自来水1 000 mL,pH 7.2。
1.1.3试剂盒与扩增引物病原菌和拮抗菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒,购自北京天根生化科技有限公司。DNA扩增引物,由上海生工生物工程技术服务有限公司合成。
1.2方法
1.2.1葡萄灰霉病菌的分离红提葡萄病果表面用10%次氯酸钠溶液浸泡3 min后,用无菌水冲洗3次,按常规组织分离切取若干块,分别接种在培养基PDA上,22℃培养1~2 d后,挑选与灰葡萄孢菌形态相似的单菌落接到新培养基上,培养到菌落表现均匀一致为止。纯化后的菌株标记,接种到PDA斜面培养基上,22℃培养3 d后置于4℃冰箱。
1.2.2葡萄灰霉病菌拮抗真菌的分离取土样10 g加入90 mL无菌蒸馏水并充分混匀,制成10-1土壤悬浮液,加无菌水稀释成10-2、10-3、10-4、10-5和10-6梯度土壤悬浮液,分别取200 μL悬浮液涂布于固体培养基YPD上,每梯度重复3皿,30℃培养12 h,2 d后根据菌落特征挑选单个菌落于液体培养基YPD中,28℃、120 r/min培养过夜。
1.2.3葡萄灰霉病菌拮抗真菌的筛选采用平板对峙生长法,将灰霉病菌在直径9 cm固体培养基PDA上活化,用直径5 mm打孔器沿菌落边缘打孔,将菌饼置于空白PDA平板中央。在距培养皿中心30 mm,四周呈“十”字形点接各拮抗菌液(菌含量108CFU/mL),重复3皿,设不接种菌液处理为对照。28℃恒温培养7 d,测定菌株的生长直径和抑菌圈直径,并对其形态学,如生长状态、颜色、形状、表面、粗糙度、光泽、边缘形态、透明度等进行初步鉴定。
1.2.4灰霉病孢子萌发和菌丝生长抑制试验取葡萄灰霉病孢子菌含量106个/mL的悬浮液20 μL,加拮抗菌发酵液20 μL,以0.5%葡萄糖液作对照,置于无菌洁净载玻片上,25℃培养8 h后观察孢子萌发情况,计算拮抗菌发酵液对灰霉病孢子萌发的抑制率;取灰霉病菌孢子悬浮液0.5 mL加入PDA培养基,将直径5 mm的灭菌滤纸片蘸上发酵液,以无菌水作对照,25℃培养3 d后测量抑菌圈直径,计算拮抗菌发酵液对灰霉病菌丝生长的抑制率[4]。
抑制率=[(对照病斑直径-处理病斑直径)/对照病斑直径]×100%
1.2.5病原菌与拮抗菌的鉴定红提葡萄灰霉病病原菌与拮抗真菌菌株的形态特征分析参照《真菌鉴定手册》[5]。采用常规CTAB法提取基因组DNA,病原菌用微生物真菌菌株鉴定的特异引物ITS1(F):5′-TCCGTAGGTGAACCTGCGG-3′,ITS4(R):5′-TCCTCCGCTTATTGATATGC-3′;拮抗真菌用特异性引物ITS1:3′-TCCGTAGGTGAACCTGCGG-5′,LR3R:5′-GGTCCGTGTTTCAAGAC-3′,分别进行PCR扩增。反应体系:10×Buffer 2.0 μL,10 mmol/L dNTPs 1.0 μL,病原菌DNA 1.0 μL,ITS1(2 μmol/L)0.5 μL/ITS1(2 μmol/L)0.5 μL,ITS4(2 μmol/L)0.5 μL/LR3R(2 μmol/L)0.5 μL,TaqPolymerase 0.2 μL, ddH2O补足至20 μL。扩增条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,共35个循环;72℃最后延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测目的条带并回收纯化后,送至上海生工生物工程技术服务有限公司测序,获得的ITS测序结果在NCBI数据库中进行序列比对。
2结果与分析
2.1病原菌的筛选和鉴定
经分离纯化,在红提葡萄感染灰霉病的果实表面筛选出1株病原菌,标记为JD2016-8。该菌株在PDA培养基上生长正常,菌丝生长初期为灰白色,贴着培养基生长且速度快,菌丝颜色逐渐加深为灰褐色,气生菌丝茂盛、质地较疏松,长度较短。后期菌丝长满盘后菌落表面成粉状,气生菌丝顶端有灰褐色的孢子,产孢后期在培养基上出现黑色不规则的菌核,大小为(2~4)mm×(1~3)mm。菌落没有色素,背面不变色,但有发霉的气味,5 d左右可长满培养皿。显微镜下观察,病原菌分生孢子梗为灰褐色,有隔膜,顶端膨大且着生大量葡萄穗状的分生孢子,分生孢子为近圆形或椭圆形单孢,无色或淡色(图1)。根据《真菌鉴定手册》[5],初步确定JD2016-8为灰葡萄孢菌。
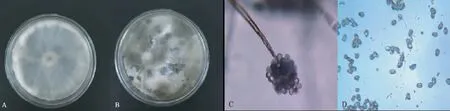
注:A为灰葡萄孢菌(生长5 d),B为灰葡萄孢菌(生长10 d),C为分生孢子梗,D为分生孢子。
Note: A.B.scinerea(after 5 d culture); B.B.cinerea(after 10 d culture); C. Conidiophore; D. Conidium.
图1分离菌的菌落形态及孢子显微结构
Fig.1 Colonial morphology and spore microstructure of isolated fungi
以病原菌JD2016-8基因组DNA为模板进行PCR扩增,得到约700 bp的目的条带(图2),并进行回收纯化测序。经序列比对,该菌与GenBank中(登录号:KJ685806.1)已知灰葡萄孢菌的ITS序列相似性达100%。结合形态特征和ITS序列分析,确定病原菌JD2016-8为灰葡萄孢菌(Botrytiscinerea)。

注:M为2 kb DNA Maker,1为病原菌。
Note: M. 2 kb DNA Marker; 1.Botrytiscinerea.
图2病原菌的ITS扩增电泳图谱
Fig.2 ITS amplification electrophoretogram ofB.cinereapathogenic fungus
2.2拮抗真菌筛选
对采集土壤样品进行梯度稀释法分离,共筛选到24株菌株,采用平板对峙生长法对分离菌株进行拮抗性复筛,只有少数菌株对灰霉病菌有抑制作用,其中有1株高效拮抗菌,标记为SW-W8(图3),其发酵滤液抑菌圈直径达25.5 mm。在复筛过程中,随培养时间延长,菌株SW-W8对病原菌的拮抗作用几乎不变。
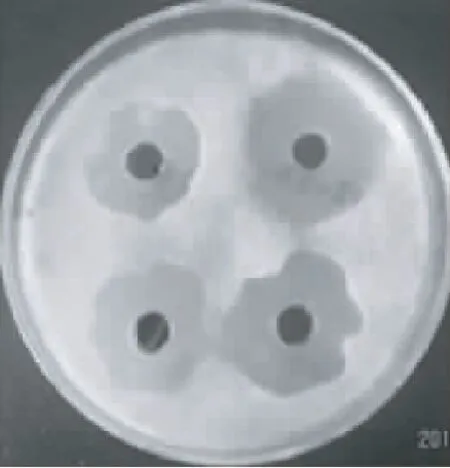
图3 SW-W8对红提葡萄灰霉病菌的抑制作用
Fig.3 Inhibition effect of antagonistic SW-W8 strain againstB.cinerea
2.3拮抗菌SW-W8的抑菌效果
经葡萄灰霉病孢子萌发和菌丝生长抑制试验,拮抗菌SW-W8对葡萄灰霉病孢子萌发的抑制率为100%,对葡萄灰霉病菌丝生长的抑制率为13.17%。
2.4拮抗真菌的鉴定
菌株SW-W8菌落为圆形、奶油色、不透明,表面光滑湿润,中间隆起,边缘整齐,不产生可溶性色素(图4)。通过光学显微镜观察菌体形态,初步确定SW-W8为酵母菌,其具体形态学鉴定特征见表1。
以拮抗菌SW-W8基因组DNA为模板进行PCR扩增,得到约650 bp的目的条带(图5),并进行回收纯化测序。经序列比对,该菌与GenBank中(登录号:FR819717.1)已知假丝酵母菌的ITS序列相似性达99%。结合形态特征和ITS序列分析,确定SW-W8为假丝酵母菌(Candidadiversa)。
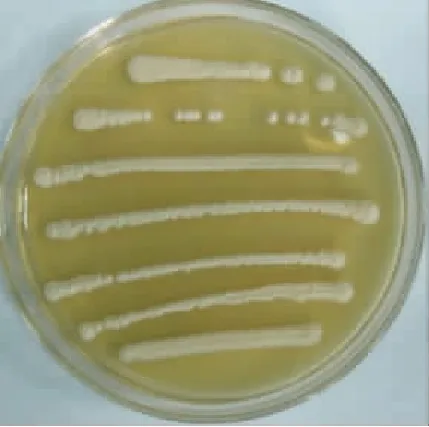
图4菌株 SW-W8的菌落形态
Table 1 Morphological characteristics of antagonistic SW-W8 strain
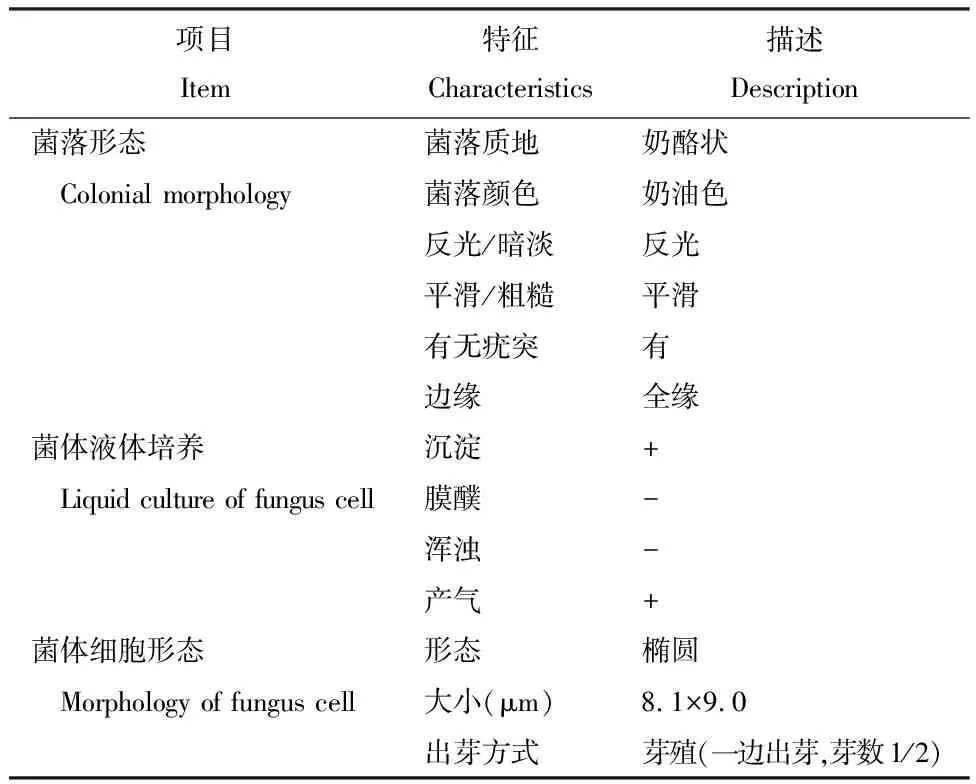
项目Item特征Characteristics描述Description菌落形态 菌落质地奶酪状 Colonial morphology菌落颜色奶油色反光/暗淡反光平滑/粗糙平滑有无疣突有边缘全缘菌体液体培养 沉淀+ Liquid culture of fungus cell膜醭-浑浊-产气+菌体细胞形态 形态椭圆 Morphology of fungus cell大小(μm)8.1×9.0出芽方式芽殖(一边出芽,芽数1/2)
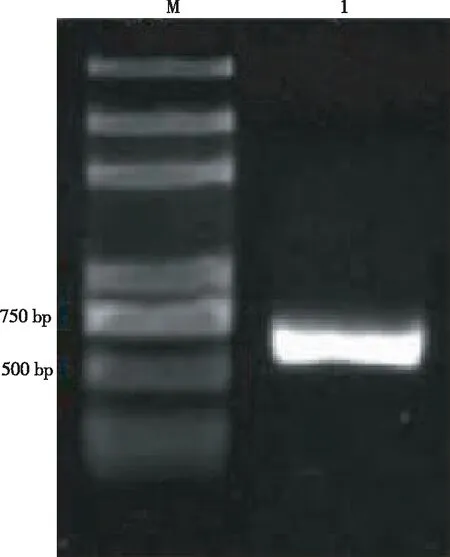
注:M为2 kb DNA Maker,1为拮抗菌。
Note: M. 2 kb DNA Marker; 1. Antagonistic SW-W8.
图5拮抗菌SW-W8的ITS扩增电泳图谱
Fig.5 ITS amplification electrophoretogram of antagonistic SW-W8 strain
3小结
利用生防菌防治植物真菌病害是当今研究的热点之一,相较于化学农药而言,既经济有效,又绿色环保。土壤是众多微生物的聚集地,从中可以筛选出大量有益拮抗菌,经过高温处理能生存的拮抗菌具有一定的抗逆性[6]。本研究从红提葡萄病果上分离出1株病原菌JD2016-8,根据ITS序列分析和菌株形态特征,鉴定为灰葡萄孢菌(Botrytiscinerea)。以JD2016-8为指示菌,从土壤中筛选到1株作用明显的拮抗菌SW-W8,鉴定为假丝酵母菌(Candidadiversa)。
目前,在生物防治研究中细菌已是较为常用的生防菌,其中枯草芽孢杆菌和解淀粉芽孢杆菌是较为常用的生防菌[7-11],但具有拮抗抑菌作用的真菌较少,有待从大自然丰富的微生物宝库中筛选出更多具有拮抗作用的菌株。拮抗酵母菌SW-W8的发酵条件、红提葡萄利用拮抗菌SW-W8的生物保鲜效果,以及对其他植物灰霉病的生物拮抗防治效果未开展试验,有待进一步研究,为利用拮抗菌进行生物防治奠定基础。

