JAK2 V617F、DNMT3A、NPM1和FLT3-ITD基因突变与骨髓增殖性肿瘤预后的相关性分析*
张叶华 郭素丽*
骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)多能造血干细胞或祖细胞以一系或多系分化相对成熟的骨髓细胞克隆性增殖异常为特点的一组异质性疾病[1]。临床主要以“脾大”为主要体征,以血细胞异常增多且在细胞形态与功能上接近正常细胞为主要血液学特征。2008年,世界卫生组织(World Health Organization,WHO)将慢性髓性肿瘤增殖区分为真性红细胞增多症(polycythemia vera,PV)、原发性血小板增多症(essential thrombocytosis,ET)、慢性髓细胞白血病(chronic myelocytic leukemia,CML)以及原发性骨髓纤维化(primary myelofibrosis,PMF)等多种亚型,并更名为“MPN”,以强调其是一种恶性克隆性疾病。
近年来,随着基因下一代测序(next generation sequencing,NGS)技术进入临床应用,已发现MPN患者存在多种不同基因突变。目前,JAK2 V617F是在MPN患者各亚型中检出突变率较高的基因,PV患者中突变率达97%~99%,在ET及PMF患者中达80%~90%,对于MPN患者具有较为显著的相对特异性,WHO已将之列为常规基因突变检查[2]。此外,近年来也相继发现MPN患者还存在较少见DNMT3A突变,NPM1和FLT3-ITD基因突变等。ET、PMF及CML等亚型可能均为PV的变异病型[3-4]。在疾病转归的相互依赖关系以及对于预后的影响,尚缺乏更多的相关研究报道予以支持。本研究回顾性分析80例MPN患者的基因突变谱情况,旨在探讨JAK2 V617F、DNMT3A、NPM和FLT3-ITD基因突变与MPN患者预后的相关性。
1 资料与方法
1.1 一般资料
选取2015年3月至2017年3月邢台市人民医院收治的80例MPN患者,其中男性48例,女性32例,年龄26~52岁,平均年龄(55.48±12.52)岁,依据WHO诊断与分类标准(2008版本),患者在初诊时均获得明确诊断,其中PV为19例,ET为31例,PMF为18例,CML为12例。根据核型分析结果将80例患者分为预后良好组(36例)、中度风险组(22例)及不良风险组(22例)。
1.2 纳入与排除标准
(1)纳入标准:①所有患者经临床检查均为MPN;②患者最初治疗时肝肾功能未超过正常值上限1.5倍;③患者及家属均知情同意且签署知情同意书。
(2)排除标准:①凡合并有其他血液系统疾病或既往有过MPN相关性治疗史的患者;②患者合并重要脏器、眼中出血和血栓危及生命者。
1.3 血液学检查
所有患者均行血液学检查,凡合并有其他血液系统疾病或既往有过MPN相关性治疗史的患者均予以排除。对所有患者骨髓及外周血标本均行NGS测序以及对所有患者均行细胞遗传学检查、染色体核型分析等。
1.4 基因检测
利用NGS对与MPN发病常见的18个相关基因进行靶向测序,分别为FLT3-ITD、KIT、JAK2、NRAS、KRAS、MPL、CBL、NPM1、RUNX1、LNK、WT1、TP53、DNMT3A、IDH1、IDH2、TET2、SRSF2、U2AF1。
骨髓或外周血基因分析使用美国Thermo Fisher Scientific公司研发的Ion Torrent PGM平台进行。靶基因扩增引物设计采用美国Life Technologies公司研发的Ion AmpliSeq Designer软件,确定聚合酶链反应(polymerase chain reaction,PCR)的具体反应条件及NGS测序步骤。采用美国Invitrogen公司生产的QIAamp DNAKit提取DNA。每份标本提取20 ng的DNA用于NGS检测。进行测序的PGM测序仪购于美国Life Technologies公司,测序覆盖率评估使用美国Thermo Fisher Scientific公司研发的Coverage Analysis软件(版本3.2.1),原始序列读数鉴定采用美国Broad Institute研究所生产的Integrative Genomics Viewer软件进行。确定基因变异参考公共数据库[COSMIC(http://cancer.sanger.ac.uk/cosmic/)和dbSNP(http://www.ncbi.nlm.nih.gov/SNP/)]。
1.5 MPN患者细胞遗传学分析
采用染色体核型分析和荧光原位杂交(fluorescence in situ hybridization,FISH)技术进行MPN患者细胞遗传学分析。
(1)染色体核型分析。收集MPN患者外周血或骨髓抽吸/活检标本80例,均使用常规R显带技术,参照标准细胞遗传学核型分析,检查分裂中期细胞≥20个。
(2)FISH技术分析。采用5q EGR1(5q31)、D7S486(7q31)、CEP 8(SA)、D20S108(20q12)、MLL(11q23)break-apart和TP53(17p13.1)探针组合进行FISH技术分析。
1.6 统计学方法
使用SPSS 19.0软件对数据进行统计处理。对分类变量比较行x2检验。患者生存期分析根据Kaplan-Meier生存曲线进行,总体生存期从初诊第1 d开始计算,直到死亡(任何原因)或最终随访结束为止。以P<0.05为差异有统计学意义。
2 结果
2.1 各亚型之间检测项目两两比较
各检测项目不同亚型之间两两比较,差异均有统计学意义(t=9.168,t=10.273,t=8.532,t=9.065;P<0.05)。见表1。
表1 MPN患者各亚型血液学检测项目比较(±s)
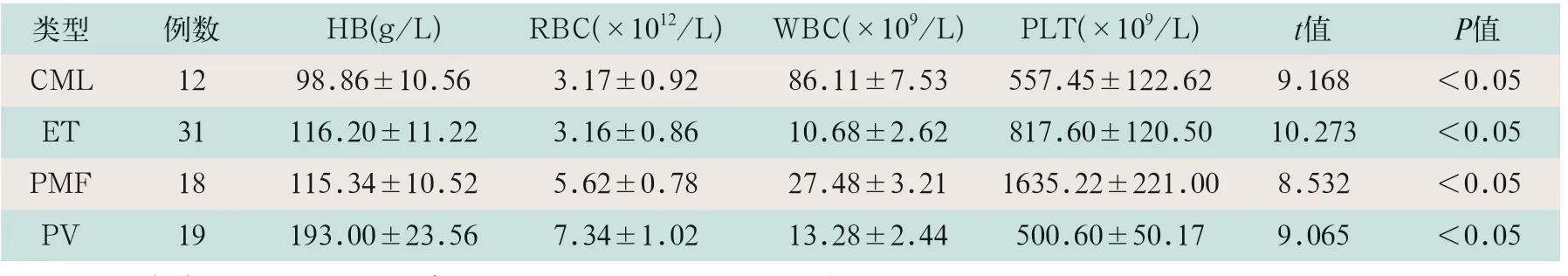
表1 MPN患者各亚型血液学检测项目比较(±s)
注:表中PV为真性红细胞增多症;ET为原发性血小板增多症;PMF为原发性骨髓纤维化;CML为慢性髓细胞白血病;HB为血红蛋白;RBC为红细胞;WBC为白细胞;PLT为血小板。
类型 例数 HB(g/L) RBC(×1012/L) WBC(×109/L) PLT(×109/L) t值 P值CML 12 98.86±10.56 3.17±0.92 86.11±7.53 557.45±122.62 9.168 <0.05 ET 31 116.20±11.22 3.16±0.86 10.68±2.62 817.60±120.50 10.273 <0.05 PMF 18 115.34±10.52 5.62±0.78 27.48±3.21 1635.22±221.00 8.532 <0.05 PV 19 193.00±23.56 7.34±1.02 13.28±2.44 500.60±50.17 9.065 <0.05
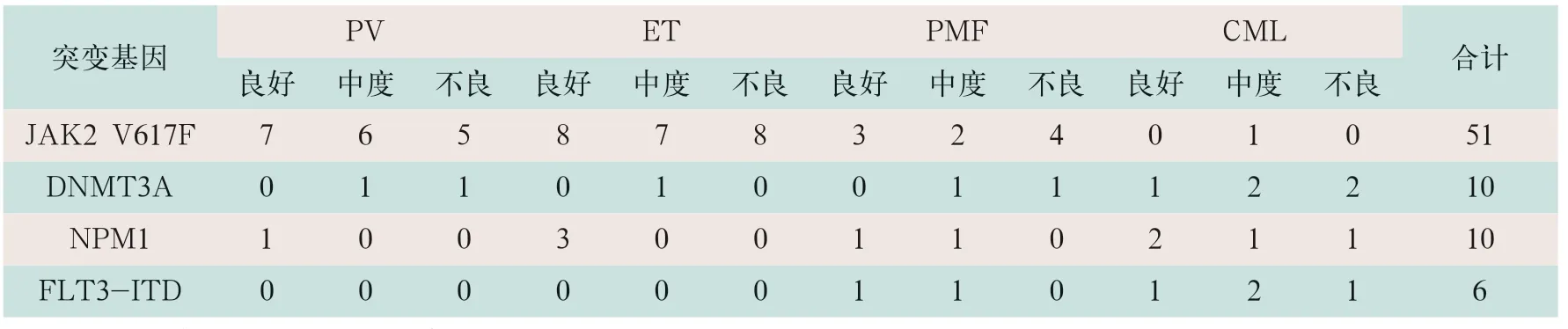
表2 MPN患者各亚型全基因组首次检测结果(例)
2.2 染色体核型分析
染色体核型分析结果为:①19例PV患者中12例正常核型,7例异常核型,异常核型主要为+8、+9、del(20 q)、del(13 q)及del(9 q),其中1例+8和+9同时存在;②31例ET患者中28例正常核型,3例异常核型,异常核型为+8、9 q和20 q-等;③18例PMF患者中5例异常核型,13例正常核型,异常核型除5例为异常核型外,其余均为正常核型,异常核型为del(13)(q12-22)、der(6)t(1;6)(q21-23;p21,3)、del(20 q)、+1q、+8及+9等;④12例CML患者中5例正常核型,5例异常核型,异常核型为50,XY,+3,add(6)(p23),+add(6)(p23),+9,+21(5)/46,XY,+8,+9(3)/46,xy(7);Ph染色体异位,核型为46,XY(XX),t(9:22)(q34:q11),复杂核型的Ph染色体2例,核型为46,XX,t(9:22:11)(q34:q11:q14)。
三组主要核型均包括有正常核型与异常核型,其中不良风险组还包括复杂核型的Ph染色体2例,核型为46,XX,t(9:22:11)(q34:q11:q14)。
2.3 R显带技术及NGS检测情况
在三组MPN患者中,预后良好组的26例患者PV、ET、PMF及CML各8例、12例、4例和2例;中度风险组32例患者PV、ET、PMF及CML各4例、17例、6例和5例;不良风险组22例患者PV、ET、PMF及CML各7例、6例、4例、5例。
排除阳性,随访中末次从阴性中检测到阳性结果。采用NGS技术对MPN初诊患者与MPN发病相关的18种基因靶向测序,80例患者检出JAK2 V617F突变阳性61例,突变率为76.25%,主要见之于PV、ET及PMF亚型患者中,突变率分别为89.47%、74.19%和50%;在CML中检出1例,突变率为8.33%。检出DNMT3A突变阳性10例,突变率为12.5%,但主要分布于CML患者中,检出NPM1突变阳性10例,突变率为12.5%,检出FLT3-ITD突变阳性6例,突变率为7.5%,主要分布于CML患者中。各相关基因的检出情况及相关基因变异在各风险组中的分布情况见表2。
2.4 MPN患者基因突变谱分析
采用NGS靶向测序,80例MPN患者中,最少发生1个基因突变有73例,突变率为91.25%;多基因(≥2)突变有49例,突变率为61.25%,在中等风险组中分布最高,发生18例,多基因突变率为81.81%。排除阳性,从阴性患者中再次采用NGS靶向测序,检测出JAK2 V617F突变、DNMT3A突变、NPM1突变与FLT3-ITD突变情况见表3。测序分析以NMP1为例,如图1、图2所示。
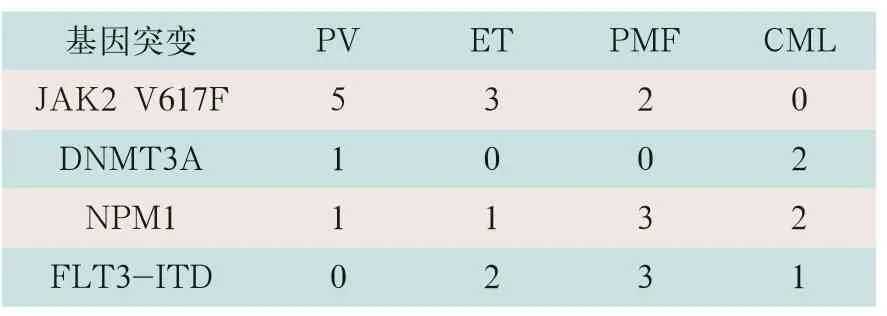
表3 排除阳性四种基因突变检测结果(例)

图1 直接测序筛选NPM1基因突变结果
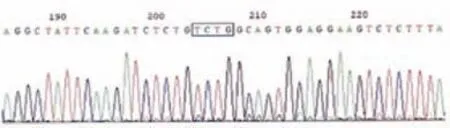
图2 NPM1基因A型突变克隆测序结果

表4 MPN病型变异在不同风险组中的分布
表5 四种基因突变阳性组与阴性组总生存期比较(±s)
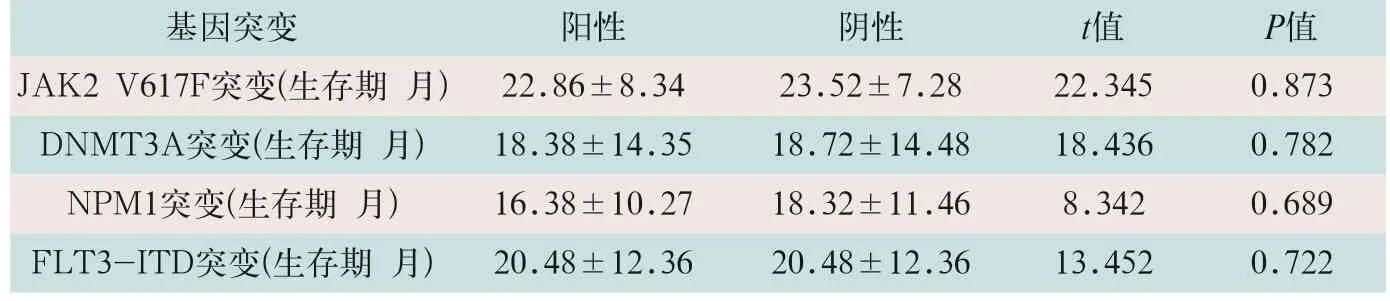
表5 四种基因突变阳性组与阴性组总生存期比较(±s)
基因突变 阳性 阴性 t值 P值JAK2 V617F突变(生存期 月) 22.86±8.34 23.52±7.28 22.345 0.873 DNMT3A突变(生存期 月) 18.38±14.35 18.72±14.48 18.436 0.782 NPM1突变(生存期 月) 16.38±10.27 18.32±11.46 8.342 0.689 FLT3-ITD突变(生存期 月) 20.48±12.36 20.48±12.36 13.452 0.722
2.5 基因突变与疾病转归之间的关系
80例MPN患者基因突变与疾病转归之间的关系:①19例PV患者中转为ET的2例(占10.52%),转为PMF的2例(占10.52%);②31例ET患者中转为PMF的3例(占0.09%);③18例PMF患者中转为CML的3例(占16.67%),另有1例转为急性白血病。对上述病例检测出基因突变情况及在不同风险组中的分布见表4。
2.6 JAK2 V617F突变、DNMT3A突变、NPM1突变与FLT3-ITD突变与MPN患者总生存期的关系
80例患者均获3年随访,JAK2 V617F突变、DNMT3A突变、NPM1突变与FLT3-ITD突变阳性与阴性总体生存期比较,差异均无统计学意义(t=22.345,t=18.436,t=8.342,t=13.452;P>0.05),与MPN预后无明显相关性(见表5)。
Kaplan-Meier生存曲线分析结果显示,在MPN亚型PMF病例中,JAK2 V617F突变阳性+NPM1突变阳性患者,中位生存期明显短于阴性,差异有统计学意义(t=11.086,P<0.05),提示预后不良。与单独阳性组、单独阴性组及双阴性组比较,差异均有统计学意义(t=9.637,P<0.05),患者多预后不良。在CML中度风险组患者中,FLT3-ITD突变阳性+DNMT3A突变组的总生存期明显短于FLT3-ITD突变阴性组和FLT3-ITD突变阳性+DNMT3A野生型。因此,AML患者是否同时发生DNMT3A突变能够显著改变FLT3-ITD的预后效应。
3 讨论
MPN是造血干细胞或祖细胞在向一系或多系分化过程中导致血细胞异常增殖的一组异质恶性克隆性疾病,主要包括PV、ET、PMF以及CML等几种亚型。在MPN的疾病进程中,可发展为骨髓纤维化,并最终进展为白血病[6]。患者生存期范围较广,从短至数月至数年,甚至20年以上。MPN的预后因素较为复杂,包括病型、年龄、性别、细胞遗传学、染色体核型、基因突变等多种因素。
近年来,随着全基因组测序进入临床使用,发现与MPN发病相关的基因已越来越多。基因突变不仅是MPN在不同阶段病情进展的标志,还可能是MPN预后的重要标志[7]。目前,除已发现JAK2 V617F是MPN患者存在较高突变频率的基因,DNMT3A、NPM1及FLT3-ITD也是MPN较为重要的常见基因。但以往临床研究较多集中于对基因突变的随机事件报道,可能存在的联系以及与MPN预后的相关性。马娟等[8]研究显示,MPN中亚型ET和PMF均为PV的变异病型,各亚型是否为同一种疾病的不同发展阶段,不同的基因突变事件是否在MPN的病型变异发展中存在联系,可能均为在评估预后上需要重点考虑的因素。
本组研究中,采用NGS靶向测序技术,从MPN的基因突变谱分析其结果显示,80例患者中有73例最少可检测到1个基因突变,占91.25%,有49例检测到最少有2个以上的多基因突变,占61.25%。提示基因突变≥2模式为MPN患者基因突变的主要模式。其中,JAK2 V617F突变率最高,主要见之于PV、ET、PMF等亚型,与以往报道相符[8]。但DNMT3A、NPM1及FLT3-ITD在MPN中只存在较低的基因突变率,主要出现在CML患者中。而进一步分析表明,JAK2 V617F、DNMT3A、NPM1及FLT3-ITD突变在MPN患者的阳性与阴性总生存期比较,差异均无统计学意义,与MPN预后并无明显相关性。但进一步对MPN亚型展开分析,在JAK2 V617F阳性的ET和PMF患者中,转为白血病的几率较高,患者生存期均较短,而在JAK2 V617F阴性的中度风险组的CML患者中,FLT3-ITD同时伴NPM1或DNMT3A基因突变,会带来不同的预后结果。FLT3-ITD同时伴NPM1基因突变,多提示预后不良,与以往报道的NPM1阳性,预后良好的结论有所不同[9]。FLT3-ITD同时伴DNMT3A基因突变,能产生预后效应。
本研究通过分析MPN各亚型基因突变数据发现,JAK2 V617F、DNMT3A、NPM1及FLT3-ITD等基因突变均可能是MPN疾病进展阶段性的重要基因突变事件,能否产生预后效应,与其标志的MPN病情进展阶段及严重程度有关。这可能为JAK2 V617F、DNMT3A、NPM1及FLT3-ITD中任一单独基因突变,与MPN患者总体生存期的相关性表现并不明显的原因。基因突变并非孤立性事件,自JAK2 V617F基因突变发现后,已成为JAK2 V617F阳性MPN发生的病理基础[10]。JAK2突变可能为MPN发病的关键性基因,JAK2为JAK基因家族成员之一,编码位于胞浆的酪氨酸激酶组蛋白,而JAK家族是指导转录的重要基因,通过JAK-STAT途径参与细胞表面多种受体特别是多种细胞因子的信号传递。更为重要的是,多种细胞因子也均是通过这一途径参与对细胞增殖和分化调控,而其中的JAK2就与造血祖细胞多种高敏感性生长因子的信号转导有关,包括干细胞因子(SCF)、红细胞生成素(EPO)、以及血小板生成素(TPO)、粒细胞巨噬细胞刺激因子(GM-CSF)、白细胞介素3(L-3)等。而JAK2基因突变,造成基因功能性丧失或破坏,也可能会引起与之关系密切的编码其他生长因子的基因突变,最终导致各种异质性克隆性MPN亚型克隆性疾病发生。而JAK2高频率突变为JAK2 V617F突变,在MPN的亚型PV、ET及PFM患者中均检测到JAK2 V617F较高阳性发生率,究其原因,也可能在于JAK2 V617F突变引发与之相关的造血祖细胞的不同生长因子的正常功能不同程度受到影响,从而出现各种MPN亚型。DNMT3A是与甲基化有关的基因,调节转录沉默。马丽丽[11]研究证实,单独DNMT3A基因突变,并不足以导致白血病发生。而NPM1编码核质穿梭的核磷蛋白是保守基因,具有较好稳定性,在核糖体合成、维持基因稳定以及调控抑癌基因的活动性与稳定性等多种细胞生物活动过程,具有重要作用。FLT3-ITD基因是与造血因子有关的基因,通过编码酪氨酸激酶II系组蛋白,调控细胞增殖与生长[12]。鉴于DNMT3A与NPM1基因在细胞功能结构域中的重要地位与作用,DNMT3A和NPM1基因突变,可能表明DNA基因受累已在移向核心功能结构域,疾病已进展到严重阶段。上述3种基因突变在PV、ET及PMF患者中存在极低发生率或不能检测到阳性,可能与疾病还未进展到这一阶段有关。而在CML患者中,均能检测到上述3种基因突变阳性,可能与基因受累的严重程度有关,提示MPN可能已进展到相当严重程度,引发多种基因突变协同作用,最终促使白血病形成。而几乎临床上所有PV、ET、PMF等MPN亚型最终均能发展为白血病,也对此予以证实[13]。
本组研究中,多基因突变模式在中度风险组较为常见,但所导致的MPN严重程度可能还与是否引起位于细胞核心功能结构域的基因突变有关。在核心功能结构域的基因发生突变事件,对于功能系统的破坏程度可能是致命的。而在CML中度风险组患者中,检测出FLT3-ITD伴DNMT3或NPM1同时突变发生率较高,为40%,患者多预后不良,亦可证实位于核心功能结构域的多基因受累是导致患者预后不佳的原因。
王彦丽等[14]研究表明,MPN病型变异对于MPN原发病进展走向具有重要影响,与预后评估密切相关。有研究显示,ET和PMF均为PV的变异病型,可能为同一种疾病在不同发展阶段的表现,但缺乏足够的证据支持。虽然在MPN的亚型PV、ET及PMF能检测到较高发生率的JAK2 V617F阳性突变,但在CML患者中,并不能检测到JAK2 V617F阳性突变。以往研究较多集中于孤立基因突变的随机事件,很少涉及不同基因突变事件之间可能存在的联系,自JAK2 V617F、DNMT3A、NPM1以及FLT3-ITD基因突变在MPN患者中相继发现后,目前并无上述基因突变可能存在的相互影响,对MPN的变异病型是否为同一种疾病受基因突变事件相互影响所导致的在不同阶段的表现,缺乏进一步的深入了解。
本研究对于MPN各亚型的变异病型给予了在基因突变事件上可能存在的关联性上的数据分析,发现了11例原发MPN向其他亚型变异,发生率为13.75%。其中PV→ET2例;PV→PMF2例,ET→PMF3例,PMF→CML3例,此外,有1例为MPN激变期发展为急性白血病。发现3例CML变异病型均存在于JAK2 V617F阳性率较高的PMF患者中,且在原发病患者中均存在伴DNMT3或NPM1基因突变。证实了ET、PMF等亚型可能为PV的变异病型的结论。对上述病例均再次进行基因检测,3例NPM1阴性原发PMF病型变异为CML的患者,检测到NPM1突变阳性,1例原发PV检测到DNMT3A阳性,1例原发PV、3例原发ET,检测到FLT3-ITD阳性。提示,在原发病患者中阴性基因可能存在潜在突变风险,可能是导致病型变异的原因。
因此,JAK2 V617F突变、DNMT3A突变以及NPM1与FLT3-ITD突变是否具有预后效应,还要看与之相联系的基因突变事件对于MPN在疾病进程阶段及发展走向上的影响。本研究中,在CML中度风险组中,FLT3-ITD只有同时伴DNMT3A或NPM1突变,才能产生预后效应,多提示患者预后不良,而在JAK2 V617F突变阳性的PMF患者中,同时伴NPM1突变,多提示预后不良。异常核型出现的NPM1基因突变,在以往研究中认为是预后良好的标志基因,本研究认为可能只是对于病理损伤的基因突变在自我修复过程中出现的防御性反应结果。而在正常核型的NPM1突变,则可能是NPM1基因严重受累所导致的异常,往往提示基因病理损伤已在向核心功能结构域转移。
由于本研究并未检测JAK2在其他位点的基因突变,如第12号外显子突变,以及近年来发现的基因JAK2 V617F阴性患者存在的MPL基因突变,也可能是导致MPN的发病基因,对于NPM1亦只检测了第12号外显子突变情况,基因突变可能存在多个位点突变,对于未知基因以及其他位点的基因突变未予以考虑,导致相关基因未能检测到,这也是本研究的局限之处。对于在CML患者中未能检测到JAK2 V617F突变,是否存在另外位点或未知基因突变,亦不能加以说明,因此,对于JAK2 V617F、DNMT3A、NPM1和FLT3-ITD在MPN患者中的预后价值,尚需临床上进一步研究予以证实。

