肾综合征出血热诊疗陕西省专家共识
陕西省卫生健康委员会(西安 710003);空军军医大学唐都医院(西安710038)
为规范肾综合征出血热的预防、诊断和治疗,根据本病临床特征和国内外重要文献,2016年开始编写,经过专家组反复讨论修改,于2018年3月发布《肾综合征出血热诊疗陕西省专家共识》(共识缩略词中英文对照见表1)。专家组由临床、基础和预防工作方面的专家组成,包括陕西省和部分其他省市的专家。
肾综合征出血热是一种世界范围内广泛分布的自然疫源性疾病,危害严重,已成为一个全球关注的公共卫生问题[1-4]。中国是全世界受肾综合征出血热危害最为严重的国家[5],陕西省特别是关中地区为该病的高发区。肾综合征出血热的预防和控制需要政府、社会、学术团体、医疗卫生单位等的共同努力。
本共识旨在为医疗和防疫人员提供操作性较强的意见和建议,但不是强制性标准。本共识主要针对成人患者,儿童、老年人、妊娠期妇女等特殊人群可参照成人患者诊疗原则,根据人群特点进行个体化处理。本共识主要针对常见共性问题提供推荐意见,未能涵盖肾综合征出血热防治过程中的所有问题。因此,临床医生在面对具体患者时,需要结合专业知识和当时的医疗资源等具体情况,制定符合实际的合理诊疗方案。
我们将根据国内外的临床实践经验和最新研究进展,不断更新和完善本共识。
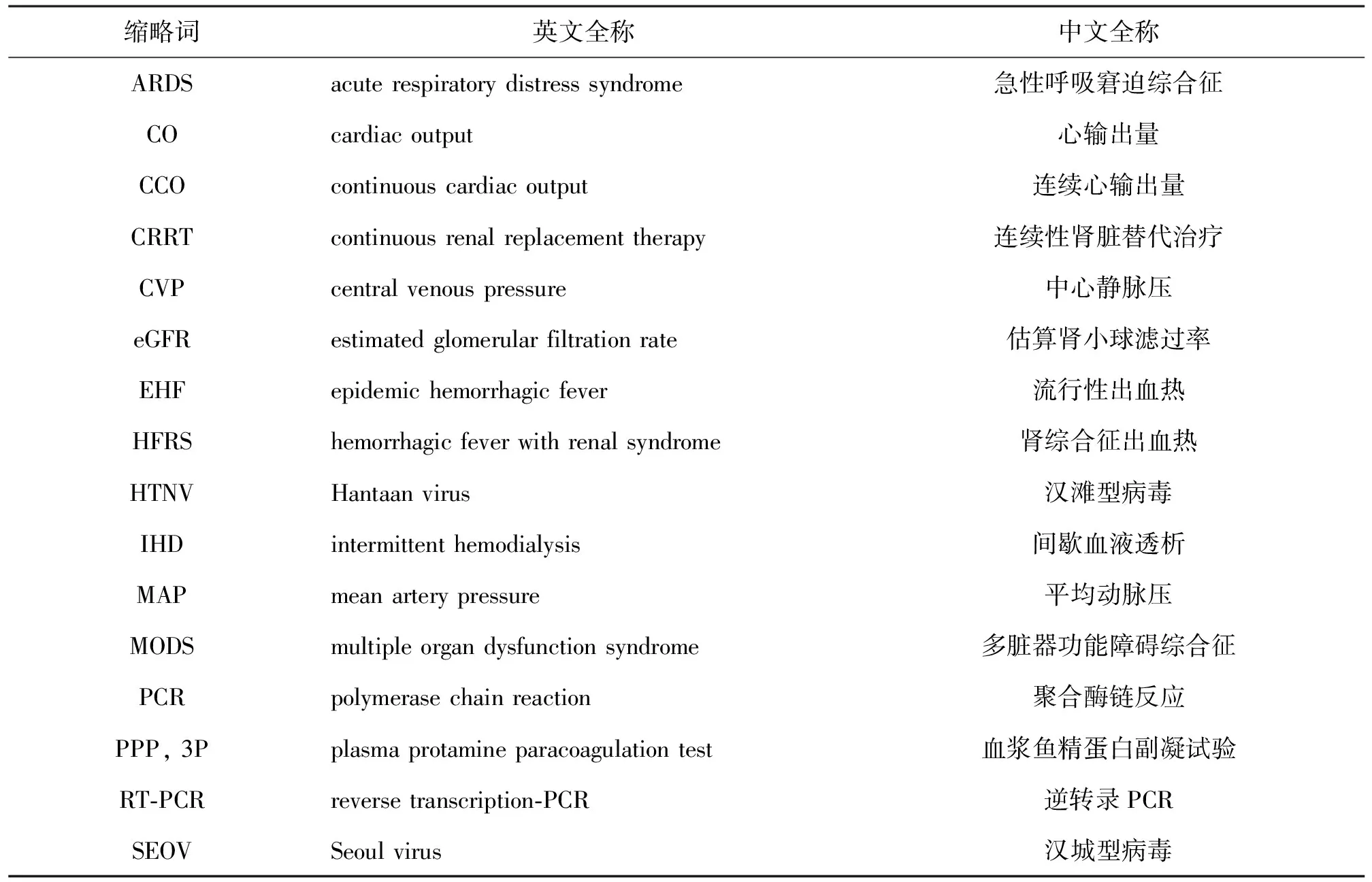
表1 缩略词中英文对照表
肾综合征出血热(Hemorrhagic fever with renal syndrome,HFRS)也称流行性出血热(Epidemic hemorrhagic fever,EHF),是由汉坦病毒科正汉坦病毒属病毒引起的,以啮齿类动物为主要传染源的自然疫源性疾病。本病的主要临床特征为发热、渗出、出血、低血压休克及肾脏损害。
1 病原学
正汉坦病毒属于布尼亚病毒目汉坦病毒科,为单股负链RNA病毒,形态呈圆形或卵圆形,有脂质外膜,膜上有纤维突起。病毒平均直径80~120 nm[6]。基因组RNA分为大、中、小三个片段,即L、M和S。L基因编码聚合酶;M基因编码膜蛋白,分为GN和GC糖蛋白,GN和GC镶嵌于病毒的包膜[7];S基因编码核衣壳蛋白,核衣壳蛋白与病毒基因组成病毒核心。
正汉坦病毒的核衣壳蛋白有较强的免疫原性和稳定的抗原决定簇,宿主感染后核衣壳蛋白抗体出现最早,在病程第2~3天即能检出,有助于早期诊断[8]。一般认为核衣壳蛋白中含补体结合抗原,而不含中和抗原;糖蛋白含有中和抗原。
现已发现正汉坦病毒有约24个血清型。正汉坦病毒是古老病毒,几乎与自然宿主鼠类共进化,不同鼠类携带不同血清型病毒,所致疾病临床表现和轻重程度也不相同[9]。汉滩型病毒(Hantaan virus, HTNV)也称为I型或野鼠型,主要为野外黑线姬鼠携带,引起的HFRS病情较重[10];汉城型病毒(Seoul virus, SEOV)也称为II型或家鼠型,主要为褐家鼠携带,引起的HFRS病情相对较轻。近年来,我国也发现了III型正汉坦病毒,即普马拉病毒,但临床意义小,至今未确认临床病例。我国主要存在I型、II型和混合型三种疫区,陕西省属于I型病毒感染为绝对优势的HFRS混合型疫区[11]。
2 流行病学和预防
根据国家卫生健康委员会统计数据,自1950年以来中国已报告超过1650,000例患者,其中死亡病例超过47,000人,总病死率约2.89%[2]。除青海和新疆外,全国大部分省市自治区都有HFRS流行,其中以东北、华北地区和陕西省流行最为严重,黑龙江、山东、辽宁、陕西、河北、吉林、湖南、江西、广东、福建等省发病人数占全国发病人数的80%以上[5,12]。2004-2015年,陕西省和东北三省是全国HFRS的重灾区[13]。根据陕西省疾病预防控制中心统计数据,2015年、2016年和2017年,陕西省分别报告出血热病例1388例、960例和2001例,分别占当年全国总病例数的13%、10%和17%。HFRS在陕西省各市均有发病,高发县区主要集中在关中地区[14]。HFRS全年各月均有发病,呈春季和秋冬季两个发病高峰。患者男女比例约为3∶1,以青壮年男性为主,职业以农民为主[15-16]。近年来,HFRS人群有向<15岁和>60岁人群转移的趋势[17]。
有大约170多种脊椎动物能自然感染汉坦病毒,我国发现50余种动物携带本病毒,主要宿主动物是啮齿类动物,其他动物包括猫、猪、犬、兔和蝙蝠[3]。我国以黑线姬鼠、褐家鼠为主要宿主动物和传染源,林区以大林姬鼠为主。鼠类携带病毒的排泄物,如尿、粪、唾液等污染环境后形成尘埃或气溶胶,主要通过呼吸道感染人体。此外,也可通过消化道、接触、虫媒传播。孕妇感染后,病毒可经胎盘感染胎儿[18]。人群普遍易感,在流行区隐性感染率可达3.5%~33%[19]。近年来,我国HFRS的总体发病率略有下降趋势,但全国监测点鼠密度/带毒率一直维持在较高水平,HFRS暴发可能性依然存在,部分地区疫情呈上升态势。HFRS的预防主要以开展预防接种为主[20],提高HFRS疫苗接种率,可有效控制发病,是预防HFRS的一项重要措施[21],同时需动员社会力量科学防鼠灭鼠。
一般认为,HFRS显性感染后能形成抗汉坦病毒IgG抗体,血清抗体滴度保持较高水平,可获得持久免疫[22]。尽管抗汉坦病毒IgG抗体水平每10年衰降25%左右,但仍处于接种人群2倍以上的高位水平,衰降幅度不足以影响人体对汉坦病毒的免疫力[19]。20世纪90年代起,一种包含2个血清型汉坦病毒的灭活疫苗在我国临床试用,包括汉滩型和汉城型毒株,是目前使用的主要疫苗[23]。接种程序分为基础免疫和强化免疫,基础免疫2剂次(第0、14天),强化免疫在6个月后或1年后加强1剂[17]。HFRS双价疫苗具有良好的免疫原性,基础免疫2剂后即可获得很高的中和抗体(姬鼠型100%,家鼠型84.21%)和荧光抗体(94.74%)阳转率[24]。完成基础免疫后可获得较高抗体水平[25],接种5年后抗体下降明显,末次接种5~10年下降40%,10~20年下降60%以上[19]。有研究报道[26],接种HFRS疫苗7~8年后保护率下降到90%以下,在末次接种后7~8年有必要再加强1剂次[19,27]。
推荐意见1:加强HFRS疫区、新开发区的灭鼠与防鼠。田间劳作、清整杂草秸秆和野外活动时加强个人防护。预防吸入鼠类排泄污染物和鼠体寄生虫叮咬。
推荐意见2:建议HFRS疫区居民和外来人口的适龄人群接种出血热疫苗。
3 发病机制与病理生理
HFRS是一种严重的全身炎症反应性疾病,血管内皮受损导致的血管通透性增加和出血是该病最基本的病理生理变化,是该病发生发展过程与临床表现的基础[28-30]。
汉坦病毒进入人体随血液到达全身,在血管内皮细胞、骨髓、肝、脾、肺和淋巴结等组织中增殖后再次释放入血引起病毒血症。HFRS早期患者血中可检出汉坦病毒RNA,且汉坦病毒RNA载量与病情严重程度相关[31]。HFRS患者几乎所有脏器组织中均能检出汉坦病毒抗原。
汉坦病毒可直接破坏受感染细胞的功能和结构[32]。汉坦病毒诱发固有免疫反应和适应性免疫反应,B细胞和T细胞反应以及多种细胞因子、炎症因子都参与了病理生理过程[33-34]。炎症因子风暴在重症患者的发病中发挥了重要作用。补体和NK细胞也参与了发病过程[35-36]。
小血管内皮损伤导致血管壁的通透性增加,从而引起血管渗漏、血浆外渗,产生组织水肿、疼痛、血液浓缩、低血压、休克等表现[2,30]。肾小球和肾小管直接损伤以及低血压休克造成的继发性损害是该病肾脏损伤的主要原因。
4 临床表现
本病潜伏期4~46 d,一般为7~14 d。HFRS典型临床表现是发热、渗出水肿、充血出血和肾脏损害,多有发热期、低血压休克期、少尿期、多尿期和恢复期五期经过。轻型或早期及时治疗的患者可无低血压休克和明显出血或肾脏损害,甚至无少尿期,即所谓越期,五期经过不明显。少数患者可有发热、低血压休克和少尿三期重叠,此类患者往往病情危重,病死率高。
4.1 发热期 急性起病,主要表现为感染中毒症状、毛细血管损伤及肾脏损伤相应的症状和体征。
4.1.1 感染中毒症状:发热为本病早期常见症状,典型病例有畏寒、寒战、高热,体温多在38 ℃~40 ℃之间,热型多为弛张热、稽留热或不规则热,一般持续4~6 d。大部分患者伴头痛、腰痛、眼眶痛(三痛)、全身肌肉关节酸痛,部分患者伴消化道症状,如食欲不振、恶心、呕吐、腹痛或稀水样便。少数患者腹痛剧烈,伴腹肌紧张、压痛及反跳痛等急腹症表现;重危患者可出现兴奋、谵妄、烦躁不安、嗜睡和昏迷等神经精神症状。上述伴随症状亦与组织渗出水肿和细胞损伤有关。
4.1.2 充血和出血:于第2~3病日起,患者可出现眼球结膜及颜面部、颈部和上胸部皮肤充血潮红(三红),似酒醉貌。黏膜出血多见于软腭、悬雍垂及咽后壁,表现为网状、点状或斑片状出血。眼球结合膜也可见点状或斑片状出血。皮肤出血好发于双侧腋下、前胸和肩背部,多为出血点或搔抓样、条索样出血斑点,针刺部位也可见到瘀斑。患者早期毛细血管脆性试验(束臂试验)可呈阳性。重症患者有鼻衄、咯血、呕血、便血、血尿、脑出血等。
4.1.3 渗出与水肿:渗出与水肿是全身性的,组织疏松部位表现更加突出,浅表组织和器官容易发现。眼球结合膜水肿为本病早期特征性表现,依据水肿程度分为3度。轻度水肿:检查者用拇、食指挤压上、下眼睑时,可在内眦或外眦见到涟漪状波纹或皱褶;中度水肿:睁眼时,外观可见明显水肿;高度水肿: 隆起的球结合膜呈胶冻样或鲜荔枝肉样,突出于眼裂平面。球结合膜水肿是重要体征,有助于HFRS诊断,其严重程度直接反映了血管损害和血浆外渗的程度。此期患者常伴有眼睑和颜面部水肿,甚至出现渗出性腹水、胸水和心包积液。
4.1.4 肾脏损伤:表现为蛋白尿、血尿和尿量减少。早期尿蛋白为“+~”,重症患者可达“~”,尿中可见膜状物,镜检可出现透明管型、颗粒管型或蜡样管型。大部分患者有肾区叩击痛。部分患者可有黄疸、肝脾肿大和肝功能异常[37]。发热期一般持续4~6 d,少数患者可超过10 d,但是几乎无超过2周者,个别患者发热期可短于3 d。发热4~6病日后,体温下降,但其他症状反而加重。通常临床病情轻重与此期的体温高低成正比,即体温越高,热程越长,病情越重。
4.2 低血压休克期 发病第3~7病日(大多数在第4~6病日),患者出现低血压或休克,持续时间数小时至数日不等。低血压休克主要表现为:①血压下降,心率、脉搏增快。成人收缩压较基础血压下降超过40 mmHg或低于年龄段正常值的2个标准差。根据血压和脉压差水平分为低血压倾向、低血压和休克,其动脉收缩压分别≤100 mmHg(13.3 kPa)、≤90 mmHg(12.0 kPa)和≤70 mmHg(9.3 kPa);平均动脉压[MAP,MAP=(收缩压+2×舒张压)/3或舒张压+1/3脉压差,正常值为70~105 mmHg]分别≤70 mmHg、≤60 mmHg和≤50 mmHg。儿童休克参考标准:1~12月龄儿童收缩压<70 mmHg;1~10岁儿童收缩压<70 mmHg+(年龄×2);>10岁儿童收缩压<90 mmHg。心率增快,脉搏细速或扪不清,浅表静脉塌陷,伴呼吸浅快。②面色与口唇苍白或发绀,肢端发凉,皮肤发花。③烦躁不安,继之可出现谵妄、嗜睡、昏睡、昏迷。④少尿或无尿。⑤中心静脉压(CVP)降低[<6 mmHg(0.8 kPa)]。
此期患者的渗出体征特别突出,出血倾向明显,可合并DIC。多数患者低血压休克期不超过24 h,少数患者血压降低或不稳定可长达72 h以上。休克出现越早,持续时间越长,病情越重。
部分患者经充分扩容及其他方法抗休克治疗,休克不能逆转,成为难治性休克,表现为:①血压测不出或休克持续2 h以上;②伴有至少一个重要脏器/系统功能衰竭,如心脏、呼吸、脑、肾、肝衰竭或凝血系统功能障碍;③休克重复发生。难治性休克预后极差,是HFRS死亡的主要原因之一。
4.3 少尿期 少尿期与低血压休克期常无明显界限,两期也可重叠发生或完全缺失。轻型患者常无休克和少尿期。本期一般出现于第5~8病日,持续时间约2~5 d,长者可达2周以上。本病少尿期的主要表现类似于其他病因所致的急性肾衰竭,但高血容量综合征和出血更为突出,而代谢性酸中毒及低钾多不严重。
4.3.1 少尿或无尿和氮质血症:少尿或无尿为本病急性肾衰竭最突出的表现。24h尿量少于400 ml为少尿(儿童少尿标准:婴幼儿<200 ml/d;学龄前<300 ml/d;学龄期<400 ml/d),少于100 ml为无尿(儿童<30~50 ml/d)。少数患者有明显的氮质血症,但尿量无明显减少,可称为“非少尿型肾衰”。
急性肾衰竭主要表现为不同程度的尿毒症、酸中毒、水中毒和电解质平衡失调。临床可见厌食、恶心、呕吐、腹胀、口干舌燥、舌苔厚等,可出现顽固性呃逆,查体可见面部和下肢水肿,部分患者可伴肺水肿、胸水和腹水。此外检测血尿素氮和肌酐多明显升高。
4.3.2 肾性脑病:严重氮质血症可出现头昏、头痛、嗜睡、烦躁、谵妄、甚至抽搐、昏迷。可出现锥体束征、踝阵挛和扑翼样震颤等体征。
4.3.3 出血和贫血:本期皮肤、黏膜出血常常加重,重者可伴有呕血、咯血、便血和血尿。少尿期持续超过1周的患者多有轻重不等的贫血。
4.3.4 高血容量综合征:高血容量综合征在本病患者出现率较高,休克期输入液体过多的患者更易出现。临床表现为颜面部肿胀、体表静脉充盈怒张、脉搏洪大、血压增高、脉压差增大、心音亢进及血液稀释,严重者易合并心力衰竭、肺水肿及脑水肿。
4.3.5 电解质和酸碱平衡失衡:本病少尿期可合并代谢性酸中毒和高血钾,但程度多较轻,低血钠较多见。严重酸中毒患者可出现嗜睡、昏迷及Kussmul氏呼吸或潮式呼吸,引起心缩无力和血压下降,检测血气可见碱剩余<-3 mmol/L,甚至低于-15 mmol/L,血pH低于7.35。
4.3.6 高血压:少尿期超过1周者易合并不同程度的高血压。
4.3.7 急进型肾衰或重症尿毒症患者极易出现多种并发症,如大出血(包括肾破裂出血、脑出血、肺出血、消化道出血、穿刺部位大出血等),肺水肿和急性呼吸窘迫综合征(Acute respiratory distress syndrome, ARDS),意识障碍等严重中枢神经系统损害,血糖等内环境严重失调,严重感染和心力衰竭等。
4.4 多尿期 少尿后期尿量逐渐增多,进入多尿期。未使用利尿剂的情况下,24 h尿量400~2000 ml,称为移行阶段。24 h尿量>2000 ml,称为多尿早期。每日尿量超过3000 ml,称为多尿后期,此期患者24 h尿量可达5000~10000 ml,少数可达15000 ml(儿童24h尿量超过400 ml/m2以上即进入多尿期)。本期多出现于第9~14病日,大多持续1~2周,少数可长达数月之久。轻症患者可无低血压休克和少尿期而直接进入多尿期,称之为越期。
移行阶段和多尿早期的临床表现同少尿期,易出现并发症,随尿量增多,肾功能恢复,尿毒症及其相关并发症逐渐减轻。大量排尿如不及时补充水和电解质易发生脱水、低血钾和低血钠,甚至发生二次休克(失水性休克)而引起继发性肾衰竭,重者可危及生命;极少数患者可发生高钠,甚至高渗性意识障碍。
4.5 恢复期 多数患者病后第3~4周开始恢复。24 h尿量<2000 ml(儿童24 h尿量恢复到400 ml/m2以下)且BUN和Cr接近正常为进入恢复期的标志。此期肾脏功能渐好转,精神、食欲和体力亦逐渐恢复。恢复期通常1~3月,少数重症患者恢复时间较长,但是很少超过6个月。恢复期患者仍感全身不适、无力、头晕、头痛、食欲不振、腰痛、持续多尿及夜尿增多等,检查可见轻、中度蛋白尿,低比重尿,可有高血压及轻、中度贫血。个别患者可演化为慢性肾衰竭。
4.6 特殊类型出血热
4.6.1 小儿HFRS:小儿肾综合征出血热发病率低,约占成人发病总人数3.17%~7.62%,个别地区可达10%,近年来有逐渐增加的趋势[38-39]。小儿HFRS临床表现不典型,全身中毒症状轻,缺乏典型的“三红”表现,头痛、腹痛较多,出血倾向和低血压休克较少。易出现多脏器受累,以呼吸、消化系统受累为主,程度较轻。心脏、肝脏损害常见,可出现脑膜刺激征。肾脏损害较轻。小儿HFRS分期多不明显,越期现象多,恢复快,病死率较成人低[40]。因小儿HFRS临床表现不典型,应对疫区发热患儿常规进行HFRS抗体IgM检查,以免漏诊并实现早期诊断,从而提高治疗和抢救成功率。肾脏B超检查发现有明显肾脏肿大,包膜水肿,有助于小儿HFRS的临床诊断[41]。
4.6.2 老年HFRS:患者早期临床表现不典型。中、低热多,少数患者无明显发热;低血压休克出现早,发生率高。肾脏损伤多严重,少尿及无尿发生率高。消化道大出血、脑出血、肺水肿、肺部感染和中枢神经系统损害等并发症发生率高。恢复相对较慢,重型及危重型病例多,病死率高。
4.6.3 妊娠合并HFRS:患者病情较重,容易发生低血压休克(58.3%),心电图异常100%。妊娠晚期发生HFRS时对母子影响较大,可因流产、死胎、DIC、阴道大出血而死亡[42]。妊娠期妇女患HFRS,可通过胎盘垂直传播,使胎儿宫内感染,从而对胎儿造成严重伤害。因此,妊娠合并HFRS患者容易发生流产、死胎[43-44]。目前观察资料未发现汉坦病毒对胎儿有致畸作用。妊娠期妇女患HFRS,胎儿可从母体获得特异性IgG抗体,6月龄内大多数转阴。对妊娠HFRS患者的治疗应更加重视,入院后应密切观察胎儿情况,如为死胎应立即人工引产,并注意清宫以防胎盘残留,引起持续性出血或诱发DIC。对产后患者,应预防休克和肾衰竭发生。
5 并发症
并发症主要见于低血压休克期、少尿期和多尿早期。常见的并发症有:各种大出血(包括消化道大出血、肾破裂出血、颅内出血、肺出血和穿刺部位大出血等)、DIC、肺水肿、ARDS、严重中枢神经系统损害、高血容量综合征、严重内环境紊乱、心衰和继发感染[45]等。胃肠道大出血可导致休克危及生命;肺大出血可导致循环呼吸骤停;颅内出血可引起抽搐、昏迷和呼吸心跳骤停。少尿期和多尿早期易并发肺炎、尿路感染、败血症、DIC、电解质紊乱等,常加重病情,造成死亡。
6 实验室检查
6.1 血常规 早期白细胞总数正常或偏低,第3~4病日后多明显增高,一般为15~20×109/L,少数重症患者可呈类白血病样表现,白细胞计数可>50×109/L。白细胞分类计数时中性粒细胞比率明显升高,以杆状核白细胞增多为主,同时异型淋巴细胞增多。血小板计数在第2病日开始减少,低血压和少尿期降至最低,多数在30~70×109/L,重症患者可低于10×109/L。发热期末和低血压休克期患者由于血浆大量渗出和血液浓缩,红细胞计数和血红蛋白可明显上升,其升高的程度多与病情轻重和休克的程度密切相关。
6.2 尿常规 尿蛋白在第2~4病日即可出现,且迅速增多,至少尿期可达高峰,多尿后期和恢复期转阴。重症患者可出现大量红细胞(镜下或肉眼血尿)、白细胞、透明或颗粒管型,有时见明显膜状物,为本病患者特有的表现。尿沉渣中还可发现巨大的融合细胞。
6.3 血生化检查 主要表现为血清白蛋白明显减低,低于15 g/L多系危重型患者,预后不良。血尿素氮(BUN),血肌酐(Cr)在发热末期和低血压休克期即可上升,少尿期达高峰,肾小球滤过率(estimated glomerular filtration rate,eGFR)明显降低。低钠、低钙常见,高钾血症也可出现。可出现高血糖或低血糖。
6.4 凝血和出血系列检查 HFRS合并DIC 主要见于低血压休克期,DIC诊断的初筛标准为血小板计数<50×109/L,凝血酶原时间比正常延长3秒以上,纤维蛋白原<1.5 g/L,纤维蛋白原降解产物(FDP)>20 mg/L或D二聚体明显升高。血浆鱼精蛋白副凝试验(Plasma protamine paracoagulation test, 3P)早、中期阳性(晚期多为阴性)也有诊断价值。
6.5 血气检测 ①酸碱指标特点:发热期多表现为呼吸性碱中毒(呼碱)或呼碱伴代谢性碱中毒(呼碱伴代碱)。发热末期可出现代谢性酸中毒(代酸)。低血压期和少尿期常以单纯性代酸和代酸伴呼碱为主要变化。多尿期轻、中型患者的血气指标常趋向正常,但也可因大量排尿、脱水和低钾导致代碱,多呈单纯性呼碱、代碱或呼碱伴代碱。个别患者可出现三重酸碱紊乱。②氧合状况:HFRS从发热期到多尿期都存在肺泡-动脉氧分压差P(A-a)O2增大,少尿期尤为明显。低血压休克期或其他各期合并肺水肿、肺部感染或心衰时可出现低氧血症,动脉氧分压(PaO2)明显下降,此时应结合P(A-a)O2的变化判断肺部换气和氧合障碍的严重程度,防范ARDS。
6.6 血清学检查 是HFRS实验室检测的重要内容。检测方法主要有酶联免疫吸附试验(ELISA)、胶体金免疫层析试验和间接免疫荧光试验(IFA)等。ELISA法具有良好的敏感性、特异性和重复性[46],不同厂家的HFRS-ELISA检测试剂敏感性、特异性略有不同,有条件的单位应首选ELISA法检测。胶体金免疫斑点试验又称免疫滴金实验,属于快速检测技术,基本原理是以微孔滤膜如醋酸纤维素膜为载体,以胶体金为免疫标记物,在膜上完成抗原抗体反应,如果膜上出现特异性斑点(条带),则结果为阳性,否则为阴性结果。胶体金免疫斑点试验的敏感性和特异性通常低于ELISA法,但具有快速、简便、无须特殊设备的特点,适合基层单位开展快速检测。免疫荧光技术有多种方法,具有可靠、特异性和敏感性高的特点,但需要一定的设备条件,标本染色后需立即观察,且检验及报告人员需经过严格训练,应用受到一定限制。
早期患者特异性IgM抗体阳性,或双份血清(发病4 d以内和间隔1周以上)特异性IgG抗体4倍以上增高,可以确诊为现症或近期感染。少数患者第2病日IgM抗体检测即可呈阳性,但大部分患者此时IgM仍为阴性。特异性抗体检测通常应在第3病日后进行,检测阴性不能排除HFRS诊断,检测阴性的疑诊病例可每日或隔日重复检测。随着病程进展,IgM检出率明显增加,4~6病日阳性率超过90%,第7病日接近100%。部分临床病例症状不典型,但特异性IgM抗体阳性;也有部分病例临床表现符合HFRS,但特异性IgM阴性。对于此类患者病原学检查可作为血清学检查的补充。
6.7 病原学检查 利用逆转录PCR(Reverse transcription-PCR, RT-PCR)方法从患者外周血中检测到汉坦病毒RNA或从患者血液等标本中分离出汉坦病毒有助于确诊本病[47]。但此检测方法步骤复杂,成本较高,临床应用较少。病毒培养需要高级别生物安全实验室,临床诊断极少使用。
7 影像学检查及其他检查
7.1 超声检查 由于彩超的应用,观察肾脏的改变成为早期诊断HFRS的方法之一,尤其应用彩超检查以后,可观察肾内血流情况,有助于明确诊断[48-49]。超声主要表现肾脏肿大且形态饱满,各径线均增大,实质回声明显增厚、增强。肾髓质充血和点状出血,严重出血和水肿,引起肾小管上皮细胞坏死,导致肾小管狭窄阻塞,表现为肾髓质锥体回声减低。肾包膜与肾实质易分离,严重患者可有包膜下积液。及时进行肾脏超声检查有助于发现肾破裂。如有必要也可行心脏、肺脏、胸水、腹水、下腔静脉变异度等的超声检查。
7.2 放射影像学检查 主要包括X线片和CT片,有助于及时发现肺部病变及并发症。可出现肺纹理增多,片状影、肺实变、胸腔积液等。条件允许情况下,尽早行胸部CT检查;如患者病情危重,可行床旁胸部X线片。头颅CT检查有助于诊断脑出血。
7.3 心电图 HFRS患者可发生各种心电异常,心电图异常率约为76.3%,心电图改变以窦性心律失常(窦性心动过速、窦性心动过缓)和ST-T改变最常见,窦性心动过缓主要发生在少尿期和多尿早期[50]。心电图异常发生率与患者病情严重程度、年龄和基础疾病等有关,病情越重,异常率就越高,心肌损害就越严重[51]。
8 诊断与鉴别诊断
8.1 诊 断 主要依靠特征性临床症状和体征,结合实验室检查,同时参考流行病学史等进行诊断。
8.1.1 流行病学资料:①在本病流行季节、流行地区发病,或患者于发病前1~2个月内到过HFRS疫区居住或逗留;②患者有与鼠类等汉坦病毒宿主动物及其排泄物直接或间接接触史,或食用过鼠类污染的食物或被鼠类寄生虫叮咬,或有实验动物特别是鼠类接触史。
8.1.2 临床表现:有典型发热、出血和肾损害三大主症和5期临床过程及特殊中毒症状,如“三痛”和“三红”,肾脏损害表现等。早期要特别注意是否有渗出、组织水肿体征和出血点。
8.1.3 实验室检查:包括血液浓缩、血红蛋白和红细胞增高;白细胞计数和中性粒细胞增高和血小板减少;检出明显的尿蛋白和尿膜状物等均有助于诊断。
8.1.4 血清学和病毒核酸的检测:是确定诊断的重要依据。检测特异性IgM抗体阳性或双份血清IgG抗体滴度4倍以上增高,或检出汉坦病毒RNA。
推荐意见3:结合患者临床表现、流行病学史和实验室检查,特异性抗体IgM阳性可确诊。如患者无相关临床表现,仅特异性抗体IgM阳性不能诊断HFRS。
推荐意见4:当前特异性抗体检测首选酶联免疫吸附试验,也可使用胶体金免疫层析试验。必要时使用间接免疫荧光试验或汉坦病毒 RNA检测。
推荐意见5:特异性抗体检测通常应在第3病日后进行,检测阴性的疑诊病例可每日或隔日重复检测。进行汉坦病毒RNA检测应在发病早期采样,最好在发热期进行。
8.2 临床早期定度与预警 HFRS预后影响因素多,患者在发热早期临床症状和体征的轻重程度,与本病中、后期临床表现的严重程度有关。此外,外周血白细胞(WBC)、血小板计数(PLT)及尿蛋白量等检测指标对病情预测亦具有重要价值。动态监测患者外周血WBC、PLT、白蛋白(ALB)、BUN、Cr、凝血酶原时间(PT)和纤维蛋白原(Fib)等指标有助于观察病情变化,同时不断修正预后预测;休克的严重程度及持续时间、脏器出血、昏迷和ARDS可作为重症HFRS患者预后的独立影响因素[52-54]。HFRS患者早期定度,有利于集中精力对重点患者进行密切观察,及时发现病情变化并采取有效处置;同时有利于采取预防性治疗。早期定度参考标准见表2。

表2 HFRS早期定度参考标准[42,55]
注:具备其中3项者可作为定度标准;早期定度可随病程进展发生变化,宜动态评估
对HFRS的临床早期预警研究始终是该病重要的临床研究内容。有研究结果显示[56],一些细胞因子的检查如TNF-α、IL-6 、 IL-8、 IL-2等具有一定临床早期预警作用,但是到目前为止仍然未发现较上述常规临床表现和检验指标更加有效和简便的指标。
8.3 临床分型 本病按病情轻重可分为四型:① 轻型:体温39℃以下,中毒症状轻,有皮肤黏膜出血点,尿蛋白“+~”,无少尿和休克;② 中型:体温39~40℃,中毒症状较重,球结膜水肿明显,皮肤黏膜有明显瘀斑,病程中出现过收缩压低于90 mmHg或脉压小于30 mmHg,有明显出血和少尿期,尿蛋白“~”;③重型:体温40℃上下,有中毒症状和外渗症状或出现神经系统症状,可有皮肤瘀斑和腔道出血,有明显休克,少尿达5 d或无尿2 d以内;④ 危重型:在重型基础上出现难治性休克、重要脏器出血、严重肾损害或其他严重合并症如心力衰竭、肺水肿、呼吸衰竭、继发严重感染、脑水肿或脑出血甚至多脏器功能障碍综合征(Multiple organ dysfunction syndrome, MODS)等。
8.4 鉴别诊断 典型患者诊断并不困难,进入少尿期或多尿期后,可问及明显的分期发病过程,且易于检出特异性抗体。因此,重点是发热期和低血压休克期与其他发热疾病,如上呼吸道感染、流行性感冒、发热伴血小板减少综合征、流行性脑脊髓膜炎、流行性斑疹伤寒、伤寒、钩端螺旋体病及败血症等及伴发低血压休克的疾病如急性中毒性菌痢和休克性肺炎、某些肾脏疾病进行鉴别。 出血倾向严重者应与急性白血病、过敏性和血小板减少性紫癜等进行鉴别。肾损为主的出血热应与肾脏疾病如原发性急性肾小球肾炎、急性肾盂肾炎及肾病等相鉴别。少数有剧烈腹痛伴明显腹膜刺激症者应排除外科急腹症。
9 治 疗
本病目前尚无特异性病原学治疗药物,主要针对各期的病理生理变化,进行综合性和预防性治疗。抓好“三早一就(指早发现、早休息、早治疗和就近在有条件的医院治疗,推荐在就近的2级以上医院治疗)”、把好“四关(包括休克、少尿、出血和脏器损害)”,对减轻病情、缩短病程和改善预后具有重要意义。该病病情变化快,密切观察,及时发现病情变化并进行适当处置至关重要。药物治疗以液体疗法和对症支持治疗为主,抗病毒治疗为辅,必要时行抗菌治疗。预防和及时有效治疗并发症是减少死亡的重要手段。对重症患者,在有条件的医院应尽早转入感染病专科或综合ICU救治。儿童、老年人、妊娠期妇女等特殊人群应根据其特点进行个体化处理。
9.1 发热期治疗
9.1.1 一般治疗:卧床休息,避免劳累。给予营养丰富、易于消化的饮食。高热者应给予物理降温。可使用糖皮质激素抗炎降温。氢化可的松100 mg,静滴,1~2次/d;地塞米松5~10 mg,肌注或静滴,1~2次/d(儿童0.2~0.4 mg/kg,疗程2~3 d,或热退即停);甲基强的松龙 20~40 mg,静滴,1~2次/d;必要时上述药物每日可使用4次。甘草酸制剂有类激素作用,具有降低毛细血管通透性,抑制多种细胞因子的生成和释放、抑制炎症的作用,也可使用[57],进入少尿期后停用。阿司匹林除退热作用外,有抗血小板作用,可加重出血,应避免使用。布洛芬、对乙酰氨基酚、安乃近等退热药物有发汗作用,可进一步降低有效循环血量,诱发或加重休克,应慎用。
静脉补入适量盐和葡萄糖等液体,每日1000~1500 ml,发热期末每日静脉液体入量可增至1500~2000 ml,平衡盐液(如复方醋酸钠林格液)或生理盐水的用量约占总量的1/3甚至1/2,并及时根据体温、血压、尿量、出汗状况及血液浓缩情况予以调整。儿童补液量为生理需要量+额外丢失量。
9.1.2 抗渗出治疗:本病的基本病理改变为毛细血管和小血管损害,由此导致血浆的大量渗出。抗渗出可选用钙剂如葡萄糖酸钙、甘露醇和糖皮质激素等。用法20%甘露醇125 ml(儿童2~3 ml/kg)静滴,1~2次/d,每日不超过4次。抗氧自由基药物如还原性谷胱甘肽、抗组织胺受体药物如扑尔敏也可应用。渗出体征明显者,应及时加用胶体液如新鲜或冰冻血浆、人血白蛋白、低分子右旋糖酐等,以预防低血压休克的发生。
9.1.3 抗出血治疗:发热期出血主要由于小血管壁的损伤和血小板减少所致,可给予维生素C、酚磺乙胺、卡巴克络等。
维生素C可加入液体中静滴,2~4 g/d。酚磺乙胺用量为0.5~1.0 g (儿童0.25~0.5 g),静滴或肌注,1~4次/d。卡巴克络水杨酸钠注射液,5~10 mg,肌肉注射,2~3次/d;卡巴克络磺酸钠注射液,60~80 mg,静滴,1次/d。氨甲苯酸0.1 g~0.3 g,稀释后静滴,2次/d。为预防DIC发生,改善血液流变性,可给予双嘧达莫(潘生丁)0.1 g [儿童3~5 mg/(kg·d)],口服,3次/d;低(小)分子右旋糖酐250~500 ml,静滴,1次/d[儿童10 ml/(kg·d),不超过成人用量]。血小板低于20×109/L时,可输注血小板。
9.1.4 抗病毒治疗:本病早期(3~5病日)及时给予抗病毒治疗,可能具有减轻病情、缩短病程的作用。Huggins等观察到利巴韦林对体外培养的汉坦病毒有明显抑制作用。在此基础上进一步用汉坦病毒感染的乳鼠进行了感染动物试验,研究证实用10倍致死剂量的汉坦病毒76-118株感染乳鼠后,利巴韦林治疗组存活率为55%,而对照组存活率为0%[58]。Moreli报道[59],病程早期应用利巴韦林后,HFRS患者生存率有显著提高。
抗病毒治疗主要选用利巴韦林。利巴韦林按10~15 mg/(d·kg),分2次加入10%葡萄液250 ml中静滴,每日总量不超过1500 mg,一般疗程3~5 d,不超过7 d。
推荐意见6:推荐在就近有条件的2级以上医院进行治疗。
推荐意见7:避免使用阿司匹林、布洛芬、对乙酰氨基酚、安乃近等药物退热。
推荐意见8:推荐使用糖皮质激素,首选氢化可的松,也可使用地塞米松或甲基强的松龙等。
推荐意见9:抗病毒药物宜早期使用,推荐使用利巴韦林,一般不超过7d。
9.2 低血压休克期治疗 休克发生率约为5%~20%,常见于野鼠型HFRS患者。休克是患者的主要死因之一。
9.2.1 基础治疗:①宜就地组织抢救,减少搬运;②保持呼吸道畅通,常规给予氧气吸入治疗;③严密监测血压、心率、呼吸、神志和出血情况。记录24h出入量;④保持静脉通路畅通,常需建立多路静脉通道;⑤注意保暖。寒冷季节输入的液体应加温到25℃左右;⑥积极预防其他病原体感染。
9.2.2 液体复苏治疗(补充血容量)
9.2.2.1 液体种类:近年多项国际随机对照多中心的临床试验表明,脓毒性休克(Septic shock)的液体复苏时首选晶体液或胶体液,对患者病死率无影响[60]。对7项多中心随机对照[62-67]分析显示,初始液体复苏选用晶体液(生理盐水、乳酸林格液)与胶体液(白蛋白或其他胶体液)对脓毒症患者28~30 d病死率无影响。除了白蛋白和血浆,加用其他种类的胶体液并未显示出更好的疗效,国内也在进行相关探索。HFRS休克治疗以平衡盐等晶体液为主,辅助白蛋白、血浆和低分子右旋糖酐等胶体液。
9.2.2.2 补液原则与速度:发生休克时,成年患者首批1000 ml液体应在60 min内滴(注)入,其后60~120 min内快速输入1000 ml,以后根据血压、MAP、血红蛋白量、末梢循环、组织灌注及尿量的动态变化,决定滴速和用量,血压回升至基本正常后仍然需要维持输液,以晶体液为主,速度约200~300 ml/h,直至血压稳定约8 h。
儿童休克液体量可按20 ml/kg在10~20 min内推注,后评估循环恢复情况,如无明显改善可给与第2、3剂量,每剂10~20 ml/kg,总量可达40~60 ml/kg/h;血压回升后,儿童继续输液可用1/2~2/3张液体5~10 ml/(kg·h),6~8 h内输入;维持输液用1/3张液体2~4 ml/(kg·h)于24 h内输注;其后据病情调整输液方案。
扩容是否足量的主要观察指标:①收缩压达90~100 mmHg(12.0~13.3 kPa);②平均动脉压(MAP)65 mmHg(8.67 kPa)以上;③心率100 次/min以下; ④微循环障碍缓解;⑤血红蛋白和红细胞压积接近正常。有监护条件的单位可开展中心静脉压(CVP),连续心输出量(CCO)和动态MAP监测,也可联合应用床旁心肺超声、无创CCO监测仪等措施评估容量状态。可参照《成人严重感染与感染性休克血流动力学监测与支持指南》中的治疗目标,即:中心静脉压 (CVP)达到8~12 mmHg(1 mmHg = 0.133 kPa);对于进行机械通气或存在心室顺应性改变的患者推荐维持在12~15 mmHg;平均动脉压(MAP)维持≥65 mmHg;中心静脉血氧饱和度(或上腔静脉Scv O2)≥70%,或混合静脉血氧饱和度(SvO2)≥65%。
9.2.2.3 补液量:一般低血压倾向、低血压和休克时每日输入液量分别为3000 ml、4000 ml和5000 ml左右。也可依据HGB计算,以HGB 150 g/L为基准,每上升10 g/L,相当于丢失血浆300 ml,约需补液1000~1200 ml;同时补充持续外渗液量和出量。既要防止补液不足,也要防止补液过量,血压已经基本稳定后应减少输液量,以避免加重肺等组织器官的水肿。
9.2.3 纠正酸中毒:低血压休克多伴有代谢性酸中毒,常用5% 碳酸氢钠静滴,具体用量可根据血气结果确定。动脉血pH值高于7.25时,通常不需要纠酸治疗。
9.2.4 血管活性药物:液体复苏效果不佳时,在继续液体复苏的同时使用血管活性药物。休克患者去甲肾上腺素和多巴胺均能通过收缩血管而升高MAP,与多巴胺相比,去甲肾上腺素对心率和每搏量(SV)的影响较小,却能更有效地改善脓毒性休克患者的低血压状态[68]。有Meta分析显示,休克患者使用肾上腺素和多巴胺在28~30 d 病死率无明显差别。但去甲肾上腺素组室性或室上性心律失常发生率明显低于多巴胺组[60,69-70]。因此,推荐去甲肾上腺素作为休克患者的首选血管升压药物。同样,HFRS患者休克治疗的血管活性药物首选去甲肾上腺素,慎用多巴胺和间羟胺。去甲肾上腺素成人常用量,开始以每分钟8~12 μg速度滴注,调整滴速以达到血压升到理想水平;维持量为每分钟2~4 μg,必要时可增加,需注意保持或补充血容量[71]。
9.2.5 正性肌力药物:对心肺功能不全的患者,或大量快速输液可能出现心衰肺水肿的患者,可酌用毛花苷丙(西地兰)0.4 mg(>2岁儿童0.02~0.03 mg/kg,<2岁儿童0.03~0.04 mg/kg)或毒毛旋花苷K 0.125~0.25 mg (儿童0.007~0.01 mg/kg,最大量不能超过成人用量),加入葡萄糖液中静脉缓慢推注,必要时12h后重复1次,半量注射。对于存在下述情况时,建议以2~20 μg/(kg·min) 的速度输注多巴酚丁胺:①心脏充盈压升高、CO降低提示心肌功能障碍;②尽管已取得了充足的血容量和足够的MAP仍出现灌注不足征象[60]。
9.2.6 糖皮质激素:可用氢化可的松200~400 mg/d稀释后静滴或地塞米松10~40 mg/d静推,分2~3次使用(儿童地塞米松0.2~0.4 mg/kg,1~2次/d)。也可用甲基强的松龙[儿童1~2 mg/(kg·d)]。
9.2.7 DIC或继发性纤溶的治疗:应根据临床和实验室检查结果进行治疗。主要分为三期:①高凝期主要用肝素治疗。一般普通肝素每次用量为0.5~1.0 mg (62.5~125U)/kg,静脉或皮下注射,6~12 h1次;低分子量肝素3000~5000 U/d,皮下注射。两种肝素的治疗均需根据病情决定疗程,一般1~3 d即可。可用APTT(部分凝血活酶时间)监测,肝素治疗使其时间延长至正常值上限的1.5~2.0倍较为合适,>2倍时间可暂停注射1次;低分子量肝素常规剂量下无需监测。亦可同时应用低分子右旋糖酐500 ml静脉滴注,以减低血小板粘附性和抑制红细胞聚集。②消耗性凝血障碍期的早期,凝血时间尚未明显延长时,可以应用肝素治疗,剂量同上。若APTT超过正常值的2倍时,不宜再应用肝素治疗。此期主要是凝血因子缺乏所致的出血,应补充新鲜血浆或鲜血、冷沉淀物、纤维蛋白原等。为防输鲜血及凝血因子后再引起血管内凝血,可加用小剂量肝素1次。③继发性纤溶。可予氨甲苯酸、6-氨基己酸或氨甲环酸治疗,氨甲苯酸0.1 ~0.3 g/次稀释后静滴,2次/d,6-氨基己酸4.0 ~6.0 g/次,静脉滴注,2~4次/d。氨甲环酸0.25 ~0.5 g/次,稀释后静脉滴注,2~4次/d。肝素过量或肝素类物质增加可用硫酸鱼精蛋白注射液,1 mg硫酸鱼精蛋白可中和100 U普通肝素,硫酸鱼精蛋白每次50~100 mg,加入5%葡萄糖液中缓慢推注, 2~4次/d。
9.2.8 难治性休克:难治性休克治疗难度大,救治成功率低,是肾综合征出血热死亡的主要原因之一,是亟待解决的问题。但是,经过积极液体复苏、血管活性药物、维持内环境稳定、连续性肾脏替代、呼吸支持等综合治疗,有少数患者可以治愈。对这类患者仍不应轻言放弃,应积极抢救。CRRT对机体血流动力学影响小,具有清除炎症因子、减轻水负荷等作用,已成为重症HFRS患者的重要支持治疗措施。目前对难治性休克HFRS患者CRRT的最佳时机、治疗持续时间及模式选择尚无定论。杜虹等研究报道[72-74], 对已合并急性肾损伤(AKI)、严重非心源性肺水肿、电解质紊乱及严重酸碱失调的患者,开展床旁CRRT有助于缓解病情。此外,难治性休克患者多伴有严重的凝血机制紊乱,多数患者有明显出血倾向或合并重要脏器出血,此时应使用枸橼酸体外抗凝或无抗凝剂方案。CRRT中需定期监测动脉血气、血常规、肾功、电解质及凝血指标。
推荐意见10:建议就地治疗,如果需要转院,需在生命体征相对平稳的情况下,由医护人员陪同,使用急救设备相对完善的救护车转运。
推荐意见11:可能的情况下,建议在感染病专科或综合ICU治疗。
推荐意见12:液体复苏按照“先快后慢、先晶后胶”的原则进行。晶体液与胶体液的比例一般控制在3∶1~5∶1左右,渗出严重的患者可以提高胶体液比例。
推荐意见13:晶体液首选复方醋酸钠林格液、乳酸钠林格液,也可选用生理盐水、葡萄糖生理盐水等。
推荐意见14:胶体液优先选用血浆、人血白蛋白,也可使用低分子右旋糖酐。不使用羟乙基淀粉。
推荐意见15:休克患者2~3 h输注超过3000 ml液体血压不能恢复或恢复后血压再次下降者(儿童患者经充分扩容后血压仍不能恢复者),应使用血管活性药物。血管活性药物首选去甲肾上腺素,必要时联合使用多巴酚丁胺,慎用多巴胺和间羟胺。
推荐意见16:难治性低血压休克时可试用CRRT治疗。建议选用枸橼酸体外抗凝或无抗凝剂CRRT治疗方案。
9.3 少尿期治疗 稳定机体内环境、积极防治并发症和促进肾功能恢复是本期的治疗原则。
9.3.1 稳定机体内环境
9.3.1.1 维持水、电解质和酸碱平衡:应严格限制液体入量,每日补液量为前1d尿量和吐泻量加500~800 ml。近年随着血液净化治疗的普及,少尿期的补液量可适度放宽。静脉补入液体通常以高渗糖为主,可根据患者内环境作适当调整。审慎使用含钾药剂。HFRS患者少尿期低钠血症多为稀释性低钠,一般勿需补钠治疗。通常血钠低于125 mmol/L才补钠。一般先补半量,常用生理盐水或3%高渗盐水静脉滴注。可参照公式计算补钠量:补钠量(mmol)= [ 142-血钠测定值(mmol)]×0.6×体重(kg)。
合并心衰肺水肿或脑水肿者补钠宜慎重。本病少尿期较少出现严重高钾血症。纠正高钾血症可临时推注10%葡萄糖酸钙或静脉滴注高渗葡萄糖和普通胰岛素(每4~6 g糖加用1单位胰岛素)。重度酸血症可酌用5%碳酸氢钠。血液透析是调整内环境最简便有效的方法,内环境紊乱且条件具备时应进行血液净化治疗。
9.3.1.2 热量及氮质平衡:鼓励患者进食清淡易消化的食物。每日糖量不低于150~200 g,以保证热量。对于少尿时间持续较长,且进食不佳者也可辅以10%脂肪乳250~500 ml/d静滴。酌用胰岛素、ATP和辅酶A等。
9.3.2 促进利尿:通常血压稳定12~24 h后开始利尿。首选呋塞米20~40 mg/次静脉推注,若2~4小时未排尿,可加大呋塞米用量至100~200 mg/次,2~4次/d。根据前1d的尿量决定当日利尿剂剂量,使每日尿量达2000 ml左右即可,呋塞米总量通常不超过800 mg/d。托拉塞米等利尿药物也可使用。高血容量综合征除利尿治疗外,应尽快进行血液透析超滤脱水或导泻,甚至放血治疗。
9.3.3 血液净化:血液净化治疗主要包括间歇性血液透析(IHD)和CRRT。
9.3.3.1 血液透析:是当前HFRS肾衰竭的主要治疗方法。HFRS患者透析指征:①少尿超过3d或无尿1d,经利尿治疗无效;②尿量增加缓慢,氮质血症日趋严重,血尿素氮>30 mmol/L;③高血容量综合征伴肺水肿、脑水肿、尿毒症脑病等,可与药物治疗同时进行;④严重电解质紊乱(血K﹢>6.5 mmol/L,血Na﹢>160 mmol/L或<125 mmol/L)。
透析禁忌证:①低血压休克未纠正;②严重感染,生命体征不稳定;③身体极度衰竭,生命体征不稳定。
透析并发症:①出血;②凝血;③溶血;④低血压休克;⑤失衡综合征;⑥发热等。应当注意防治。
9.3.3.2 CRRT:对机体血流动力学状态影响小,可清除炎症因子、减轻水负荷,应用指征基本同血液透析,特别适用于血流动力学不稳定、不宜搬动的危重HFRS患者。治疗模式可考虑选择连续性静-静脉血液滤过(CVVH)、连续性静-静脉血液透析滤过(CVVHDF)和连续性静-静脉血液透析(CVVHD)。对无严重凝血机制紊乱的少尿期患者,可考虑普通肝素或低分子肝素抗凝;对存在严重凝血机制紊乱者,可考虑枸橼酸体外抗凝或无抗凝剂方案。CRRT中需定期监测动脉血气、血常规、肾功、电解质及凝血指标。CRRT常见并发症:出血、低血压休克、凝血、过敏、导管相关性血流感染、空气栓塞等。
9.3.4 物理治疗:少尿超过1周时可使用肾脏超短波热疗。
推荐意见17:血压稳定12~24h后开始利尿。首选呋塞米,分次使用,每日总剂量不超过800 mg。
推荐意见18: 血液净化是少尿期至关重要的治疗措施,间断性血液透析和CRRT均可使用。对血流动力学不稳定、不宜搬动的危重HFRS患者优先选用CRRT,对存在严重凝血机制紊乱者,可考虑枸橼酸体外抗凝或无抗凝剂方案。
9.4 多尿期治疗 移行期及多尿早期的治疗原则同少尿期,此阶段虽然尿量明显增多,肾功能的修复才刚刚开始,体内以BUN和Cr为代表的各种代谢产物仍可继续增加,感染、大出血等并发症仍可危及患者的生命,需继续防治感染、抗出血及对症支持等治疗。对于尿量迅速增加的患者,应防止发生严重脱水、低血容量性休克、低血钾、低血钠及非酮症性高渗性昏迷,适时补足液体及电解质。逐渐增加蛋白及高热量饮食,对于不能进食的患者可静脉输注脂肪乳、复方氨基酸或肾脏必需氨基酸及血浆等。多尿中后期可予六味地黄丸等中药口服,以促进肾功能的恢复。
9.5 恢复期治疗 患者应注意休息,逐渐增加活动量。加强营养,补充高蛋白、高热量和高维生素饮食。复查血常规、尿常规及肾功能,了解肾脏损伤、血压及贫血等的恢复情况。
9.6 并发症的治疗
9.6.1 继发感染:尽早预防、诊断和治疗有助于控制继发感染。预防措施包括加强病室的清洁及消毒,限制陪护和探视,注意饮食卫生,加强口腔护理,加强营养和支持治疗,严格无菌操作,合理使用广谱抗菌药物和糖皮质激素等。尽早诊断措施包括观察体温、呼吸及血象,必要时及时送血、痰和尿等培养。抗菌药物的选择应按照抗菌药物使用一般原则进行,应避免使用氨基糖苷类等肾毒性药物,以免诱发或加重肾脏损害。
肺部感染的治疗应根据病原学结果结合临床表现选用抗菌药物,贯彻广谱、联合、足量和静脉给药原则。杆菌感染可选用第三、四代头孢菌素和碳青霉烯类抗生素,球菌感染可选用利奈唑胺及万古霉素等。注意排查和治疗真菌感染。
9.6.2 肺部并发症:原发性肺水肿的预防主要是用氧自由基清除剂如维生素E、辅酶Q10等,以减轻肺血管损害。发热期及低血压期应控制液体总量和含钠液的输入,酌用20%甘露醇125 ml静滴,1~2次/d。
肺出血的治疗需根据不同出血原因,选用鱼精蛋白、抗纤溶药物等进行针对性治疗,症状好转时不可突然停药,同时必要时补充血浆等凝血因子和血容量。大出血时可试用垂体后叶素或精氨酸血管加压素治疗。必要时可行支气管镜检查和治疗。
尿毒症肺治疗关键是严格掌握出入量,稳定内环境,适时使用血液净化治疗。ARDS的治疗主要采用机械通气,应用肾上腺皮质激素,积极控制感染及减轻肺水肿等。
9.6.3 重要脏器出血
9.6.3.1 自发性肾破裂:自发性肾破裂多发生于重症患者少尿期,其次为多尿早期,以包膜下出血占多数[75-76]。肾破裂90%发生在重型和危重型HFRS,临床发生率约0.5%,病死率达18.6%[76]。自发性肾破裂临床表现差异较大,表现为腰痛加剧,腰肌紧张,明显压痛,腹膜刺激征,严重者可发生出血性低血压休克。包膜未破裂,易形成包膜下血肿,出血量少,局部疼痛剧烈。一旦肾包膜破裂,疼痛虽有减轻,但出血量加大,可危及生命。B超和CT可准确判断肾破裂出血部位、类型和程度。一旦确立肾破裂诊断,绝对卧床休息2~4周,过早下床活动会诱发再度出血。密切监测患者生命体征、血常规、尿常规变化。由于肾破裂多发生于重症或危重症患者,手术条件差,因此,尽可能选择内科保守治疗或介入止血治疗,审慎选择手术治疗。内科治疗指征:肾包膜下出血;肾包膜破裂经短期观察处理肾周血肿不再扩大;虽伴有休克,但易于纠正。可选用2~3种止血药物联合,待出血停止后逐渐停药。
9.6.3.2 消化道大出血:消化道大出血相对常见,主要包括胃出血和肠道出血。胃肠道出血早期,血液未经口呕吐或经肛门排出之前,患者常有进行性腹胀,常诉腹胀或恶心。常有进行性贫血,腹部隆起,叩诊鼓音,肠鸣音减弱等。消化道大出血是患者死亡的常见原因之一。采取各种止血措施,如维生素C、酚磺乙胺、卡巴克络、维生素K1等常规应用,收缩小血管、提高血小板数量,促进凝血因子合成等;使用生长抑素或奥曲肽;质子泵抑制剂或H2受体阻滞剂,如兰索拉唑、奥美拉唑、雷尼替丁等抑酸药物静注;去甲肾上腺素8 mg加入冷盐水100 ml中口服或鼻饲,1~3次/d;6-氨基己酸或氨甲苯酸治疗继发性纤溶亢进;新鲜血浆或纤维蛋白原输注,补充凝血因子和蛋白质。伴有尿毒症时,积极进行血液透析以降低BUN及Cr等毒性物质对血小板及胃肠黏膜的影响。
9.6.3.3 颅内出血:HFRS整个病程中都有发生颅内出血的可能,包括脑实质出血和蛛网膜下腔出血,病情凶险,预后差。判断是否发生颅内出血,主要根据患者是否出现中枢神经系统症状和体征。在病程中患者突发头痛或头痛加剧、呕吐、意识障碍、抽搐、呼吸心跳骤停等症状,脑膜刺激征阳性,需要考虑脑出血可能。考虑颅内出血均应尽可能行头颅CT检查。蛛网膜下腔出血腰椎穿刺为血性脑脊液。主要进行内科止血治疗和对症支持治疗。慎重评估风险后,如有必要可考虑外科治疗。
推荐意见19:建议使用青霉素类或不含酶制剂的头孢菌素预防细菌感染。不建议使用限制级抗菌药物预防细菌感染。应避免使用氨基糖苷类抗菌药物,以免加重肾损害。
推荐意见20:不论何种原因造成的呼吸衰竭,推荐尽早使用无创或有创机械通气。
推荐意见21:慎重使用肝素治疗凝血功能紊乱。
推荐意见22:血小板计数低于20×109/L,建议输注血小板。在大出血的情况下,即使血小板计数为20×109/L~50×109/L,也应考虑输注血小板。
推荐意见23:脑出血和脏器大出血均以保守治疗为主,必要时可考虑介入治疗。不推荐外科治疗肾破裂出血和胃肠道大出血。
10 护理要点
10.1 发热期
10.1.1 密切观察体温、脉搏,作好高热患者护理。体温过高时,应及时采取物理降温,并及时告知医生。
10.1.2 每日留尿样化验尿常规,观察尿蛋白的动态变化。
10.1.3 按医嘱定时观察并记录生命体征(体温、心率、脉搏、呼吸、血压、神志、尿量等)及动态心电图的变化,以便尽早发现低血压及呼吸衰竭或肾衰竭倾向。
10.2 低血压休克期
10.2.1 为保证液体能及时快速输入,应至少建立2条静脉通道,或用9号以上针头穿刺大的浅部静脉或深静脉置管。
10.2.2 严密观察血压、脉搏变化,在血压不稳定或休克时宜每15~30分钟测量1次,并作好记录。
10.2.3 注意补液速度,早期应快速补液,用血管活性药物时,应根据血压情况,调整药物滴入速度,防止血压骤升骤降。注意输液反应和液体外渗。
10.2.4 注意尿量,及时发现少尿倾向。
10.2.5 让患者绝对卧床,尽可能不搬动,以防血压波动。
推荐意见24:为保证液体能及时快速输入,应至少建立2条静脉通道,或用9号以上针头穿刺大的浅部静脉或深静脉置管。
10.3 少尿期
10.3.1 密切观察和记录患者生命体征,准确记录24h出入量。
10.3.2 做好患者的清洁护理,定时帮助患者翻身,严防继发感染[77]。
10.3.3 密切观察患者出血等并发症。
10.4 多尿期 加强营养。准确记录24h出入量。
11 出院标准
11.1 主要症状消失,尿量基本恢复正常。部分重型、危重型患者仍感纳差、衰弱、疲乏及轻度多尿,也可出院居家康复。
11.2 血、尿常规化验及生化检查正常或基本正常或仅有轻度贫血及蛋白尿,心电图基本正常。
11.3 可在床上活动,无需吸氧。
出院后可根据病情恢复情况,休息1~3个月。重型、危重型病例可适当延长,并间隔1~4周定期复查。
12 待解决的问题
12.1 阐明血管损伤及血管渗漏的发生机制,寻找有效的治疗方法。
12.2 HFRS休克,特别是难治性休克治疗效果亟待提高。
12.3 寻找加快肾脏损伤修复的治疗方法。
12.4 减少肺损害并提高呼吸衰竭的治愈率。
12.5 减少肺出血、脑出血、肾破裂出血和消化道大出血,并提高严重出血治愈率。
12.6 规范特殊人群HFRS如老年人、儿童、孕妇等的治疗。
专家组成员(按拼音排序):
白雪帆 党双锁 杜 虹 樊万虎 郝春秋 黄长形 贾战生 姜 泓 李红兵 李 沛 李亚绒
李燕平 李用国 连建奇 刘海玲 刘洪艳 刘拉羊 刘小莹 刘正稳 马立宪 宁 博 王 峰
王贵强 王敬军 王九萍 王临旭 王平忠 徐志凯 张复春 张 鸿 张 颖
执笔:黄长形,姜 泓,白雪帆

