胆汁酸代谢紊乱与消化道疾病的研究进展
杨泽俊,朱敏佳,王菲菲,狄治杉,王跃秀,李利生,徐敬东
杨泽俊,朱敏佳,王菲菲,狄治杉,徐敬东,北京市首都医科大学生理学与病理生理学系 北京市 100069
王跃秀,北京市首都医科大学国际学院 北京市 100069
李利生,北京市首都医科大学基础医学院 北京市 100069
核心提要: 人体肠道中存在大量的微生物,胆汁酸(bile acid,BA)是其重要的代谢产物.BA可以参与肠道菌群数量的双向调控、肠道免疫应答以及肠道正常生理功能调节.当BA代谢发生紊乱时,肠神经系统以及肠道中多种信号分子的正常功能受到影响,出现肠道功能紊乱,目前成为研究热点.
0 引言
在人体消化道中有数万亿的微生物定殖,它们作为人体的共生生物,从人体消化道的食物残渣中获取营养,其代谢产物如短链脂肪酸(short chain fatty acids,SCFA)、胆汁酸(bile acid,BA)等作为信息物质对肠道内环境进行调控.当肠道内微生物群落生态失调时,其代谢紊乱将会引起肠道多种疾病发生.在肠道中,各种形式的BA充分发挥各自的生理功能,并再次决定了自身的命运.这是因为肠道微生物可以将肝脏合成的初级BA转化为次级BA,并激活G蛋白偶联BA受体5(G protein-coupled bile acid receptor,TGR5),该受体位于细胞膜表面,与BA结合后升高胞内cAMP,激活MAPK信号通路,该受体具有参与抑制巨噬细胞功能和BA调节能量稳态的作用.而共生菌的数量或种类变化对肠道功能产生影响,例如腹泻型肠易激综合征(irritable bowel syndrome,IBS)患者中大肠杆菌增加.肠神经系统(enteric nervous system,ENS)是调节肠道功能的自主神经系统的一部分,主要由肌间神经丛和黏膜下神经丛构成.而次级BA作为肠道重要的代谢产物,对于ENS有调控作用,但是BA变化引起的ENS功能异常与肠道的疾病未能引起足够关注.本文基于近年对BA与ENS的功能的研究进展,对BA在肠道的角色的重要性予以综述.
1 肠道微生物通过BA途径调节肠道功能机制
BA在以鹅脱氧胆酸(chenodeoxycholic acid,CDCA)和胆酸(cholic acid,CA)两种形式存在,当其在胆囊中存储时,大部分BA与甘氨酸酰胺化(“缀合”),小部分与牛磺酸酰胺化.这些初级BA在肠道中微生物的作用下,会发生7-位羟基脱氧,形成二级或三级BA,如脱氧胆酸(deoxycholic acid,DCA)和熊去氧胆酸(ursodeoxycholic acid,UDCA),在肠道中形成BA池.大多数BA在回肠中被重新吸收并通过门静脉循环到肝脏[1].BA的这种动态平衡变化对于其发挥信号分子的作用是十分重要的.初级BA经过肠道细菌代谢成为次级BA的过程是由多种肠道细菌的BA盐水解酶(bile salt hydrolases,BSHs)催化进行,并且这有助于肠道细菌在人体内BA的抑菌作用下存活.同时,肠道细菌参与对BA的酯化和脱硫作用,这可以调节BA的排出,从而维持BA池的稳态.除与此外,BA的解偶联可以促进肠道细菌的定殖,BSH的缺失将导致细菌的感染性降低[2].BSH催化的结合BA的解离作用也可能会为类杆菌、长双歧杆菌等肠道微生物提供碳源或氮源[3].Out等[4]人通过对常规培养小鼠使用抗生素后发现BA排泄减少,但BA合成酶CYP7A1的表达却增加,这是由于微生物的减少影响了其对于抑制肠道胆汁盐转运蛋白Asbt表达的转录因子Gata4的刺激,使得Asbt的表达在回肠和小肠的近端中明显增加,导致肠道对于BA的吸收能力增强.由以上各种证据看来,BA和肠道微生物之间存在双向的调节作用.
另外,肠道微生物通过BA及其相关受体可以影响肠道正常的生理功能.TGR5是一种已知的BA特异性受体,其广泛存在于肝脏、肠道和脂肪等机体的组织中,尤其在ENS中广泛表达[5].众所周知,BA作为消化脂肪所必要的物质,当进食高脂肪食物时,胆分泌出大量的初级BA进入消化道.这些初级BA被肠道中的微生物分解成次级BA,诱导肌间神经丛中TGR5和iNOS上调,继而对胃肠道运动产生影响[5],在IBS和溃疡性结肠炎(ulcerative colitis,UC)患者中表现为结肠转运时间缩短,敏感性增加,产生腹痛、腹泻的症状[6].最新研究显示TGR5参与新陈代谢的调节功能,使用TGR5激动剂诺米林(nomilin)或齐墩果酸(oleanolic acid)[7]具有显著的抗炎活性,所以靶向TGR5的药物开发对未来治疗一些与BA代谢性疾病提供了可能的方向[8].近年来BA的另一种主要的核受体类法尼醇x受体(farnesoid X receptor,FXR)引起了科学家的高度关注,它是一种以CDCA为主要配体的转录调节因子,在肠道中FXR通过抑制BA合成过程中的关键酶——胆固醇7α羟化酶(CYP7A1)参与BA的负反馈调节[9].另外,肠道FXR的激活诱导肠道中的Acetatifactor和拟杆菌产生石胆酸(LCA),LCA的升高激活TGR5,然后刺激肠L细胞分泌胰高血糖素样肽-1(GLP-1)以改善肝葡萄糖和脂质代谢[10].然而,也有研究表明,缺乏FXR基因的小鼠表现出明显的血浆胆固醇和TG升高[11],微生物相关的BA去共轭可以通过激活肠FXR信号传导和阻断肝FXR-SHP途径影响BA的肠肝循环,加速脂肪合成,诱导非酒精性脂肪肝病[12];同时更有实验证明了BA对糖异生中磷酸烯醇式丙酮酸羧化酶、葡萄糖-6-磷酸酶的基因表达的影响,而FXR的激活改善了糖尿病小鼠的高血糖和高血脂[13-16],所以FXR是一个新型的代谢综合征调控靶点.
2 BA代谢紊乱与肠道疾病
2.1 IBS IBS是一组持续或间歇发作,以腹痛、腹胀、排便习惯和(或)大便性状改变为临床表现,而缺乏胃肠道结构和生化异常的肠道功能紊乱性疾病.目前依据数据统计在我国以腹泻型为主[17].而研究发现,BA代谢的紊乱是IBS形成的原因之一.
有研究表明,鹅去氧胆酸和CA或是它们的缀合物可以激活肥大细胞[18].并且BA由于其洗涤剂的性质而对细胞膜中的磷脂有一定溶解作用,这和肥大细胞脱颗粒有关系[18].肥大细胞的细胞质颗粒中储存有大量的介质,受到刺激时可以分泌释放组胺、类胰蛋白酶等物质.其中,类胰蛋白酶激活位于肠神经和内脏传入神经上的蛋白酶激活受体2(protease activation receptor2,PAR2)导致黏膜的屏障作用降低,使得肠上皮细胞暴露于肠腔内颗粒的物理创伤以及各种微生物[19],也可向神经发出信号[20],导致持久的神经元过度兴奋,并有可能诱导内脏痛觉过敏[21,22].其他介质如干扰素-γ,肿瘤坏死因子-α(TNF-α),白细胞介素(IL)-1β,IL-4,IL-13和前列腺素E2也对细胞旁通透性有破坏作用[23,24].组胺通过作用于几种特定的受体(H1R、H2R、H3R)影响人体的黏膜下神经元兴奋和肌间胆碱能运动神经元,调节胃肠动力[21].
另外,阻塞胆汁流通可导致肠道中的细菌增殖并移位,但在给予BA后细菌的移位受到抑制,这表明BA能够抑制细菌活动[25].Kurdi等[26-28]通过研究不同浓度下BA对于细菌的抑制情况,发现游离BA抑制细菌生长可能使细菌膜内外pH差异消失而导致质子驱动的生物能量消失;或直接破坏细菌细胞膜.另外Inagaki等[25]人通过实验表明FXR在保护远端小肠免受细菌过度生长和由此导致的上皮屏障破坏中起着至关重要的作用,其在回肠中调节的几种基因的产物,包括Ang1,iNos和IL-18,可以建立抗菌作用.因此在BA分泌不足,肠道细菌过度生长时,可造成宿主肠道黏膜受损而导致细菌跨过肠壁屏障与下层组织直接接触,触发肠道免疫调节的变化.
2.2 UC 发达国家UC的发病率高于发展中国家,可能与西化的生活方式有关,特别是高动物蛋白和低复杂碳水化合物的饮食习惯.随着高脂肪、高肉类摄入的增加,肝脏合成和分泌的BA相应增加,可能对UC的发生产生影响.最新研究认为 UC的产生原因有肠道菌群失衡,上皮功能障碍和异常的免疫应答,而BA通过多种途径都了参与其中过程.
研究[29-31]通过实验证明在小鼠结肠中使用DCA后显示出肠道通透性的增加,而在使用神经阻滞剂六甲铵、阿托品后发现DCA引起的通透性变化降低,这说明DCA通过烟碱受体降低肠道上皮通透性.另有研究表明,BA通过肠道微生物代谢分解产生的BA盐通过诱导ERK磷酸化,促进囊泡成熟及运输,从而诱导肠嗜铬细胞分泌5-HT作用于肥大细胞上的5-HTR,继而促进UC肠道的运动[32-34].UC的主要标志就是黏膜炎症.通过对FXR缺乏的小鼠中促炎细胞因子的观察,表明FXR可以调节结肠黏膜内的促炎细胞因子(IL-1,IL-6,TNF-α等)的产生[35].在UC患者肠道中,肠神经胶质细胞激活和促炎介质,S100B、TNF-α、IL-1β、IFN-γ、iNOS的表达将诱导募集免疫细胞浸润肠道组织[36],降低细胞紧密连接中ZO-1表达水平,使得肠道的通透性明显增加而导致顶端α-Actin破坏[23].UC患者结肠黏膜FXR表达明显减少,有研究表明FXR与UC发病呈现负相关.同时由于BA抑制肠道细菌过度生长,以防止发生细菌移位.因此调整细胞中FXR的表达成为治疗UC的另一个新的方向.
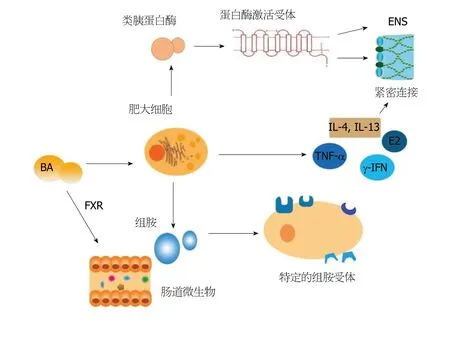
图1 胆汁酸与肠易激综合征相关性模式图.BA可以抑制肠道细菌过度生长,同样也可以刺激肥大细胞脱颗粒释放类胰蛋白酶,其可以刺激处于神经上的蛋白酶激活受体.这可以造成持续性的神经过度兴奋,也可以造成上皮细胞间紧密连接的损伤.另一种所释放的重要物质-组胺,可以通过三种特定的组胺受体调节神经和运动功能.同时,肥大细胞还释放多种物质,造成了上皮通透性的增加[19-21].
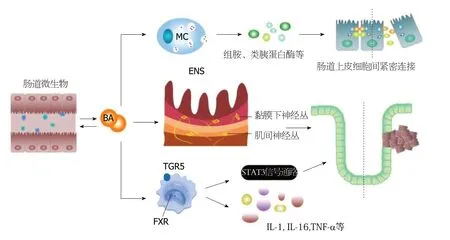
图2 胆汁酸与相关消化道疾病调控途径的关系示意图.肠道中的微生物将初级BA分解为次级BA,BA与肠道微生物有一定双向调控作用.BA激活肥大细胞脱颗粒,释放出组胺和类胰蛋白酶等物质,使肠道上皮细胞的紧密连接从而引起上皮通透性降低,引起IBS和UC;BA通过其两种主要的受体TGR5/FXR影响促炎细胞因子的释放.同时,BA通过STST3信号通路控制细胞癌变,其与乙酰胆碱部分类似的物理性质可以扰乱ENS对于细胞增殖正常的调控[18,42,44].
2.3 消化道肿瘤 消化道肿瘤是最常见的疾患,严重威胁到患者的生命健康.与正常人相比,结肠腺瘤患者大便BA水平明显升高,BA代谢总量及结肠对DCA的吸收能力也大大提高.许多研究已经证实,大便BA水平与结肠癌发病率存在显著的相关性.有报道证实在肠道中隐窝中的干细胞是肠癌的起源细胞[37,38],而肠道肿瘤的发生与BA代谢紊乱有一定的关系.一方面富含脂肪的饮食会增加肠腔内BA的含量,而BA本身具有一定的细胞毒性,将会导致膜损伤,并且产生活性氧(ROS)[39,40],使细胞处于氧化应激状态,诱导细胞凋亡[41],而这将引起DNA的损伤,增加基因的突变率,使细胞发生癌变的可能性明显增加;另一方面,BA可直接与TGR5和FXR结合,在一定程度上直接或间接的影响了肿瘤细胞的增殖.Cao等[42]通过免疫组化发现TGR5在上述肠干细胞中过度表达,而BA可通过TGR5受体促进细胞增殖[42].重要的是,许多报道显示信号转导及转录激活因子(signal transducer and activator of transcription,STAT3)在各种肿瘤细胞系如结肠癌、胃癌、肺癌、皮肤癌和乳腺癌等细胞中均被激活,JAK-STAT信号通路功能广泛,目前许多研究都集中于免疫反应与免疫调控.2005年的Cancer Cell[43]报道STAT5信号与白血病JMML的有密切关系,STAT分子的过量表达往往出现在很多恶性增殖性疾病中,而通过拮抗STAT3通路发现TGR5是胃癌细胞增殖和迁移的抑制因子.通过抑制STAT3的磷酸化及由脂多糖(LPS)或IL-6诱导的STAT3信号通路的转录活性来激活TGR5,结果表明TGR5通过抑制STAT3信号传导可抑制胃癌的增殖和迁移[42],FXR对BA合成所需的关键酶如CYO7A1和CYP8B1产生抑制作用[44],当体内需要大量合成BA以助消化时,FXR将会减少表达.目前实验发现具有高FXR表达的回肠显示出低的癌症发生率,而FXR缺乏可以增加肠道细胞增殖,促进肠道癌变,这都表明FXR与结肠肿瘤呈现负相关[45,46].因此,上述变化将减弱其抗癌作用,从而引起癌变.这些发现使得TGR5/FXR成为治疗肠道癌症的新的潜在靶点.值得关注的是大量研究表明,BA可以刺激毒蕈碱受体引起一系列变化[47-50],分子模拟表明BA与毒蕈碱受体的功能相互作用是由于其空间结构形状与Ach相似性[51].BA的这种性质使得其在大量分泌时产生乙酰胆碱样作用发挥对细胞增殖正常的调控功能.目前BA与肝癌、胆管癌的关系也引起了临床医务工作者的高度重视.
3 结论
次级BA是肠道微生物重要的代谢产物之一,参与调节肠道黏膜屏障,成为研究肠道免疫和肠道健康的热点.BA具有激活体内肥大细胞脱颗粒,抑制细菌过度生长,调节肠道通透性等作用,并通过Stat3和TGR5等多途径参与肠道内的免疫监视、免疫自稳、免疫调控,从而保证肠道正常生理功能;同时BA代谢紊乱可通过直接或间接途径影响肠道其他一些肠内分泌细胞,同时对肠道上皮造成一定损伤,从而诱发一些常见疾病.由此可见,BA为人体肠道名副其实的有力“晴雨表”.然而,BA在肠道免疫调节功能、肠道肿瘤的发生与发展当中的更多细节问题还有待发现、研究和探讨.

