长链非编码RNA GAS5在肿瘤中的研究进展
李明凯,詹浩炼,吴灵飞
李明凯,詹浩炼,吴灵飞,汕头大学医学院第二附属医院消化内科广东省汕头市 515041
核心提要: 本文就长链非编码RNAs(long non-coding RNAs,lncRNAs)生长阻滞特异性转录因子5(growth arrestspecial transcript 5,GAS5)在肿瘤中的研究进展作一综述.GAS5通过一系列复杂的机制参与多种肿瘤发生、进展、远处转移及化疗耐药的调控,该lncRNAs有可能成为肿瘤防治的新型靶标.
0 引言
近年,长链非编码RNAs(long non-coding RNAs,lncRNAs)在肿瘤中的作用受到广泛关注.有证据显示,lncRNAs参与了细胞多种生命活动并与肿瘤的发生及进展密切相关,本文结合国内外最新报道,对lncRNA生长阻滞特异性转录因子5(growth arrest-special transcript 5,GAS5)在各类肿瘤中的表达及作用作一综述.
1 LncRNA
LncRNA是一类长度在200 nt以上的非编码RNA,一般分为反义长非编码RNA、内含子非编码RNA、基因间长非编码RNA、启动子相关长非编码RNA、非翻译区长非编码RNA等5类,定位于细胞核或胞浆,具有明显的时空特异性和组织特异性表达特点.LncRNA通过与相关蛋白、DNA或RNA结合,主要以诱饵型(Decoyarchetype),信号型(Signalarchetype),指导型(Guidearchetype)及支架型(Scaffold-archetype)四种方式在表观遗传水平、转录水平及转录后水平调控靶基因的表达[1,2].LncRNAs在肿瘤中的作用是近年生命科学领域的研究热点.证据显示,lncRNAs参与细胞多种生命活动,如X染色体沉默、基因组印记、转录调控以及核内运输等重要调控过程,并与肿瘤的发生及进展密切相关[3].
2 LncRNAGAS5的发现和作用机制
GAS5属于lncRNA家族一员,最早由Schneider等于1988年在鼠NIH3T3纤维原细胞中因细胞生长停滞后其表达增加而被发现[4],目前认为与肿瘤生长[5],血管重塑,炎症反应等多种生物行为相关[6].在人体内,GAS5位于1号染色体长臂2区5带,全长4087 bp,由12个外显子及11个内含子组成,其中外显子虽然有较短的开放阅读框,但不具有编码蛋白质的能力.内含子能编码10个C/D框小核仁RNA(sno RNAs),是sno RNAs的宿主基因.GAS5除编码lncRNA外,还编码小核仁RNA(snoRNA),microRNA(miRNA)和PIWI相互作用的RNA(piRNAs).由于在7号外显子上存在可供选择的5'端供体拼接位点,所以GAS5可通过剪切、拼接产生两种成熟形式的lncRNA: GAS5a和GAS5b,其中GAS5b被认为是其主要转录物.LncRNA GAS5的1号外显子上有5'-TOP序列,该序列以胞嘧啶为起始,其生物学特征由5'-末端寡嘧啶RNA所决定.其转录受雷帕霉素(mTOR)信号通路及无义介导的mRNA降解通路(nonsense-mediated mRNA decay,NMD)调控.LncRNA GAS5表达水平在生长抑制(如饥饿状态下)细胞中有转录后积聚现象.人剪接GAS5的开放阅读框很小,它的终止密码子存在外显子中,其转录子通过NMD途径进行翻译.在快速生长的细胞,mTOR活性增加,5'-TOP RNA的活跃翻译促使GAS5 转录子通过NMD途径迅速降解,细胞内GAS5水平下降.相反,当细胞处于营养缺失而生长抑制时,mTOR活性降低,GAS5小开放阅读框翻译受阻,抑制其翻译使得通过NMD降解的GAS5减少,导致GAS5集聚而水平升高[5].此外,GAS5的表达亦受表观遗传调控,其启动子区域因高甲基化而呈低表达[7].
文献报道,GAS5主要通过三种形式参与细胞生物学行为的调控: (1)GAS5作为诱饵与具有转录功能的调节蛋白如转录因子结合,通过“滴定”的方式调节相关基因的转录激活或抑制.如GAS5可折叠成一个次级RNA结构,暴露出一个类似糖皮质激素受体结合元件的序列,通过与糖皮质激素受体的DNA结构域结合而抑制糖皮质激素介导的生理功能[5].Tani等[8]在人肾上皮细胞HEK293T中研究证实GAS5可通过竞争性结合糖皮质激素受体而影响糖皮质激素诱导的蛋白激酶及其下游信号分子cIAP、SGK1的表达[8],并参与细胞增殖、离子通道以及细胞生长的调控.(2)GAS5亦可作为miRNA或剪切因子的诱饵,模拟分子海绵的吸附作用,通过靶向结合miRNA而负性调控miRNA下游靶基因的表达.Gu等[9]通过计算机软件分析出GAS5存在miR-23a的靶向结合位点,通过RIP及双荧光素酶报告基因实验验证了GAS5与miR-23a的直接结合.在乳腺癌MDAMB-231细胞中发现GAS5可通过海绵样吸附作用降低胞内miR-23a水平,促使ATG3表达及自噬活化并抑制肿瘤细胞生长.(3)GAS5参与基因转译的调控.Kim等[10]报道,GAS5可负性调节eIF4E下游靶基因c-Myc的翻译,其机制与GAS5 lncRNA与c-Myc RNA直接结合、抑制c-Myc进入多聚核糖体有关.LncRNA GAS5在肿瘤中的表达及具体调控机制见表1.
3 GAS5与肿瘤的相关性研究
研究表明,LncRNA GAS5在大多数肿瘤如前列腺癌、肾细胞癌、卵巢癌、宫颈癌、骨肉瘤等中呈低表达,作为抑癌基因参与肿瘤发生、进展的调控[33-37],但随着研究的深入,也有学者报告GAS5在某些肿瘤如食管癌、肝癌中呈高表达,GAS5通过抑制凋亡扮演致癌基因角色[18,23],这种看似矛盾的结果说明了GAS5调控机制的复杂性,可能与肿瘤亚型、不同实验方法及细胞株生物学背景差异有关.总之,越来越多的证据表明GAS5与肿瘤易感性[23]、发生、发展、远处转移[11]及化疗耐药[15]密切相关,LncRNA GAS5有望成为潜在的肿瘤生物学标记物及治疗靶点.
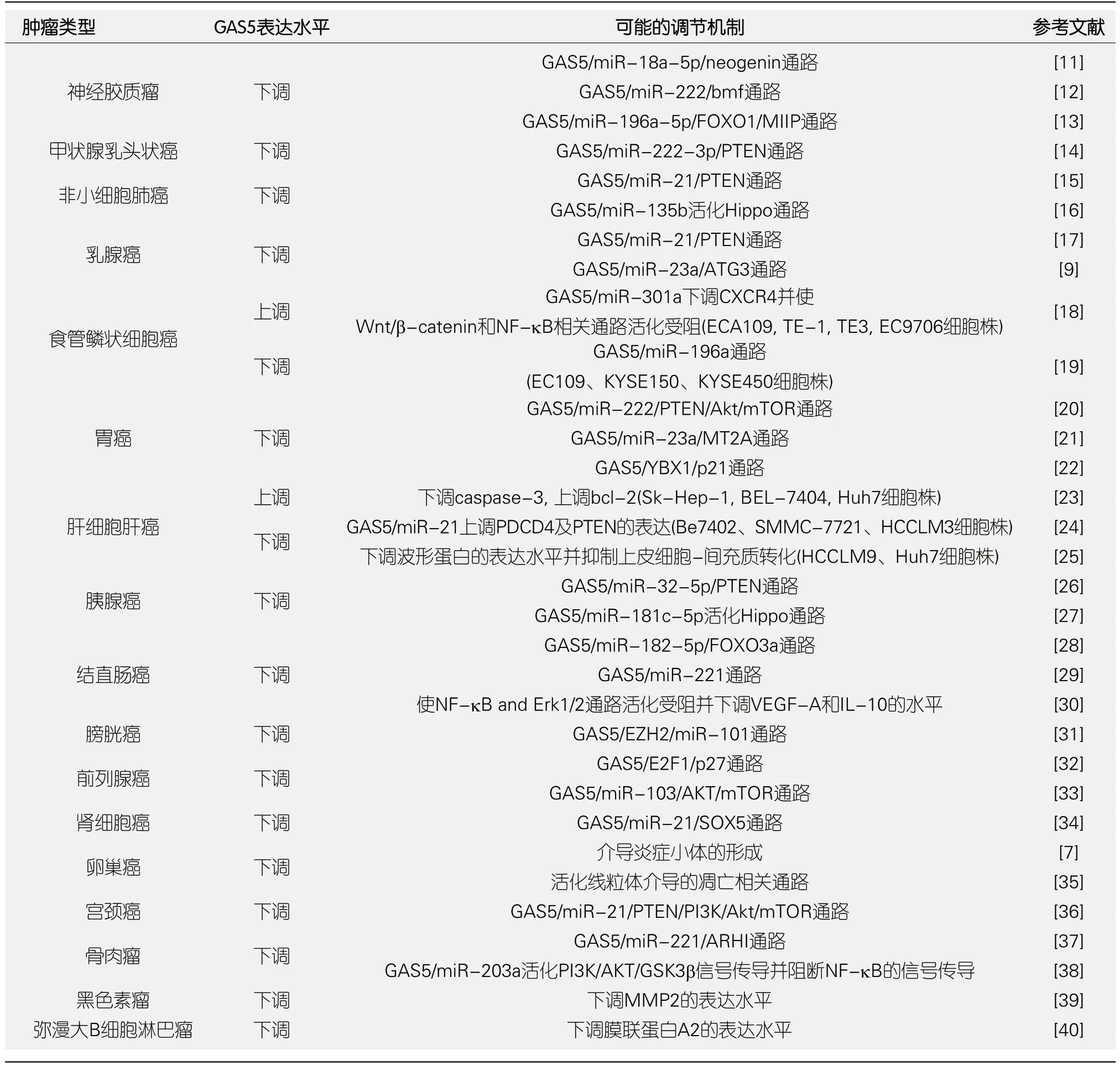
表1 LncRNA GAS5在各种肿瘤中的表达及可能机制
3.1 GAS5与神经系统肿瘤 Liu等[11]检测10例正常人脑组织及32例神经胶质瘤组织中GAS5的表达水平,结果显示在神经胶质瘤细胞U87、U251中GAS5表达水平明显低于正常脑组织.在U251细胞中过表达GAS5可使细胞周期阻滞于G1期的比例提高约10%,表明GAS5可抑制神经胶质瘤细胞的生长.裸鼠实验证实,过表达GAS5可使神经胶质瘤生长减慢约50%,而干扰GAS5的表达则产生完全相反的效果,提示GAS5在神经胶质瘤中扮演着抑癌基因角色.
研究表明GAS5的基因多态性与神经胶质瘤易感性有关.Yuan等[41]通过404位神经胶质瘤患者及820位健康中国人对比分析,证实GAS5启动子区5 bp插入/缺失多态位点rs145204276的Del/Del基因型比Ins/Ins基因型和Ins/Del基因型患神经胶质瘤的风险提高71%,作者认为若检测出GAS5多态位点rs145204276为Del/Del基因型,便应及时告知患者远离放射线等致癌环境并加强随访.Zhao等[12]发现GAS5可通过“海绵样”作用吸附miR-222,诱导肿瘤抑制因子Bcl-2修饰因子(bmf)和Plexin C1的表达从而抑制肿瘤细胞生长.体外裸鼠实验亦证实过表达GAS5且敲除miR-222后裸鼠体内肿瘤生长减缓且总体生存期延长,认为GAS5联合miR-222有望成为神经胶质瘤治疗的新靶点.Shen等[42]随访106名神经胶质瘤患者血清GAS5表达量,结果表明GAS5表达量越高患者2年生存率及总无病生存率越高,提示GAS5可作为胶质瘤病人的预后指标.
3.2 GAS5与头颈部肿瘤 Guo等[43]检测212名甲状腺癌及61名甲状腺良性肿瘤患者中GAS5表达,结果显示甲状腺癌细胞中GAS5呈低表达,且GAS5表达量与甲状腺癌病人TNM分期、淋巴结转移及预后有关.LncRNA表达量越低病人预后越差.在一项评估GAS5单核苷酸多态性对接受放化疗的鼻咽癌患者疗效和毒性研究中,Guo等[44]证实GAS5基因单核苷酸多态位点rs2067079 CT阳性的鼻咽癌患者放化疗后出现严重骨髓抑制及中性粒细胞减少风险增加;而GAS5单核苷酸多态位点rs6790具有基因效应,rs6790 GG型、rs6790 GA型及rs6790 AA型三组患者放化疗后出现骨髓抑制的风险逐渐减少,作者认为GAS5基因多态性位点rs2067079和rs6790可作为评估鼻咽癌放化疗后发生骨髓抑制风险的预测指标.
3.3 GAS5与呼吸系统肿瘤 研究表明,lncRNA GAS5在非小细胞型肺癌(non-small cell lung cancer,NSCLC)中可吸附miR-135b而抑制肿瘤细胞的增殖并增强肿瘤对放疗的敏感性,敲除GAS5则可促进NSCLC生长[16].在NSCLC细胞对顺铂(Cisplatin,DDP)耐药的研究中,Cao等[15]证实NSCLC耐药株miR-21呈高表达而抑癌基因PTEN低表达.GAS5可通过结合miR-21而上调PTEN,使肺癌患者对DDP化疗敏感性提高.血清中GAS5低表达及miR-21高表达还与患者不良预后有关,促进GAS5表达有望提高NSCLC患者放化疗的敏感性并取得更高的远期生存率.
3.4 GAS5与乳腺癌 Arshi等[45]检测23例乳腺癌患者肿瘤组织及15例正常乳腺组织中GAS5表达,结果显示GAS5在各个年龄段肿瘤组织中的表达均低于正常乳腺组织,而且越年轻的患者肿瘤组织中GAS5表达量越低,预后越差.Pickard等[46]发现干扰乳腺癌细胞株MCF-7和T-47D中的GAS5表达后,细胞凋亡减少.多元回归分析显示,在细胞损伤因素如紫外线、5-Fu刺激下,乳腺癌细胞内GAS5水平与细胞凋亡程度呈正相关,与细胞生长活性呈负相关.过表达GAS5可促进三阴性乳腺癌细胞及雌激素受体阳性癌细胞凋亡,提示GAS5在乳腺癌发生及进展过程中起抑癌作用.
Li等[17]在曲妥珠单抗(trastuzumab)耐药的乳腺癌SKBR-3/Tr细胞及乳腺癌组织中通过lncRNA微阵列分析发现GAS5呈低表达.GAS5通过“分子海绵”吸附miR-21,上调抑癌基因PTEN(miR-21的内源靶标)的表达而抑制乳腺癌进展.作者证实乳腺癌患者mTOR活化与GAS5减少有关.使用mTOR抑制剂提高lncRNA GAS5水平有助于加速激素受体阳性肿瘤细胞的凋亡[47].Esmatabadi等[48]研究表明外源性细胞毒药物如姜黄素(Curcumin,DNC)亦可上调GAS5的表达并提高疗效,而沉默GAS5则降低了姜黄素的化疗效果,表明GAS5参与化疗耐药的调控.
3.5 GAS5与消化系统肿瘤 Wang等[19]证实在人食管癌EC109、KYSE150、KYSE450细胞中GAS5呈低表达.在86例食管癌组织中GAS5的表达水平也低于癌旁正常组织,GAS5表达量与肿瘤病理组织学分级及TNM分期有关,越晚期肿瘤GAS5表达越低.而过表达GAS5则可抑制肿瘤细胞生长.但也有不同的报道结果.Li等[18]在四株食管癌细胞中发现ECA109、EC9706二株细胞GAS5表达量高于正常食管细胞(Esophageal cell,SHEE),而另外二株TE-1、TE-3细胞GAS5表达量与SHEE无差异.在高表达GAS5的ECA109细胞中,干扰GAS5后肿瘤细胞存活率降低,迁移能力下降,Bcl-2下调,细胞凋亡增加,显示GAS5在不同的食管癌细胞株中发挥不一样的作用.
在胃癌的研究中,Sun等[49]检测89例胃癌及癌旁正常组织GAS5表达量,发现肿瘤组织中GAS5呈低表达,且GAS5表达越低,肿瘤进展越快,预后越差.Li等[50]对比分析853胃癌患者及954名健康人后发现,GAS5的rs145204276的Del/Del基因型的人患胃癌风险较Ins/Del基因型或Ins/Ins基因型的人低,胃癌患者中若GAS5的rs145204276呈Del/Del基因型,肿瘤体积较另外两型小,而且淋巴结转移、远处转移的发生率明显降低,GAS5的rs145204276的Del/Del基因型被视为胃癌的保护因素及肿瘤患者预后良好的指标,为此,GAS5的rs145204276的Ins/Del基因型或Ins/Ins基因型的人需加强随访.此外,Zhang等[7]研究结果表明GAS5的表达受表观遗传调控并与化疗耐药有关.在阿奇霉素耐药的胃癌组织中GAS5启动子区高甲基化而呈低表达.采用甲基转移酶抑制剂5-AZA-dC处理耐药肿瘤细胞后GAS5表达上调,耐药的胃癌细胞凋亡率升高,显示GAS5可提高胃癌细胞化疗药物敏感性.
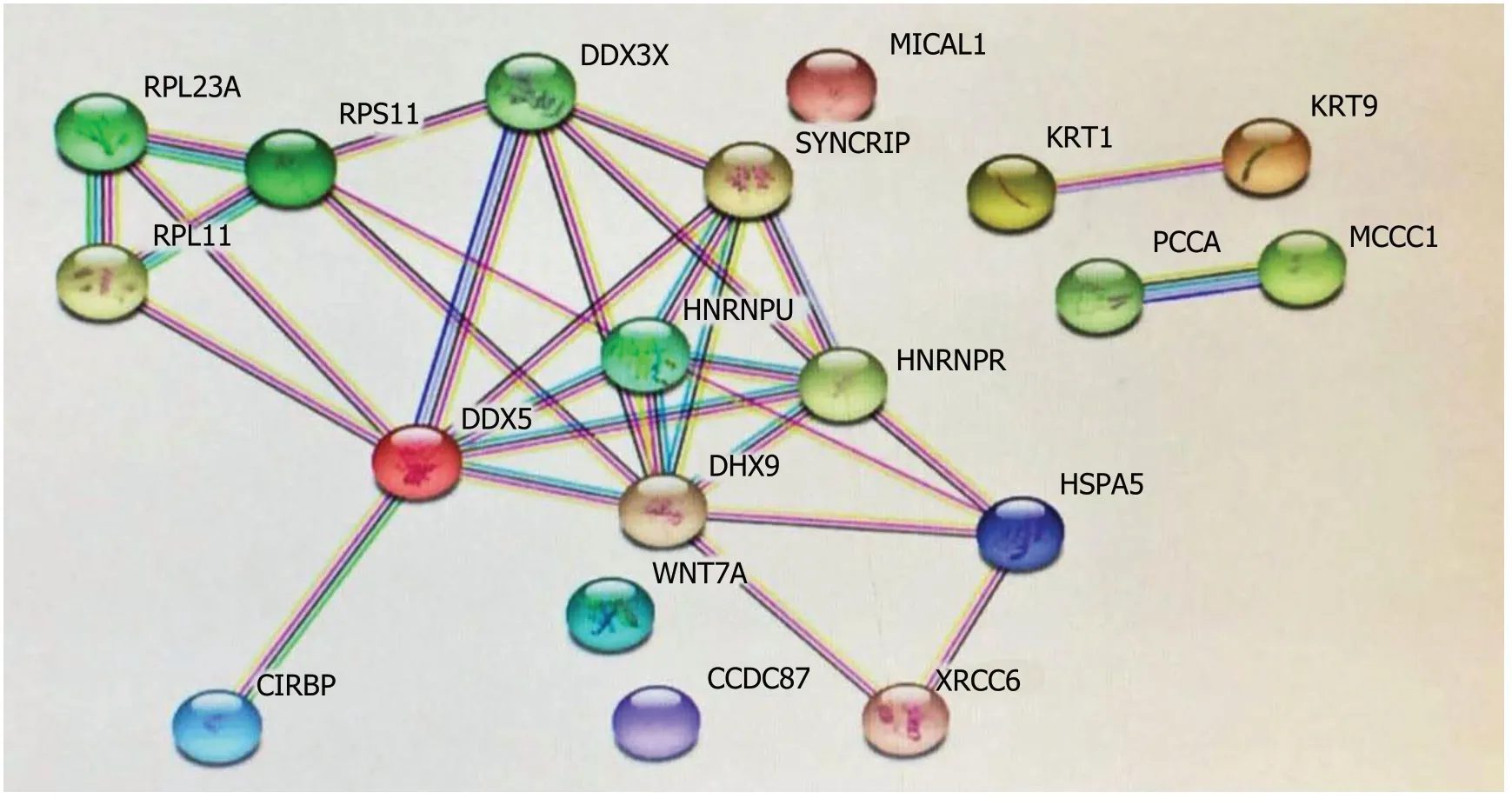
图1 生长阻滞特异性转录因子5互作蛋白String分析结果.
在肝癌研究中,Tu等[51]检测71例肝癌组织GAS5表达并与癌旁正常组织比较,结果GAS5在肿瘤组织中明显呈低表达.GAS5的表达水平与肿瘤大小及TNM分期呈负相关.Kaplan-Meier生存分析表明低表达GAS5的患者预后不良.作者认为GAS5可作为肝癌的独立预后指标.Chang等[10]在肝癌HCCLM9、Huh7细胞研究中亦证实,GAS5可升高E-钙黏蛋白水平、减少波形蛋白合成及上皮细胞间充质转化,从而抑制肝癌生长及转移.临床肝癌患者中GAS5低表达组肿瘤恶性程度高,预后差,而GAS5高表达组患者预后较好,认为GAS5不仅参与肿瘤生长、侵袭及转移的调控,还可作为独立的预后指标.我们课题组在肝癌HepG2细胞研究中发现,采用短发夹RNA(shRNA)方法干扰组蛋白去甲基化酶(KDM5C)可上调GAS5表达,表明HepG2细胞GAS5启动子区呈高甲基化状态,GAS5转录亦受表观遗传调控.此外,过表达GAS5可抑制HepG2的增殖和迁移,表明它具有抑癌功能[52].我们进一步通过RNA pull-down及MS质谱实验筛选出19种GAS5相互作用蛋白,蛋白质互作网络分析详见图1,GAS5如何调控相关蛋白的表达并发挥其作用有待进一步探讨.
有趣的是,Tao等[23]在肝癌Sk-Hep-1,BEL-7404,Huh7细胞研究中发现,GAS5过表达可促进肿瘤生长,而siRNA干扰GAS5可促进肿瘤细胞凋亡,显示GAS5在某些肝癌细胞株中具有致癌作用.对中国人群GAS5启动子区域中rs145204276多态性与肝癌易感性进行Logistic回归分析,证实rs145204276的del/del基因型(等位基因缺失)患者GAS5表达水平较高,患肝癌的风险较ins/ins型和ins/del型高;采用焦磷酸测序显示rs145204276的基因型与GAS5启动子区的甲基化状态亦有关,显示表观遗传机制在GAS5的表达中发挥作用.
Gao等[27]在胰腺癌PANC-1、BxPC-3细胞中证实GAS5表达下调,而miR-181c-5p表达上调.过表达GAS5明显抑制肿瘤细胞生长,而敲低GAS5显示出相反的结果.进一步探讨其机制,发现miR-181c-5p可通过抑制Hippo信号通路促进胰腺癌细胞耐药.GAS5通过负性调节miR-181c-5p,活化Hippo通路而抑制肿瘤细胞生长,增加耐药细胞对吉西他滨和5-FU的化疗敏感性.
在53例结肠癌的研究中,Yang等[53]的实验数据表明GAS5在肿瘤组织中呈低表达,GAS5的表达水平与肿瘤大小及TNM分期呈负相关.GAS5水平越低,患者预后越差.在体外实验中,结肠癌HCT-116、SW480细胞过表达GAS5后,细胞周期阻滞于G0/G1的比例提高了约20%,细胞增殖能力下降,集落数明显减少;而干扰GAS5后细胞增殖能力增强,显示GAS5在结肠癌中发挥抑癌作用.
3.6 GAS5与泌尿系肿瘤 Wang等[31]在膀胱癌T24和EJ细胞研究中证实,过表达GAS5能与E2F4直接作用并招募E2F4至EZH2启动子区,抑制EZH2表达并通过活化caspase-3促进细胞凋亡.Zhang等[54]对82例膀胱癌患者进行研究,qRT-PCR结果显示肿瘤组织中GAS5表达量明显低于正常组织且与肿瘤病理分级相关.该课题组还发现在膀胱癌J82和T24细胞中过表达lncRNA GAS5可抑制肿瘤细胞生长并降低化疗耐药,显示GAS5作为化疗增敏剂的潜在价值.
GAS5还与肾细胞癌的发生及进展有关.过表达GAS5在肾细胞癌中起抑癌作用[55],GAS5通过分子海绵吸附miR-21,上调miR-21下游靶基因SOX5的表达而增强肾细胞癌对索拉非尼的敏感性[34].
3.7 GAS5与妇科肿瘤 Cao等[56]检测102例人宫颈癌组织及癌旁正常组织GAS5表达量后发现,肿瘤组织中lncRNA GAS5呈低表达,离体及在体实验均证实GAS5可抑制宫颈癌细胞的增殖、侵袭及转移.Kaplan-Meier生存分析和log-rank试验结果表明低表达GAS5的宫颈癌患者总体生存时间更短,Cox回归分析显示,GAS5表达水平与淋巴结转移及FIGO分期一样,均可作为疾病的独立预后指标.GAS5还参与宫颈癌化疗耐药的调控.Wen等[36]证实过表达GAS5通过直接靶向降低miR-21而增强宫颈癌SiHa细胞对铂类化疗药物的敏感性.
Li等[57]在卵巢癌研究中证实肿瘤组织中GAS5表达明显减少,且GAS5水平降低的程度与肿瘤体积、侵袭深度、TNM分期呈反比.GAS5水平越低其无病生存率及总生存率越短.将具有稳定表达GAS5的SKOV3细胞注射到裸鼠中可抑制卵巢癌细胞增殖,其机制与调节细胞周期蛋白D1,p21和凋亡蛋白酶激活因子1的表达有关.
3.8 GAS5与血液系统肿瘤 Dousti等[40]从人类基因组学数据库中找出189种已知的和弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)有关的lncRNA,将它们输入cBioPortal数据库进行转录组学分析,结果显示40个DLBCL患者中83%存在lncRNA表达异常,其中lncRNA GAS5表达异常的发生率最高.运用NPInter数据库分析发现GAS5可靶向结合并负性调控癌基因膜联蛋白A2(Annexin A2)的表达,而细胞内游离的AnnexinA2的高水平与多种血液肿瘤的侵袭、转移有关,显示GAS5通过抑制Annexin A2发挥抗癌作用.
4 结论
肿瘤发生的分子机制是复杂的生物学过程,可能涉及逐步积累基因突变、基因组不稳定性、表观遗传变化及蛋白质编码和非编码基因的异常表达.LncRNA GAS5的研究为我们理解生物体内蛋白质翻译过程的调控以及肿瘤发生、进展提供了全新的视觉.临床上,靶向lncRNA作为新的诊断生物标志物和治疗方法还将需要更广泛深入地研究.尽管如此,微创性、病人的依从性和有效性亦应一并考虑.目前,有研究表明肿瘤患者多种lncRNA包括GAS5均可在外泌体中进行检测并可同步反映其体内的变化.因此,通过外泌体来动态监测体内GAS5水平变化应有广阔前景[58].相信随着高通量测序、基因芯片等基因工程技术的进步以及临床指标大数据的相关性研究,GAS5作为癌症治疗的靶点及新型肿瘤分子指标将在肿瘤防治中发挥重要作用.

