急性脑梗死患者血清miR-21和HIF-1α、VEGF-A的表达关系及临床意义
向 伟 魏新宇 余 彪
脑梗死(cerebral infarction),又称缺血性脑卒中,是一常见的脑血管疾病[1]。我国脑梗死的发生率、致残率、病死率极高,且脑卒中发病年龄呈年轻化趋势[2]。由于脑血管疾病病理机制复杂、病情变化迅速,迄今仍缺乏有效的临床治疗手段。近来研究发现,血液中的某些生物标志物能够反映脑梗死病理生理变化情况,且它们在血液中表达水平的变化可能影响脑血管病的疾病进展、严重程度及疾病转归,在脑血管疾病的早期诊断、病因识别、个体化治疗中具有重要临床价值[3]。本研究旨在评估急性脑梗死患者血清miR-21和缺氧诱导因子(HIF)-1α、血管内皮生长因子(VEGF)-A的表达变化及关系,以期为急性脑梗死的临床诊疗提供一定参考价值。
材料与方法
1.一般资料:选取笔者医院2016年5月~2017年5月于神经内科治疗的急性脑梗死患者63例作为研究组,其中男性36例,女性27例,患者年龄49~83岁,平均年龄61.59±8.13岁。纳入标准:①急性脑梗死诊断符合第4次全国脑血管病会议急性脑梗死的临床诊断标准;②所有患者均经头颅CT或头颅MRI确诊;③患者均为首次发病入院;④所有患者均知情同意[4]。排除标准:①重大手术或有严重外伤;②急性脑卒中病史;③神经系统功能障碍;④恶性肿瘤患者。另选同期于笔者医院体检健康者60例作为对照组,其中男性34例,女性26例,年龄48~80岁,平均年龄58.96±9.21岁。本研究经笔者医院医学伦理学委员会批准。
2.标本采集:脑梗死患者分别于发病后1、3、5、7、10天抽取空腹静脉血3ml,对照组清晨抽取空腹静脉血3ml。采集血样置于EDTA抗凝管中,3000r/min离心10min后,分离血清,于-80℃冰箱中保存。
3.脑梗死患者评分标准及分组:所有脑梗死患者于发病后2~3天内进行头颅CT或MRI检查,根据Pullicino公式,计算脑梗死灶面积[5]。脑梗死面积=长×宽×阳性扫描层数×π/6,其中长为梗死灶最大长径,宽为与长径垂直的直径。根据脑梗死病灶面积,将患者分为3组:梗死面积<4cm3,记为小梗死组,31例;梗死面积4~10cm3,记为中梗死组,21例;梗死面积>10cm3,记为大梗死组,11例。
4.荧光实时定量PCR法(RT-PCR):采用荧光实时定量PCR法(RT-PCR)检测血清中miR-21表达水平。应用RNA提取试剂盒(美国Digma-Aldrich公司)提取血清总RNA,采用反转录试剂盒(日本TaKaRa公司)进行反转录。U6 snRNA作为内源对照。本研究所有引物设计均交由上海生工公司合成。使用ABI PCR System7300扩增仪进行PCR反应,根据基因特异性引物分析miR-21表达。用2-ΔΔCt法计算miR-21相对表达水平。PCR反应体系:使用50μl PCR反应体系,10X Buffer 5μl,2.5mmol/L dNTP 4μl,,taq酶0.5μl,Pmix2.5μl,上游引物和下游引物各1μl,ddH2O 36μl。PCR反应条件:94℃预变性2min,随后于94℃变性25s,60℃退火35s,72℃延伸20s,进行31个循环扩增PCR产物。取10μl PCR产物,应用Bio-Rad全自动电泳仪(USA)进行2%琼脂糖凝胶电泳,EB染色。miR-21扩增引物设计如下:上游引物:5′-GACTGAGTACAAACTGGTGG-3′;下游引物:5′-GGGCCTCACCTCTATGGTG-3′。
5.酶联免疫吸附(ELISA):应用酶联免疫吸附法检测血清HIF-1α与VEGF-A浓度。HIF-1α与VEGF-A特异性ELISA检测试剂盒购自云南精赛顿生物制剂公司。所有操作严格按照试剂盒说明书进行。详细步骤如下:首先从平衡至室温的盒子中取出样品,其余部分置于4℃冰箱中。除空白孔外,将样品(100微升/孔)以及不同浓度的标准物质(100微升/孔)分别加入孔中,反应孔用胶纸密封。37℃温育浴90min后,将板洗涤4~6次。之后,用纸交将板干燥。除空白孔外,所有其他孔与生物素抗体(100微升/孔)混合,37℃反应30min。将板洗涤4次后,进行避光孵育20min。之后,每个孔依次加入100微升终止反应液混合以结束反应。将反应板放入酶标仪(BioTek Instruments,Burlington,VT)中,测量A450值。根据样品的A值对HIF-1α与VEGF-A含量进行计数,然后乘以样品的稀释比,获得样品HIF-1α与VEGF-A的实际浓度。将平均值作为相对数量。
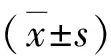
结 果
1.两组受试者一般临床资料比较:两组患者性别、年龄、吸烟、喝酒等一般资料以及临床血液生化指标比较,差异无统计学意义(P>0.05,表1)。

表1 两组受试者一般临床资料比较
2.两组受试者血清miR-21、HIF-1α和VEGF-A水平变化比较:与对照组比较,在1、3、5、7、10天,研究组血清miR-21、HIF-1α、VEGF-A表达水平显著升高,差异有统计学意义(P<0.05)。在急性脑梗死发作后1天,患者血清miR-21、HIF-1α、VEGF-A表达水平达到最高,随着发病后时间的延长(1天→3天→5天→7天→10天),研究组患者血清miR-21、HIF-1α、VEGF-A表达水平均逐渐降低。详见表2。
3.急性脑梗死患者不同体积组血清miR-21表达水平变化:研究组患者在急性脑梗死发作后的1、3、5、7、10天,与小梗死组比较,中梗死组患者血清miR-21表达水平显著增加,差异有统计学意义(P<0.05);与中梗死组比较,大梗死组患者血清miR-21表达水平均显著增加,差异有统计学意义(P<0.05,表3)。
4.急性脑梗死患者不同体积组血清HIF-1α表达水平变化:研究组患者在急性脑梗死发作后的1、3、5、7、10天,与小梗死组比较,中梗死组患者血清HIF-1α表达水平显著增加,差异有统计学意义(P<0.05);与中梗死组比较,大梗死组患者血清HIF-1α表达水平显著增加,差异有统计学意义(P<0.05,表4)。

表2 两组受试者血清miR-21、HIF-1α和VEGF-A水平变化比较

表3 急性脑梗死患者不同体积组血清miR-21表达水平变化

表4 急性脑梗死患者不同体积组血清HIF-1α表达水平变化
5.急性脑梗死患者不同体积组血清VEGF-A表达水平变化:研究组患者在急性脑梗死发作后的1、3、5、7、10天,与小梗死组比较,中梗死组患者血清VEGF-A表达水平显著增加,差异有统计学意义(P<0.05);与中梗死组比较,大梗死组患者血清VEGF-A表达水平显著增加,差异有统计学意义(P<0.05,表5)。

表5 急性脑梗死患者不同体积组血清VEGF-A表达水平变化
6.急性脑梗死患者血清miR-21和HIF1-α、VEGF-A水平的相关性分析:Spearman相关性分析显示,研究组患者发病后,血清miR-21与HIF-1α水平呈明显正相关(r=0.515,P<0.05),miR-21与VEGF-A水平呈明显正相关(r=0.553,P<0.05),HIF-1α与VEGF-A水平呈明显正相关(r=0.726,P<0.05,图1)。

图1 急性脑梗死患者血清miR-21和HIF-1α、VEGF-A水平的相关性分析
讨 论
微小RNA(miRNA)是长21~25nt的非编码RNA分子,其通过靶向结合mRNA的3′非翻译区(3′UTR)来抑制转录和转录后水平的基因表达,从而参与调节人类胚胎发育、细胞分化、代谢、肿瘤形成等多种生物学过程。miRNA具有广泛的基因调节能力,每种miRNA可以调控多个靶基因,同样,每种mRNA也可以受多种miRNA调节,这种复杂的调节网络使miRNA表现出多样性功能,从而参与多种信号转导通路。最近研究发现,在脑血管疾病的发生、发展过程中,miRNA广泛参与动脉粥样硬化、脑缺血缺氧耐受、脑水肿、神经保护等多种病理生理过程[6,7]。
大量动物和临床研究发现,miRNA表达谱在发生脑卒中的脑组织和血液中呈现异常变化,提示miRNA参与脑卒中的病理生理过程。Jeyaseelan等[8]发现,大鼠缺血再灌注后脑组织中多种miRNA表达谱发生特异性变化,且在缺血脑组织中高表达的miRNA可在血液中检测到,其变化与脑缺血损伤的生物标志物基质金属蛋白酶-9变化一致。Liu等[9]发现,成年大鼠脑梗死后,脑组织和血清内miR-298、miR155、miR3256等多种miRNA表达水平均显著上调或下调。这些结果均显示,脑梗死后,血液内miRNA和脑组织内miRNA变化一致,即血清中miRNA的变化可以反映脑组织中miRNA变化,提示,血清miRNA水平的变化可以作为脑梗死的潜在新型生物标志物。Gan等[10]发现,脑梗死患者血液中miR-145表达水平明显增加,高表达的miR-145通过促进神经嵴干细胞向血管平滑肌细胞表型转化,从而促进血管内皮细胞重建,并提出miR-145可能成为第1个缺血性脑卒中的潜在血清生物标志物。Zeng等[11]发现,急性脑梗死患者外周血miR-210表达水平显著降低,且在患病后第7天和14天变化明显,并提出miR-210动态变化与患者脑梗死严重程度有关。Tsai等[12]发现,缺血性脑血管疾病患者的血清中miR-21表达水平显著升高,可能作为预测脑血管疾病的潜在生物标志物。与此一致,本研究发现急性脑梗死患者血清miR-21水平显著增加,血清中miR-21的增加可能预示着急性脑梗死的发生。在脑梗死急性期的同一时间点,随着脑梗死面积的增加,miR-21表达水平逐渐增加,这提示miR-21在急性脑梗死患者血清中表达水平的增加与疾病严重程度有关,有可能作为急性脑梗死的潜在生物标志物。
缺氧诱导因子(HIF-1)是目前发现唯一在特异性缺氧状态下发挥活性的转录因子。研究表明,脑梗死的病理过程中,脑组织由于缺氧而产生较高水平HIF-1,HIF-1进一步与其亚单位结合,形成有活性的HIF-1α并分泌致血液中,使外周血HIF-1α水平增加,并激活相关靶基因的转录,使血管内皮生长因子(VEGF)及其他下游因子表达水平增加,从而修复损伤血管的内皮,促进新生血管形成,并刺激红细胞再生[13]。HIF-1作为低氧应答时基因表达和恢复内环境稳定的调节中心,脑梗死后其表达水平的增加对机体起积极保护作用,以减轻缺血、缺氧后的不良反应[14~16]。VEGF作为HIF-1转录因子的下游靶基因,在新血管形成之前对神经组织起直接保护作用。研究发现,机体缺氧时,HIF-1α激活VEGF的转录,从而使VEGF的生物活性增加。在缺血导致的脑组织损伤中,VEGF活性的增加能够促进内皮细胞的增殖、迁移和新血管生成[17,18]。这些研究提示,在脑梗死后,HIF-1与VEGF在分子水平上的变化,使机体对缺血环境产生适应性变化,以减轻缺血、缺氧对机体的损伤。
李建军等[19]发现,急性脑梗死患者发病后1、3、7天,血清HIF-1α和VEGF水平均显著增加。与此一致,廖彬等[20]发现,急性脑梗死患者发病后1天,HIF-1α和VEGF表达水平达到高峰,在3、5、7、14天,HIF-1α表达水平虽逐渐降低,但仍显著高于对照组。本研究发现,急性脑梗死患者发病1、3、5、7、10天后,血清HIF-1α和VEGF-A表达水平均显著高于对照组,与以往研究结果一致。
谭新杰等[21]发现,在成年大鼠局灶性脑梗死的治疗中,HIF-1α基因治疗能够通过修复和保护脑组织神经元,降低脑梗死面积而发挥急性脑梗死治疗作用。Yang等[22]发现,VEGF表达水平的降低能够使脑缺血引起的梗死体积增加,并提出内源性VEGF在缺血脑组织中表达水平的增加与神经保护作用有关。这些研究提示脑梗死面积与HIF-1α和VEGF表达水平的变化有关。本研究发现,在脑梗死急性期的同一时间点,脑梗死面积越大,HIF-1α和VEGF表达水平越高,提示脑梗死病灶面积可能影响血清HIF-1α和VEGF的表达水平。进一步进行相关性分析发现,HIF-1α与VEGF-A呈明显正相关。这些结果表明,梗死面积越大,脑细胞及周围脑组织水肿程度和缺氧状况越严重,从而导致HIF-1α被大量激活,患者血清HIF-1α含量上升越明显,进而刺激其下游靶点VEGF的转录,使VEGF-A表达水平逐渐增加。
大量研究已证实miR-21与缺氧有关[23]。Song等[24]发现miR-21过表达能够使PTEN降低、p-Akt升高,随后使HIF-1α表达增加,而miR-21抑制则导致PTEN升高、p-Akt降低,从而使HIF-1α降低,推断HIF-1α表达水平的上调与miR-21的过表达有关。与此一致,Liu等[25]发现在缺氧条件下,miR-21通过调控PTEN/Akt信号途径调节HIF-1α表达。陈惠军等[26]发现在缺血缺氧情况下,miR-21表达水平上调,使HIF-1α表达上调,从而发挥脑组织保护作用。本研究进行相关性分析发现,在急性脑梗死患者中,miR-21与HIF-1α及VEGF-A表达水平均呈显著正相关。结合过往研究推测,在脑梗死急性发作期,患者脑组织出现缺血缺氧情况,miR-21表达的上调使HIF-1α表达水平增加,HIF-1α作为转录因子,激活VEGF基因转录,从而使VEGF表达水平增加,从而使机体对缺血环境产生适应性变化。
综上所述,在急性脑梗死患者血清中miR-21、HIF-1α和VEGF表达水平的增加与疾病严重程度有关,且三者在急性脑梗死中存在相关性,可作为判断脑损伤的潜在生物学标志物。

