通过调节GRP78/CHOP抗内质网应激研究红花注射液治疗急性脑梗死的作用机制
秦秀德,张丽娜, 刘 琛, 车若梅, 李斯琪,李新悦, 赵 勃, 张国伟*
(1.深圳市中医院/广州中医药大学第四临床医学院, 广东 深圳 518000;2.河北大学中医学院, 河北 保定 071002)
脑卒中是由脑血管阻塞或破裂引起的急性疾病,2013年卒中是第二大常见死因和第三种最常见的残疾原因。在全球范围内,2013年有近2570万中风幸存者(71%为缺血性脑卒中),650万中风死亡(51%死于缺血性脑卒中)[1]。2015年,平均每3 min 45 s,就有1人死于脑卒中。在美国每19例死亡中约有一例死于脑卒中[2]。缺血再灌注损伤是脑血管疾病中的重要研究方向,内质网应激(endoplasmic reticulum stress, ERS)在缺血再灌注损伤中可能处于主要地位[3]。强烈或长时间的ERS使机体内GRP78 (glucose regulated protein, GRP78)高度表达,因此GRP78的表达水平可以作为ERS发生的标志之一[4]。CHOP (C/EBP homologous protein, CHOP)是ERS特异的转录因子, 是由抗凋亡向促凋亡转换的重要信号分子[5],因此,CHOP一定程度上可反映ERS介导的细胞凋亡水平[6]。超敏C反应蛋白(high-sensitivity C-reactive protein, CRP)是主要在肝脏内合成的一种急性反应时相蛋白,为炎症的指标,CRP与脑卒中风险增加有关系[7],因此研究CRP为缺血性脑卒中预防和治疗研究开辟了新的领域。
红花注射液具有抗缺血再灌注损伤与调节炎症反应的作用[8-9]。依达拉奉注射液是一种强效的轻自由基清除剂及抗氧化剂,脑梗死急性期患者给予依达拉奉,能有效改善神经功能缺损,故以其作为实验的阳性对照组[10]。大脑中动脉栓塞(MCAO)模型与人类急性脑梗死病理生理过程最为接近,是目前用来评价急慢性脑缺血再灌注损伤药物最为经典的模型[11]。研究红花注射液对大鼠MCAO(middle cerebral artery occlusion, MCAO)模型脑组织内质网应激相关分子 GRP78、CHOP的表达以及超敏C反应蛋白的影响,探讨通过ERS途径的红花注射液治疗急性脑梗死调节炎性反应的作用机制,可为红花注射液在防治脑梗死临床应用研究提供一定的实验依据。
1 材料和方法
1.1 实验材料
SPF级雄性SD大鼠48只,体重230~270 g,10周龄,由军事医学科学院实验动物中心[SCXK 2014-0004]提供。所有大鼠在标准环境条件下保持3 d(温度 (23±2)℃,湿度(55±5)%和12 h/12 h光照/黑暗循环),大鼠可自由饮水和进食。所有动物实验饲养、手术、取材均在河北大学医学实验中心动物实验设施内 [SYXK(冀)2012-0048]进行,均按照“河北大学实验动物护理与使用原则”进行处理,并经动物保健机构委员会批准[IACUC-2016001]。
1.2 主要试剂与仪器
兔抗GRP78多克隆抗体、鼠抗CHOP单克隆抗体(碧云天生物技术有限公司);Trizol试剂盒、Quant cDNA第一链合成试剂盒(天根生化科技北京有限公司);SYBR®Premix Ex TaqTMII(宝生物工程大连有限公司);辣根酶标记工作液、DAB显色剂(北京中杉金桥生物技术有限公司);大鼠超敏C反应蛋白试剂盒(上海源叶生物科技有限公司);2,3,5-氯化三苯基四氮唑(北京博奥拓科技有限公司);红花注射液(雅安三九药业有限公司);依达拉奉注射液(国药集团国瑞药业有限公司);荧光定量PCR仪(Applied Biosystem 7500 Fast)。

注:(a) 红花注射液(批号:150903010) (b) 最高点显示为羟基红花黄色素A的值。图1 红花注射液及指纹图谱Note. (a) Safflower injection (Batch Number:150903010)(b) Chemical fingerprint peak 9(S), hydroxysafflor yellow A.Figure 1 Safflower injection and its chemical fingerprint
1.3 实验方法
1.3.1 动物模型建立
参考文献制作大鼠MCAO模型[12],雄性SD 大鼠,在 24℃~26℃室温的实验室中饲养 3 d,大鼠于晨 8 时给予食物 20 g,自由饮水。手术大鼠术前禁食 12 h,自由饮水,称重,采用改良线栓线法制备脑缺血大鼠模型。40 mg/kg戊巴比妥钠行腹腔注射麻醉,将大鼠四肢和牙齿用棉线绳固定好,消毒,正中切口,钝性分离颈部肌肉,分离颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)、颈内动脉(internal carotid artery, ICA),结扎 ECA 远心端、CCA 近心端。动脉夹夹闭 ICA,由 CCA 插入 MCAO 栓线,向颈内动脉(ICA)推进,至大脑中动脉(middle cerebral artery, MCA),导致局灶性脑缺血。10-0 丝线缝合颈部切口。该模型为持续缺血模型,未进行再灌注。假手术组动物不插入 MCAO 栓线,术中严格控制室温在 20℃~25℃。
1.3.2 动物分组及给药
所有动物随机分为4组,假手术组12只,模型组12只,红花注射液组12只,依达拉奉注射液组12只。红花注射液组造模6 h后,尾静脉注射红花注射液(1.83 mL/kg)。依达拉奉组大鼠造模6 h后,尾静脉注射依达拉奉(5.67 mg/kg,溶于2 mL生理盐水)。
1.3.3 评估神经功能缺损程度和脑梗死面积
使用改良的Zea Longa标准评估所有动物的大鼠神经损伤程度[10],将其分为以下标准:0分,无缺陷;1分,不能伸展对侧前肢;2分,对侧前肢弯曲;3分,轻度向对侧转圈;4分,严重向对侧转圈;5分,对侧瘫痪。
将大鼠脑取出后于-20℃冰冻25 min,放入大脑切片器中将大脑均匀切成 2 mm 左右的薄片,置于制备好的1%TTC中染色,相机采集图像资料,使用尼康Elements图像处理软件分析大脑梗死面积。然后用多聚甲醛溶液和组织保存液切片,封口。红色区域是正常供血区,白色区域是梗死区。
1.3.4 免疫组化检测方法
切片进行脱蜡水化,分别用二甲苯溶液和不同浓度的乙醇溶液去除蜡,PBS 5 min冲洗3次。抗原修复,依次滴加一抗和二抗,并采取温育处理。滴加辣根酶标记的链霉卵白素工作液,滴加DAB显色剂进行显色,自来水停显,进行脱水封片。采用BX43生物显微镜在×100和×400视野下观察。在×400视野下观察细胞形态和染色部位,在×100的视野下,每张切片随机取3个视野,测量海马区CA1区,以细胞膜、胞质或细胞核出现棕黄色颗粒为阳性细胞,采用半定量积分法判断结果。阳性细胞数<6%为0分,6%~25% 为1分,26%~50%为2分,51%~75%为3分,>75%为4分;阳性强度黄色为1分,棕黄色为2分,棕褐色为3分。两者积分相乘。0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(+ +),9~12分为强阳性(+++)。
1.3.5 RT-qPCR技术检测GRP78 mRNA、CHOP mRNA
取4℃冷冻保存的大鼠同一部位脑切片组织,用液氮和Trizol试剂提取总RNA,核酸蛋白质分析仪测定核酸浓度(ng/μL)并记录OD。根据反转录试剂盒说明书,将RNA逆转录为cDNA,以cDNA为模板进行RT-qPCR定量检测。
本次实验是选GAPDH作为内参,目的基因引物序列为:GAPDH, forward primer(F): 5’-ACCCCAGCAAGGACACTGAGCAAG-3’, reverse primer (R):5’-GGCCCCTCCTGTTATTATGGGGGT-3’;GRP78[13],F:5’-AAGGGGAGCGTCTGATT GGCGA-3’,R:5’-ATGAGGCGCTTGGCGTCGAAGA-3’;CHOP[13],F:5’-AAATCGAGCGCCTGACCAGG GA-3’, R: 5’-TTGGCACTGGCGTGATGGTGCT-3’.
本次实验使用Bio-RadCFX96实时荧光定量PCR仪进行PCR循环检测。反应条件:预变性95℃,30 s;变性95℃,30 s;退火温度60℃,30 s;40个循环。监测荧光信号,获得相应Ct值。采用ΔCt法对实验数据进行统计分析,获取相对定量值的统计结果。
1.3.6 超敏 C 反应蛋白检测
按照超敏C反应蛋白试剂盒使用说明书进行操作。采用酶联免疫吸附测定法ELISA(enzyme linked immuno sorbent assay, ELISA)检测CRP的表达水平。
1.4 统计方法
2 结果
2.1 脑梗死面积比分析:
TTC染色如图2所示。在急性脑梗死12 h,模型组梗死面积与假手术组相比具有显著统计学差异(P<0.05);红花注射液组与模型组相比,梗死面积明显减小,差异具有统计学意义(P<0.05)。红花注射液12 h组与依达拉奉12 h组相比,梗死面积无统计学差异(P>0.05)。说明红花注射液能够减轻急性脑梗死的梗死面积,对脑起到保护和修复作用。(如图3A)
2.2 大鼠神经功能损伤评分分析:
由图可知,在造模后12 h,模型组神经功能缺损与假手术组相比,差异有统计学意义(P<0.05);在脑卒中12 h,红花注射液组与模型中相比,差异有统计学意义(P<0.05),其他组均无显著的统计学差异。假手术组没有发生脑梗死,其神经损伤评分较低;模型组的神经损伤评分高于其他三组,这表明模型组的神经功能损伤最严重;红花注射液的神经损伤评分低于模型组,同时依达拉奉注射液的神经损伤评分也低于模型。(如图3B)

图2 大鼠脑TTC染色Figure 2 Gross view of rat brain lisions in the different groups(TTC staining)
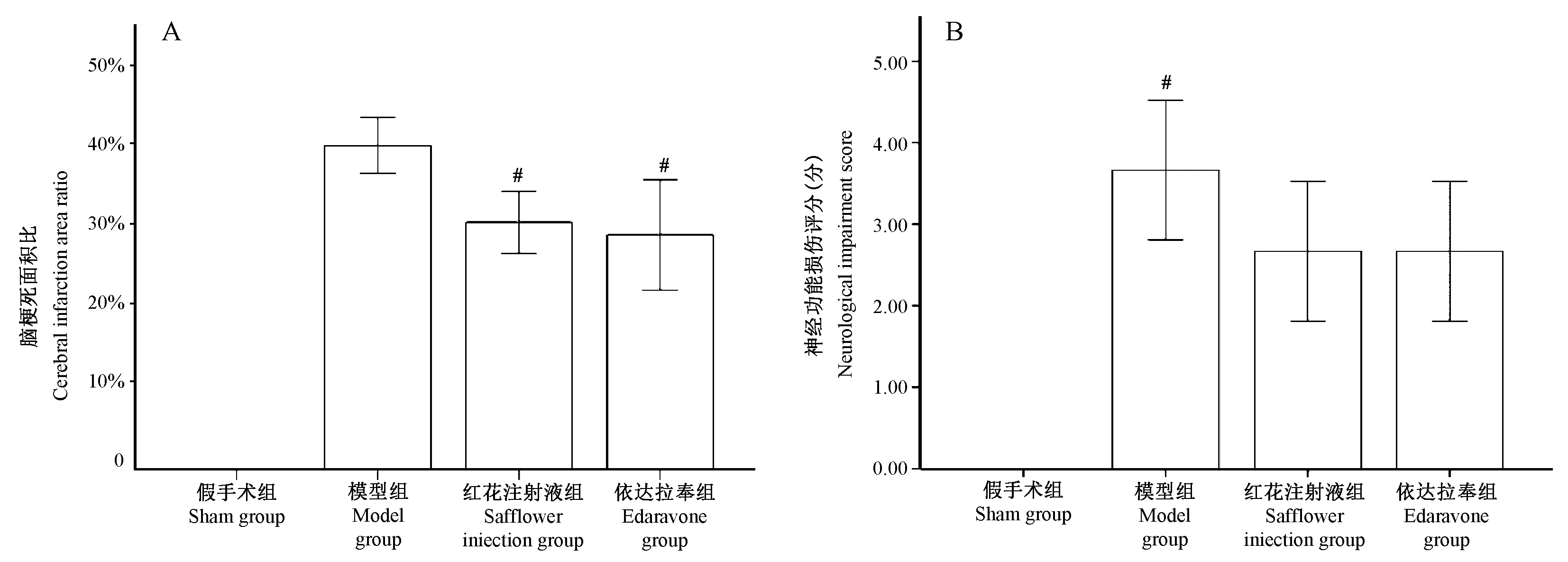
注:A 脑梗死面积, B 神经功能损伤评分。与模型组相比,# P<0.05。图3 药效指标Note.A: Area of cerebral infarction.B:Neurological impairment Score. Compared with the model group group, #P<0.05.Figure 3 Comparison of the pharmacodynamic indexes of the different rat groups
2.3 从免疫组织化学方面分析红花注射液对脑卒中大鼠的影响
2.3.1 GRP78的表达:
GRP78阳性染色细胞呈棕黄色,染色区域为胞浆,多数细胞形态正常,且相对饱满,其主要形状为圆形或椭圆形(如图4)。关于GRP78的表达,假手术组呈强阳性表达,模型组弱阳性表达,红花注射液12 h组弱阳性表达,依达拉奉12 h组中度阳性表达。

图4 免疫组化GRP78染色图像 CA1区(×400)Figure 4 Expression of GRP78 in the rat cerebral CA1 areas (immunohistochemical staining)
2.3.2 CHOP的表达:
CHOP阳性染色细胞胞浆淡染呈棕黄色,细胞核呈棕色,细胞核大多发生形态学改变,胞核皱缩,其主要形状为梭形或条索状(如图5)。关于CHOP的表达,假手术组呈中度阳性表达,模型组弱阳性表达,红花注射液12 h组弱阳性表达,依达拉奉12 h组中度阳性表达。
2.4 从RT-qPCR法分析红花注射液对急性脑梗死大鼠脑组织内质网应激相关分子 GRP78、CHOP的mRNA表达的影响
2.4.1 GRP78 mRNA的表达:
相较于假手术组,在脑缺血后12 h模型组GRP78 mRNA相对表达量升高,P>0.05,无统计学意义;红花注射液组GRP78 mRNA在12 h相对表达量不明显,P>0.05,无统计学意义;依达拉奉注射液组GRP78 mRNA在12 h相对表达量下降,P>0.05,无统计学意义,无显著性差异。与模型组比较,在脑缺血再灌注后12 h,红花注射液组GRP78 mRNA在12 h相对表达量无明显变化,P>0.05,无统计学意义;依达拉奉注射液组GRP78 mRNA在12 h相对表达量下降,P>0.05,无统计学意义。(如图6 A)。
2.4.2 CHOP mRNA的表达
相较于假手术组,在急性脑梗死后12 h,模型组CHOP mRNA相对表达量升高,P>0.05,无统计学意义;红花注射液组CHOP mRNA相对表达量不明显,P>0.05,无统计学意义;依达拉奉注射液组CHOP mRNA相对表达量升高,P>0.05,无统计学意义。相较于模型组,在急性脑梗死后12 h,红花注射液组CHOP mRNA相对表达量升高,但上升无明显变化,P>0.05,无统计学意义;依达拉奉注射液组CHOP mRNA相对表达量升高,P>0.05,无统计学意义。(如图6B)

图5 免疫组化CHOP染色图像(×400)Figure 5 Expression of CHOP in the rat cerebral tissues(immunohistochemical staining)

图6A GRP78 mRNA的表达Figure 6A Expression of GRP78 mRNA in the brain tissues
2.5 红花注射液对急性脑梗死大鼠过敏C反应蛋白的影响
由图可以看出,与假手术组比较,在急性脑梗死后12 h,模型组CRP水平升高,P<0.05,有统计学意义;红花注射液组与依达拉奉组CRP水平无明显变化,P>0.05,无统计学意义。与模型组相比较,在脑卒中12 h,红花注射液组CRP含量明显低于模型组,P>0.05,无统计学意义;与依达拉奉注射液组相比较,在脑卒中12 h,红花注射液组CRP水平无明显变化,P>0.05,无统计学意义。脑卒中后12 h,红花注射液组、依达拉奉注射液组均无显著性差异(如图7)。
3 讨论
红花注射液可从改善血流动力学、改善能量代谢、抑制细胞凋亡、抗炎症损伤、调控基因表达、改变一氧化氮和内皮素含量、抗氧化应激、改变血清白细胞介素含量等方面来发挥抗脑血管损伤的作用[14]。红花注射液的主要成分羟基红花黄素A可有效改善脑缺血再灌注损伤[15]。羟基红花黄素A能够通过抑制细胞凋亡和抑制炎症相关信号通路进而起到保护脑细胞及神经细胞的作用[15-16]。本实验基于内质网应激相关炎性反应进一步研究红花注射液治疗急性脑梗死的作用机制。
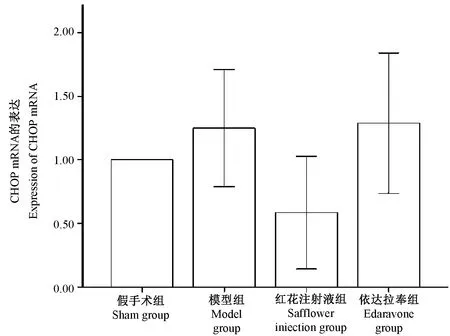
图6B CHOPmRNA的表达Figure 6B The expression of CHOP mRNA in the rat brain tissues

注: 与假手术组相比,#P<0.05。图7 CRP的表达Note. Compared with the sham group,#P<0.05。Figure 7 The expression of CRP in the rat brain tissues
ERS是继细胞死亡受体通路、线粒体通路后的第三大细胞凋亡通路,主要由氧化应激、钙失衡及炎症反应等引起内质网稳态的失衡引起的应激反应。ERS在缺血再灌注损伤中可能具有非常重要的地位[17]。CHOP与GRP78是ERS中的两个关键因子。GRP78是热休克蛋白70家族的一名重要成员,在维持细胞内稳态方面发挥重要作用。当各种原因引起的组织细胞内外环境改变,如缺血缺氧,氧化应激,病毒细菌感染,蛋白质修饰障碍等时,GRP78 与蛋白激酶RNA 样内质网激酶(RNA dependent protein kinase like-ER kinase,PERK)、活化转录因子6 (activating transcription factor 6,ATF6)、肌醇需求酶-1(inositol-requiring enzyme 1,IRE1)解离,促进蛋白质正确折叠,保护细胞。当内质网功能由于长时间的缺血而出现功能障碍时,GRP78表达开始下降,内质网稳态遭到破坏,细胞凋亡通路被启动,导致缺血细胞死亡[18]。CHOP是内质网应激中特异的转录因子[19],在非应激状态下,它的表达量很低,而在ERS中,其表达量则大大增加。在本实验中,使用红花注射液与依达拉奉做类比,验证红花注射液在治疗缺血性脑卒中上有显著作用。实验结果表明,红花注射液能够起到促进GRP78的表达和抑制CHOP表达的作用,它们是内质网应激反应中的关键指标,故推测红花注射液治疗急性脑梗死是可调节内质网应激反应。山东大学齐鲁医学院仇健等研究表明,与正常组相比,成功模型在缺血2 h 引起GRP78及CHOP表达升高,且GRP78和CHOP 的升高点不完全重合,在缺血相同时间内再灌注不同时间GRP78 和CHOP 升高不一致[18]。
CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性相蛋白, CRP也属于炎性因子之一[20]。CRP升高的程度反应炎症组织的大小或活动性,在急性炎症和感染时,CRP与疾病活动性有良好的相关性。研究证明在脑卒中首发时,CRP的含量会明显上升[21]。实验发现,红花注射液组的CRP明显低于模型组,进而可以说明红花注射液对于炎症有一定的抑制作用。有研究发现,脑缺血再灌注损伤的本质是炎症反应[22]。该实验中红花注射液使CRP表达下降,也印证了红花注射液对于急性脑梗死具有良好的治疗作用。
本实验研究结果表明,红花注射组GRP78 mRNA,CHOP mRNA的表达与模型组比较均无显著性差异,推测可能与本实验选取的检测时间点有关,本实验仅检测脑缺血再灌注后12 h而未检测24 h的GRP78、CHOP基因表达情况,后续研究将进一步检测其他时间点及预用药干预时的GRP78 mRNA,CHOP mRNA表达情况,以充实实验结果。由于红花注射液能够影响ERS中的关键指标,推测CRP可能与ERS中某条通路调控的炎症因子有直接或间接的关系,也有待进一步研究,使红花注射液治疗急性脑梗死的机制更加清晰明确,进而为临床使用红花注射液提供更强有力的理论基础。

