18F-FDG PET/ CT和PET/ MRI在前列腺癌诊断及分期中的效能研究
李云波,郭 坤,何 伟,施 乐,张 薇,袁梦晖,魏龙晓
(空军军医大学第二附属医院核医学科,陕西西安 710038)
前列腺癌是老年常见疾病之一,随着社会的发展,人口老龄化加速,前列腺癌的发病率不断上升,与年龄成正相关[1-2]。由于其进展缓慢、症状缺乏特异性,早期不易确诊,目前最常用的筛查方法是血前列腺特异抗原(prostate specific antigen,PSA)测定,但是流行病学研究发现PSA只能作为初步筛查的方法,阳性结果常常导致不必要医源性损伤[3]。前列腺癌治疗预后的关键在于早期诊断与分期[4],影像学起着重要的作用。所以,临床对影像学的要求越来越高,常规影像学[B超、计算机断层成像(computed tomography,CT)、核磁共振成像(magnetic resonance imaging,MRI)]各有优势,也具有一定的局限性。以2-氟-2脱氧-D-葡萄糖(2-deoxy-2-fluoro-d-glucose,18F-FDG)为示踪剂的正电子发射断层扫描/计算机断层成像(positron emission tomography/ computed tomography,PET/CT)作为比较成熟的分子影像学方法,具有较高的灵敏度,应用于前列腺癌筛查、诊断及分期。PET/MRI是近几年新兴的分子影像学方法,将MRI高软组织分辨率、多参数、多序列成像的优势与PET高灵敏度的优势结合,可以更好地显示腺体及前列腺外受累情况,提高转移灶的探查效率。本文通过回顾分析20例前列腺癌患者18F-FDG PET/CT及PET/MRI形态及代谢特征,比较两种方法各自的特点及优势,从检验效能角度分析两者间如何进行合理选择,更好地为临床前列腺癌筛查、诊断与分期提供帮助。
1 资料与方法
1.1研究对象回顾性分析2017年8月至2017年12月空军军医大学第二附属医院收治的20例疑似或确诊前列腺癌筛查患者穿刺或术前的影像资料。纳入标准:①主诉包括尿频、尿急、排尿困难、血尿、尿潴留等症状;②检查前测定tPSA>4 ng/mL[5-6];③随访有病理结果。排除标准:①近期行前列腺电切术;②尿潴留较重,影响图像质量;③盆腔有金属植入物。
入组患者年龄45~80岁,平均58岁, 总前列腺特异抗原(total prostate specific antigen,tPSA)水平在4~10 ng/mL之间10例,tPSA >10 ng/mL 10例;12例患者有前列腺增生病史,2例患者有骨痛。20例患者采集前或采集后进行前列腺穿刺,经组织学证实前列腺癌诊断。
1.218F-FDGPET/CT检查方法20例患者均先行PET/CT全身显像,采用通用电气公司Discovery LS PET/CT;18F-FDG以H218O为原料,放化纯度>95%(高效液相色谱法 high performance liquid chromatography,HPLC)。检查前禁食8 h、禁饮4 h;测末梢血空腹血糖<11.2 mmol/L。按照0.15 mCi/kg标准于静脉注射18F-FDG。注射后继续休息40~60 min,平卧采集。先进行体部定位扫描,电流35 mA、电压120 kV,扫描时间15~16 s,层厚0.6 mm;再进行体部CT扫描,电流170 mA、电压120 kV,扫描时间18~21 s,层厚3.75 mm;最后进行体部PET显像,2.0~2.5 min/床位,采集5~6个床位,迭代法重建图像,采用MIMvista Corp.Cleveland OH后处理工作站MIM软件获得CT、PET、PET/CT融合图像。
1.318F-FDGPET/MRI检查方法PET/MRI在PET/CT全身显像后进行,扫描范围包括整个盆腔,采用标准化PET/MRI前列腺扫描流程[7](表1)。设备为Siemens biography mMR PET/MR一体机(MRI 3.0T)。常规MRI参数:①快速自旋回波序列(turbo spin echo,TSE)T1加权像(T1 weighted image,T1WI)轴位小视野扫面:重复时间(repetition tme,TR)550 ms,回波时间(echo time,TE)12 ms,层厚3 mm,层距0.6 mm,扫描视野(field of vies,FOV)20 cm×20 cm,矩阵240×320。②TSE T2WI轴位、冠状位小视野扫描:TR 4 000 ms,TE 89 ms,层厚3 mm,层距0.6 mm,FOV 20 cm×20 cm,矩阵256×320。③短时间反转恢复序列(short time inversion recovery,STIR)小视野扫面:TR 6 230 ms,TE 87 ms,层厚3 mm,层距0.6 mm,FOV 20 cm×20 cm,矩阵205×256。④弥散加权序列(diffusion weighted imagin,DWI)参数:采用平面回波成像(echo planar imaging,EPI)序列,b值为50、400、1 000 s/mm2,TR 8 900 ms,TE 79 ms,层厚3 mm,层距0.6 mm,FOV 20 cm×17 cm,矩阵85×124,自动生成表观弥散系数(apparent diffusion coefficient,ADC)图,扫描时间1 min 40 s。必要时加扫液体衰减反转恢复脉冲序列(fluid attenuated inversion reconvery,FLAIR)冠状位、矢状位。采用MIMvista Corp.Cleveland OH后处理工作站MIM软件获得CT、PET、PET/CT融合图像。为了排除尿液本底干扰必要时充分利尿后延迟显像。
表1一体化PET/MRI前列腺扫描流程

项目MRI序列PET定位三平面定位-衰减校正TOF的衰减校正-前列腺MRI采集顺序横轴位T1加权序列同步PET采集1~2个体位横轴位/冠状位T2加权序列横轴位/冠状位 STIR序列DWI序列(b值=50、800、1 000)
MRI:核磁共振成像;PET:正电子发射断层扫描 ;DWI:弥散加权成像。
1.4图像分析方法影像结果由2名核医学副主任医师或主任医师分别独立对20例患者结果进行分析。①PET/CT结果:通过视觉及半定量分析,观察前列腺形态、大小、与周围组织关系,在PET/CT图像代谢最浓层面勾画感兴趣区(region of interest,ROI),测量最大标准摄取值(standardized uptake value max,SUVmax),大于2.5为阳性;必要时测量最小标准摄取值SUVmin。②PET/MRI结果:首先通过MRI确定前列腺癌病灶的部位及范围,根据2015年前列腺影像报告和数据系统第2版(prostate imaging reporting and data system version 2.0,PI-RADS V2)标准进行评分,以常规T2WI信号为评分标准。1分,外周带或移行带均匀高信号(正常);2分,线样或楔形低信号或弥漫轻微低信号,边界模糊;3分,信号不均匀或界限不清,呈圆形,中等低信号(包括其他不符合2、4、5分);4分,界限清楚,均质低信号灶及或团块局限于前列腺内,病灶最大径<1.5 cm; 5分,同4分者,但病灶最大径≥1.5 cm或在外周带及移行带DWI序列上病灶出现确切向前列腺外扩散及(或)侵袭征象[8]。1、2分为MRI阴性,3、4、5为可疑病变区,还需与PET结果进行匹配对照,在PET/MRI T2WI 低信号且代谢最浓层面勾画ROI,测量SUVmax,大于2.5为阳性。同时需要测量其他各叶非病变区的SUVmax,值需<2.5。
1.5统计学处理结合随访结果,采用SPSS 18.0软件分析数据,对PET/CT与PET/MRI前列腺高代谢区域SUVmax值行配对t检验;对PET/CT与PET/MRI结果阳性率、转移结果进行卡方检验。以P<0.05有统计学意义。
2 结 果
2.118F-FDGPET/CT全身显像PET/CT发现前列腺代谢异常共11例(55%),均位于侧叶,PET代谢特征为不均匀“斑片状”或“散点状”(图1),SUVmax为2.9±0.25,病灶区域CT值与非病灶区域无法明确区分;其中tPSA水平在4~10 ng/mL之间2例,tPSA >10 ng/mL共9例。发现骨转移共6例(54%),均为成骨性改变,其中4例存在骨盆转移,包括2例骨痛患者。盆腔淋巴结转移4例(36%),表现为淋巴结增大及放射性摄取增高。发现邻近器官受侵可疑仅有1例(膀胱壁增厚)。
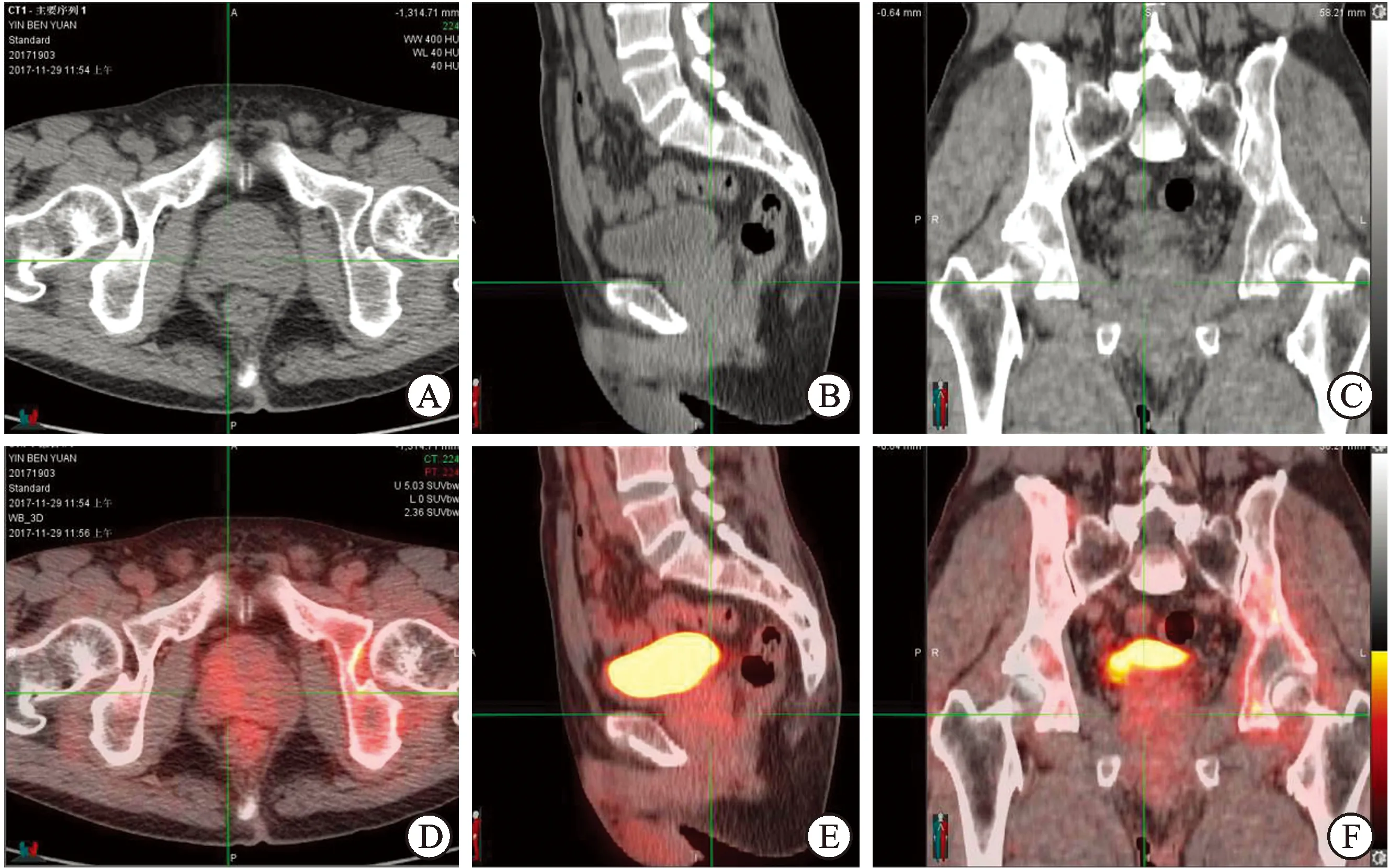
图1 病理证实为66岁前列腺癌患者的PET/CT图像
A:CT轴位;B:CT矢状位;C:CT冠状位(示前列腺增生,密度均匀);D:融合图像轴位;E:融合图像矢状位;F:融合图像冠状位(示右侧叶FDG摄取不均匀增高,SUVmax 2.8;左侧髂骨骨质密度欠均匀,FDG摄取增高,SUVmax 2.6)。
2.218F-FDGPET/MRI前列腺显像PET/MRI阳性病例共18例(90%),均位于外周带(≥4分),PET代谢特征为“斑片状”(图2),SUVmax为3.2±0.26,病灶区域与MRI T2WI基本一致,特征为短T2、STIR低信号、DWI受限,边界欠清楚,范围大小不等。tPSA水平在4~10 ng/mL之间8例,tPSA >10 ng/mL共10例。发现骨盆转移5例(27%),也包括2例骨痛患者。发现盆腔淋巴结转移4例(36%),表现淋巴结高代谢,STIR高信号、DWI受限。发现邻近器官受侵4例(22%),2例精囊、1例膀胱壁、1例尿道。2例PET/MRI阴性患者与PET/CT阴性结果一致。
2.318F-FDGPET/CT与PET/MRI诊断及分期效能比较PET/CT与PET/MRI诊断前列腺癌的阳性率分别为55%、90%,两者效能指标比较见表2。
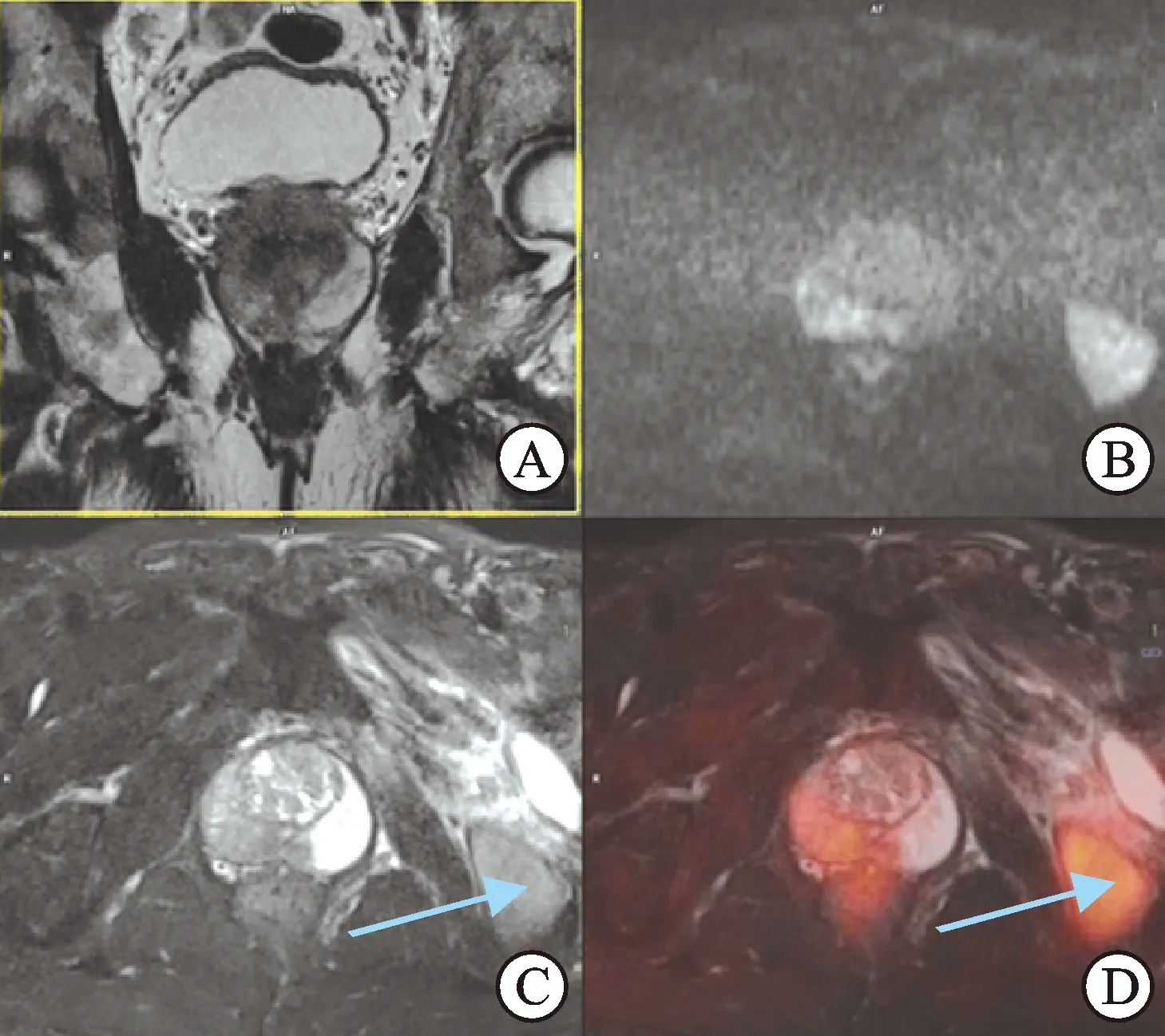
图2同一患者的PET/MRI图像
A:T2冠状位;B:DWI,b=1 000;C:STIR横轴位;D:STIR和PET轴位融合图像,前列腺右侧外周带信号异常区域(短T2、STIR低信号、DWI高信号)伴FDG摄取增高,SUVmax 3.8,SUVmin 1.1,左侧髂骨信号异常伴摄取增高,SUVmax 3.5,SUVmin 1.3(箭头),系骨转移。
表218F-FDGPET/CTandPET/MRI效能指标比较
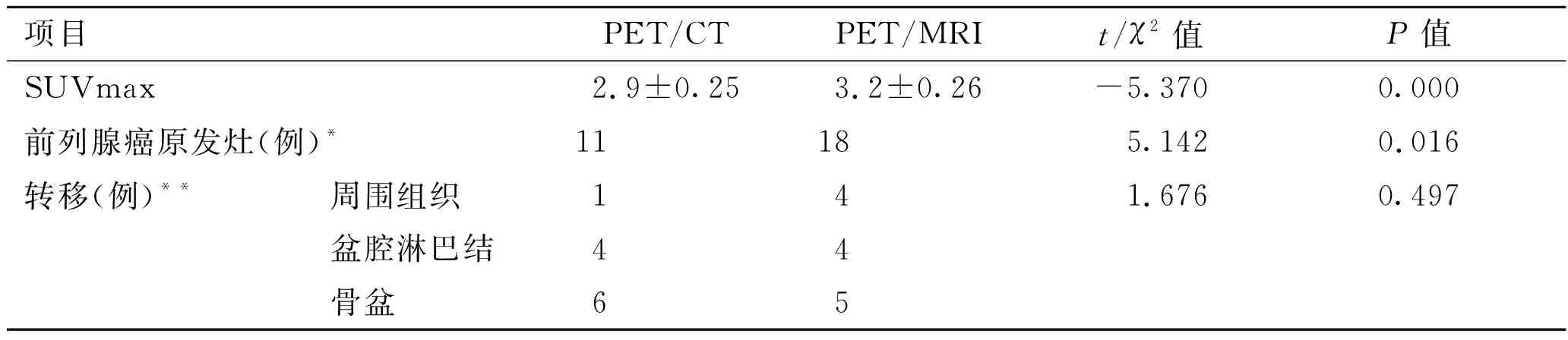
项目PET/CTPET/MRIt/χ2值P值SUVmax2.9±0.253.2±0.26-5.3700.000前列腺癌原发灶(例)*11185.1420.016转移(例)**周围组织141.6760.497盆腔淋巴结44骨盆65
*采用配对χ2检验,P通过McNemar Test计算;**PET/MRI扫描仅包含盆腔范围,采用Fisher’s确切概率法。
3 讨 论
18F-FDG是目前最常用的广谱PET肿瘤显像剂,基于理化特性更容易普及使用,在前列腺癌的诊断、分期中有着重要意义。为了最大发挥FDG的优势,采用影像学图像技术与PET融合,提高病灶的检出率,同时采用CT和MRI对于PET进行衰减矫正,使得PET可进行量化评价。PET评价体系中的量化指标是病灶的SUVmax值,本研究中PET/CT与PET/MRI的SUVmax数据结果存在统计学差异,主要原因在于两种方法采用不同的衰减矫正方式[9],PET/CT采用CT预扫描的方式进行衰减矫正,而PET/MRI采用基于飞行时间技术的测量方法[10]。故这种差异单纯表现在数值结果的不同,不能通过SUVmax值进行良恶性及疾病程度的直接比较,但是两种方法的SUVmax结果存在正相关性[11],即前列腺癌患者使用两种方法测量的SUVmax均升高且>2.5,无论使用哪种方法,通过SUVmax值的结果诊断前列腺癌的结论并没有差异。
本研究发现PET/MRI的探测前列腺癌的阳性率高于PET/CT,原因在于MRI在前列腺显像方面的优势,高分辨扫描可显示结构细节,并进行肿瘤T分期;而CT扫描显示前列腺各叶及周围的关系存在不足。观察膀胱改变时PET/CT需要充盈采集,导致前列腺邻近的尿路放射性本底浓聚,影响了前列腺病灶的观察,所以,18F-FDG PET/ CT对前列腺癌的诊断难以发挥太大作用[12]。此外,除了前列腺癌,FDG摄取增高也可见于前列腺炎、前列腺增生等良性病变,而CT鉴别上述病变存在不足,降低了PET/CT在前列腺癌诊断的特异性。PET/MRI则要求排空膀胱,降低了周围尿路的放射性本底影响;此外,MRI常规序列及DWI在前列腺疾病鉴别具有明显优势[13]。可以说,基于SUVmax评价体系的PET/MRI诊断前列腺癌的阳性率高于PET/CT,两种方法存在统计学差异。一体化PET/MRI集PET和MRI的优势,不但提高诊断的阳性率,也对分期起到了重要的作用;在鉴别诊断时,PET/MRI也优于PET/CT。
本研究从周围组织、盆腔淋巴结、骨盆3个方面分析,18F-FDG PET/CT及PET/MRI探查转移灶(即N、M分期)无明显统计学差异。究其原因是转移灶存在解剖学的变化,CT和MRI都可以发现,且PET都存在异常代谢。MRI的优势仅在于观察周围组织如精囊、尿道及膀胱壁的侵犯。CT比MRI多发现一例骨转移,仔细回顾该例患者,T2及DWI可见轻微的信号改变,单纯MRI检查容易漏诊。故CT在骨显像有一定的优势,特别是以成骨为主的前列腺癌特征性的骨转移;对于无明确解剖学或微小解剖学改变的骨转移,CT具有一定的优势[14]。所以,当CT和MRI发现周围组织、淋巴结及骨解剖学的改变时,配合PET的高摄取,可得出比较明确的转移结论,也能避免微小病变的漏诊,为临床治疗带来重要帮助。
PET/MRI也具有一定的局限性,首先, PET/MRI比PET/CT有更多的禁忌证;其次,MRI的采集时间及范围的限制。PET/CT可以在固定的较短时间内实现全身采集,除原发灶之外可显示其他部位淋巴结转移情况以及全身骨转移情况;再经过充分利尿降低本底后延迟显像,能提高前列腺及周围组织的显示效果。由于PET全身采集时间固定,PET/MRI目前只针对局部优化采集序列,总采集时间取决于MRI序列的选择,前列腺等小器官需要多角度的高分辨扫描,会明显延长MRI采集时间,增加不确定因素,患者无法耐受。控制采集时间势必要精简序列,减少序列的采集时间,会影响原发灶或转移灶显示效果。故本研究经过充分考虑时间和效能之间合理搭配,PET/MRI只进行了盆腔的局部采集及高分辨扫描。由于上述原因,本研究也未进行专门磁共振波谱(MR spectroscopy,MRS)、磁共振动态增强(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)等优势序列采集[15],充分优化PET/MRI的采集序列及各序列的合理应用是本研究正在同步进行的研究内容。
对于已经明确诊断的前列腺癌患者,使用18F-FDG PET/CT及PET/MRI进行治疗后显像,可将代谢活性病灶与代谢静止者区分开来,帮助临床迅速评价治疗疗效[16],做到精准医疗。综上所述,18F-FDG PET/CT及PET/MRI有其各自特点,PET/MRI探查前列腺癌原发灶具备优势,而临床分期两种方法无明显差异,某些时候需要观察全身情况时PET/CT也具有独特的优势;所以不能简单地首选PET/MRI进行前列腺癌的诊断与分期,要根据临床工作和需求进行合理选择。
回顾本研究中的2例PET/CT及PET/MRI为阴性患者均为微小病变。即使PSA出现异常,影像学分辨率仍会导致假阴性的结果,18F-FDG代谢、高分辨T2WI、DWI等高灵敏度的方法依然存在不足,通过新的方法探查微小病变(例如siemens resolve DWI)是新的研究方向。

