T2 FLAIR增强和T1WI-3D-TFE增强序列对结核性脑膜炎诊断的对比研究
郑广平,王立非,云永兴,陆普选,魏方军,张辉,罗杰棋,黄铭勇
结核性脑膜炎是肺外结核严重的类型,也是中枢感染性疾病中难治的一种。结核性脑膜炎的诊断依赖于临床表现和脑脊液检查,影像学检查主要观察病变累及脑实质及柔脑膜的范围,并观察脑梗死及脑积水等并发症。影像学检查另外一个重要作用是观察治疗效果。常用的颅脑MRI增强扫描是T1WI,本研究采用T2 FLAIR增强序列与T1WI三维快速扰相梯度回波(T1WI-3D-TFE)增强序列进行对比,旨在对比两种增强序列对病变的显示能力。
1 材料与方法
1.1 一般资料
本研究选取深圳市第三人民医院2017年1月至2018年12月68例疑诊结核性脑膜炎患者行磁共振行MRI常规扫描及T1WI-3D-TFE增强及T2 FLAIR增强进行前瞻性研究。纳入标准:选取临床确诊肺结核(确诊肺结核标准为痰涂片阳性),并且疑诊结核性脑膜炎68例,最终52例经临床确诊结核性脑膜炎,临床确诊标准采用结核性脑膜炎诊断评分标准(2009)[1]中的确诊依据:脑脊液结核杆菌抗酸检测阳性。排除标准:52例确诊病例中,排除MRI增强扫描未发现脑实质或柔脑膜病变12例,脑实质病灶数目数不清及弥漫柔脑膜病变8例。余32例患者最终纳入对比性研究,其中男性20例,女性12例,年龄11~29岁,平均年龄(16.9±3.8)岁。本研究经过医学伦理委员会审核通过,全部受检者于检查前签署知情同意书。
1.2 检查方法
本组病例采用Philips Achieva 1.5 T磁共振进行扫描,所有病例先行常规平扫,然后行T1WI FLAIR增强,延迟20 min后,最后行T2WI FLAIR增强扫描。平扫扫描序列为:(1)听眦线横断面T1WI,TR=8.1 ms,TE=1.6 ms,FOV 20~26 cm,矩阵(192~256)×(256~320),层厚1.2 mm,层间距0 mm。(2)听眦线横断面及冠状面SE-T2WI,TR=3000~4000 ms,TE=90~120 ms,FOV 22~24 cm,矩阵(192~256)×(256~320),层厚6 mm,层间距1.5 mm。(3)平扫T2 FLAIR,TR=8400 ms,TE=109 ms,层厚=1.2 mm,层间距=0 mm。增强扫描序列为:T1WI-3D-TFE,TR=8.1 ms,TE=1.6 ms,层厚1.2 mm,层间距=0 mm。T2 FLAIR,TR=8400 ms,TE=109 ms,层厚=1.2 mm,层间距=0 mm。对比剂采用钆喷替酸葡甲胺(Gd-DTPA)(0.1 mmol/kg),经肘静脉注射,注射速率为2 mL/s。在完成T1WI增强20 min后进行T2WI FLAIR增强,获得两种增强图像。
1.3 图像分析
所有图像由两名高年资放射诊断医师进行阅片,有异议病例讨论后界定,两名诊断医师对患者确诊结核性脑膜炎并不知情。结核性脑膜炎影像诊断标准采用结核性脑膜炎诊断评分标准(2009)[1]中的影像评分标准,结核性脑膜炎的影像诊断评分标准有:脑积水1分;脑膜强化2分;结核瘤2分;脑梗死1分;增强前颅底高信号2分。满足临床评分≥12分,影像学评分≥2分,且排除其他病因脑膜炎即可诊断结核性脑膜炎。32例均达到诊断结核性脑膜炎标准。本研究针对两种增强扫描方式,主要观察脑实质结核瘤和柔脑膜强化,观察指标有:有或无病灶;病灶数目和位置;强化或不强化;两种增强扫描方式都有强化者,记录强化或明显强化。
1.4 统计学分析
应用SPSS 19.0统计软件进行统计学分析。对两种增强扫描方式的脑实质及柔脑膜病灶显示程度进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 影像表现
2.1.1 脑实质病变位置和数目
32例确诊病例中,脑实质单发病灶6例,2处病灶15例,3处病灶10例,4处病灶1例。32例共67处脑实质病灶,病灶见于脑干31例,见于额叶10例,见于颞叶15例,见于枕叶5例,见于顶叶4例,见于基底节2例。
2.1.2 柔脑膜病变位置和数目
32例确诊病例中,未见柔脑膜强化10例,单处柔脑膜病变2例,2处柔脑膜病变12例,3处柔脑膜强化8例;32例50处柔脑膜病灶,病灶见于脑底柔脑膜病灶29例,额叶柔脑膜12例,颞叶柔脑膜6例,顶叶柔脑膜2例,枕叶柔脑膜1例。
2.1.3 T1WI-3D-TFE增强和T2 FLAIR增强显示病灶程度
67处脑实质病灶中,T1WI-3D-TFE增强显示39处,T2 FLAIR增强显示57处。50处柔脑膜病灶中,T1WI-3D-TFE增强显示18处,T2 FLAIR增强显示46处。T1WI-3D-TFE增强显示柔脑膜明显强化6例,强化12例;T2 FLAIR增强显示柔脑膜明显强化28例,强化18例。见图1。
2.2 统计结果
T1WI增强对脑实质和脑膜病变的显示率分别为58.2%和36.0%,T2 FLAIR显示率对脑实质和脑膜病变的显示率分别为85.0%和92.0%。两种增强方式对脑实质病灶显示程度有差异(χ2=11.901,P<0.05)(见表1);两种增强方式对柔脑膜病灶显示程度也有差异(χ2=34.028,P<0.05)(见表2)。
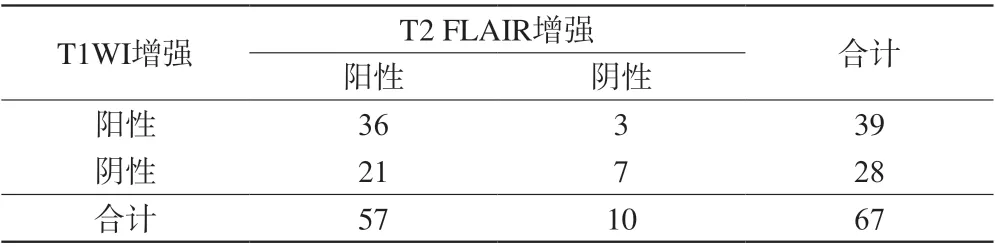
表1 两种增强方式对脑实质病灶显示程度比较Tab. 1 Comparison of two enhancement methods in displaying cerebral parenchymal lesions
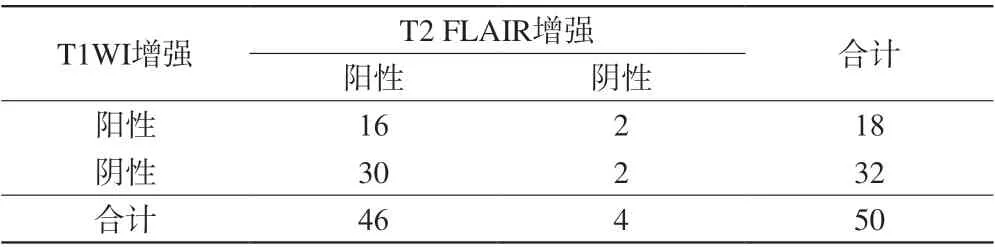
表2 两种增强方式对柔脑膜病灶显示程度比较Tab. 2 Comparisons of two enhancement methods in displaying leptomeninges lesions
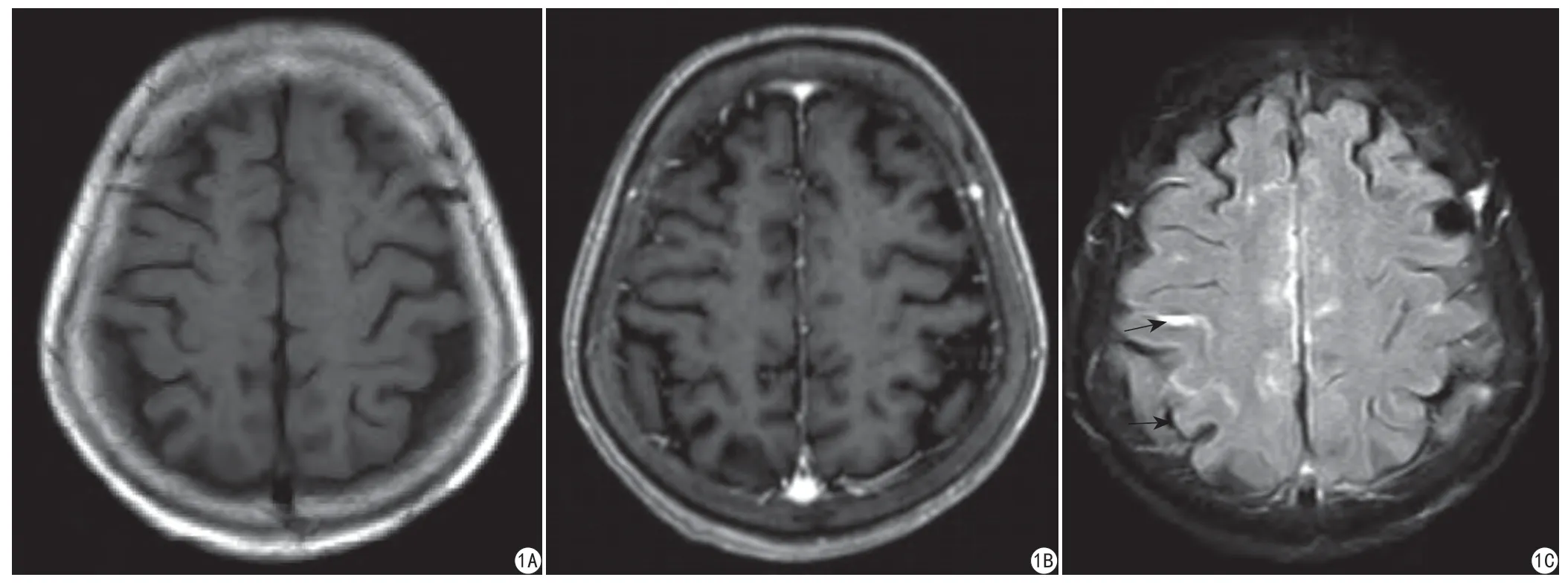
图1 男性,26岁,结核性脑膜炎。平扫T1WI (A),T1WI-3D-TFE增强未见异常柔脑膜强化(B),T2 FLAIR见柔脑膜明显增厚强化(C,箭)Fig.1 Male, 26 years old, was diagnosed with tuberculous meningoencephalitis. A: T1WI plain scan; B: No abnormal leptomeninges enhancement was observed on T1WI-3D-TFE contrast-enhanced image; C: The T2 FLAIR contrast-enhanced image showed marked leptomeninges thickening and enhancement (arrow).
3 讨论
结核性脑膜炎是由结核分枝杆菌感染引起的非化脓性炎症[2-3]。结核性脑膜炎的诊断主要依赖于临床表现、脑脊液检查、影像学检查和其他部位结核依据进行综合诊断[4-5]。目前临床上尚无一种方法完全解决结核性脑膜炎的诊断问题[6]。结核性脑膜炎的影像学检查主要观察柔脑膜和脑实质累及的范围、脑积水的程度等,并为临床的治疗效果判断和预后提供依据[7]。目前,常规应用的颅脑MRI增强扫描是T1WI FLAIR增强扫描,由于T1WI FLAIR增强扫描对病变柔脑膜强化的判断具有一定的局限性,本研究探索应用T2WI FLAIR增强扫描诊断结核性脑膜炎,为临床诊疗结核性脑膜炎提供新的影像学依据[8]。
3.1 T2 FLAIR增强扫描原理和特点
常用的MRI增强对比剂Gd-DTPA在T1WI增强时能明显缩短T1弛豫时间,而在T2 FLAIR上也能轻微缩短T1弛豫时间,表现高强化[9-10]。因此,T2 FLAIR增强扫描也可以应用对比剂Gd-DTPA进行扫描。在低对比剂浓度时T2 FLAIR增强具有高的脑组织对比,在对比剂浓度约0.3 mmol/L时,脑组织对比较好,而在高对比剂浓度(>2.5mmol/L)时,强化幅度减低,脑组织对比降低,表现为负性强化。相对于T1WI增强,柔脑膜强化幅度更明显,而硬脑膜强化幅度不如T1WI增强。T2 FLAIR增强图像上皮层血管无强化或者低强化[11]。
3.2 T2 FLAIR增强扫描诊断结核性脑膜炎的优势
相对于T1WI增强,T2 FLAIR增强能够更敏感地显示柔脑膜强化,并且能够去除皮层血管强化的干扰,能够提高诊断信心[11]。本研究发现,早期的结核性脑膜炎患者临床症状明显,脑脊液检查结果依据充分,但T1WI增强图像上由于皮层血管强化干扰,柔脑膜增厚强化轻微或未见强化,而在T2 FLAIR增强图像上诊断柔脑膜增厚强化的幅度、数目和范围明显优于T1WI增强,统计表明,两组诊断结核性柔脑膜病变差异具有统计学意义。而在脑实质病变,由于T2 FLAIR抑制了水和一定程度上抑制了脑灰白质信号,病灶的强化面积也增大,边界也较前者模糊,也能够增加诊断信心。对脑实质的病灶的诊断,两组的差异也具有统计学意义。
3.3 T2 FLAIR增强扫描诊断结核性脑膜炎的缺点
由于高浓度的对比剂能够降低T2 FLAIR增强作用,在扫描时应使用较低浓度的对比剂注射量,或者在进行常规T1WI增强后延迟一定时间才能进行T2 FLAIR增强,再加上T2 FLAIR序列本身扫描时间较长,因此T2 FLAIR增强扫描时间明显长于常规增强[10]。本研究是在T1WI增强后延迟20 min后进行,平均扫描时间约48 min。由于扫描时间较长,临床应用有一定的局限性。
3.4 T2 FLAIR增强扫描诊断结核性脑膜炎的临床意义
本研究发现,T2 FLAIR增强相对于T1WI增强不但能更好地显示结核性脑膜炎的柔脑膜病变,也能更好地显示脑实质病变,对临床的诊断、治疗效果和预后判断具有重要意义。但T2 FLAIR增强扫描时间较长,临床应用具有一定局限性,T2 FLAIR增强扫描可在特殊的疾病条件下使用,能达到更好的临床诊疗效果。
利益冲突:无。

