氯化锂对牙髓干细胞增殖与分化的影响
李乐枫,蒋备战
(同济大学附属口腔医院牙体牙髓病学教研室-上海牙组织修复与再生工程技术实验中心,上海 200072)
Wnt/β-catenin信号通路与牙胚生长发育、牙冠形态发生以及牙根发育形成的过程密切相关,它在牙上皮的增殖发育以及成牙本质细胞的生长分化过程当中都起到了重要的作用[1-2]。相关研究表明,无机化合物氯化锂作为该经典信号通路的激活剂,具有上调该通路的能力;通过加入氯化锂(LiCl)对该通路进行激活,能促进细胞的增殖与骨向分化[3]。而对于牙髓牙本质复合体受损伤后的盖髓治疗过程中,牙髓干细胞(dental pulp stem cells,DPSCs)受盖髓材料的作用,具有形成修复性牙本质的潜能[4]。然而,氯化锂对于牙髓牙本质复合体再生的作用尚未有深入研究。本课题拟从细胞研究层面上探究Wnt/β-catenin通路的激活剂氯化锂对牙髓干细胞增殖与分化的影响,为盖髓材料的研发提供依据。
1 材料与方法
1.1 材料与仪器
低糖型DMEM培养基、胎牛血清、谷氨酰胺、青链霉素购自美国Gibco公司;0.25%胰蛋白酶、CO2恒温孵箱购自美国Thermo公司;低速离心机购自德国Eppendorf公司;YJ-875型超净工作台购自苏州净化设备厂;倒置相差显微镜及照相系统购自日本Nikon公司;10cm培养皿及15、50mL离心管购自美国Corning公司;抗人(Vimentin、Cytokeratin 19、CD34、CD45、CD90、CD105、CD146)抗体、山羊抗兔二抗购自Abcam公司;氯化锂、CCK-8试剂盒、茜素红染液购自南京凯基公司;胶原酶、地塞米松、抗坏血酸、β-甘油磷酸钠购自Sigma公司。
1.2 牙齿样本的收集
本实验经过同济大学伦理委员会批准(伦理审查编号: 2018-012),严格遵照有关人类细胞提取及研究应用规定进行操作。所有患者均来自同济大学附属口腔医院口腔颌面外科。与患者进行充分沟通交流,介绍实验内容及目的,得到知情同意后,收集因正畸拔除的前磨牙或智齿用作原代培养。所选患者年龄为18~25岁,无系统性疾病,无牙齿发育异常,口腔卫生状况良好。收集的牙齿均牙根发育成熟,牙体无龋损,无牙髓及根尖周疾病。
1.3 原代细胞培养及细胞的克隆分离
使用高速涡轮机及TF-21金刚砂车针于新鲜拔除的前磨牙或智齿釉牙本质界处制备深沟,深度未及髓腔,制备后将离体牙浸入无菌PBS缓冲液。在超净台内,用青链霉素混合溶液反复冲洗后,使用无菌器械将离体牙冠部撬开,暴露牙髓组织,使用拔髓针将冠髓及根髓取出,放入60mm细胞培养皿加入含青链霉素混合溶液的无菌PBS缓冲液,使用无菌眼科剪将组织充分剪碎后,加入3mg/mL胶原酶。随后将培养皿放置于5% CO2孵箱37℃孵育30min。终止消化,离心半径10cm,1000r/min离心5min,弃上清液,沉淀物用含10%胎牛血清的DMEM培养基重悬,将酶消化后的组织块在培养皿中贴壁,加入培养液并置于37℃、5% CO2培养箱。每72h换液,每日观察细胞爬出情况。待爬出的细胞达到80%融合时,使用0.25%胰蛋白酶消化细胞,传代培养,隔天常规更换培养液。选择生长状态良好的第3~5代细胞用于后续实验研究。
1.4 人牙髓干细胞来源分析
将生长状态良好的第2代DPSCs以5×104个/孔接种至已放好细胞爬片的24孔细胞培养板,待第2天细胞贴壁后进行波形蛋白(Vimentin)、细胞角蛋白(Cytokeratin)免疫荧光实验分析,操作步骤如下: 用PBS浸洗细胞爬片3次,每次3min;用4%的多聚甲醛固定爬片15min后使用0.5% Triton X-100(PBS配制)室温下处理20min;PBS漂洗后山羊血清室温封闭30min;吸水纸吸掉封闭液,每张爬片滴加足够量的一抗并放入湿盒,4℃孵育过夜;PBST浸洗爬片3次,每次3min,吸水纸吸干爬片上多余液体后滴加稀释好的荧光二抗,湿盒中室温孵育1h,PBST浸洗爬片3次,每次3min;滴加DAPI避光孵育5min,对标本进行染核,PBST漂洗,洗去多余的DAPI;用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察并拍照。
1.5 流式细胞术检测细胞来源
收集对数期生长的第2代DPSCs,40μm细胞滤网过滤,制备单细胞悬液,调整细胞浓度到1×107个/mL;流式细胞管内加入400μL细胞悬液并分别加入抗体各10μL: 抗人CD34、抗人CD45、抗人CD90、抗人CD105、抗人CD146,设置对应的阴性对照组;避光条件下于冰上孵育30min,离心半径10cm,1000r/min,离心5min后去除上清液,PBS清洗细胞并重悬至500μL,流式细胞术检测细胞来源。
1.6 CCK8法检测LiCl对DPSCs细胞增殖的影响
配制浓度为0.1、1.0、2.5、5.0、10mmol/L的LiCl条件培养液,均含有10%胎牛血清与1%青霉素链霉素混合液。使用胰蛋白酶将第3代DPSCs消化后制备细胞悬液,以2×103个/孔的密度接种于96孔板,于37℃、5% CO2培养箱中培养24h,待80%融合生长后,将各组样本孔内培养液换为上述配制好的LiCl条件培养基,正常DMEM培养基作为对照组,每组设置5个复孔,每孔200μL,将细胞置于培养箱中继续培养,隔天换液。分别于第1、3、5、7天取出检测组,弃掉原培养液,PBS清洗1次,加入含有10% CCK-8试剂的100μL PBS,孵育箱孵育2h取出酶标仪测定各孔450nm处吸光度值(A450),记录结果,以培养天数为横坐标,吸光度值为纵坐标绘制细胞生长柱状图。
1.7 LiCl对DPSCs细胞矿化的影响
1.7.1 矿化形成实验 配制矿化诱导条件培养基(osteogenic medium,OM): 含10% FBS的DMEM培养液,加入β-甘油磷酸钠、抗坏血酸和地塞米松,终浓度分别为10mmol/L、0.05mmol/L和100mmol/L,避光,4℃保存。第3代DPSCs消化后制备细胞悬液,以2×104个/孔的密度接种至24孔板,37℃、5% CO2培养箱中培养,待细胞融合至80%左右时,将各组样本孔内的培养液换为对应条件培养基,实验设置由CCK-8检测得出的最适宜浓度LiCl实验组(2.5mmol/L),矿化诱导对照处理组,含2.5mmol/L LiCl的矿化诱导处理组以及阴性对照组,共4组,每组各设3个复孔;每3d换1次液,分别第14、21天进行茜素红染色,体式显微镜观察并拍照,比较不同组别矿化效果的差别。
1.7.2 荧光定量PCR检测 将第3代DPSCs消化后制备细胞悬液,以2×105个/孔的密度接种至6孔板按上述方法矿化诱导培养14、21d后分别使用TRIzol法提取实验组与对照组DPSCs的总RNA,反转录成cDNA,检测碱性磷酸酶(alkaline phosph-atase,ALP)、骨涎蛋白(bone sialoprotein,BSP)、牙本质基质蛋白1(dentin matrix protein 1,DMP1)、牙本质涎磷蛋白(dentin sialophosphorin,DSPP)的表达,以GAPDH为内参,引物序列见表1。PCR反应参数: 95℃ 2min,95℃ 10s,60℃ 10s,72℃ 10s,共45个循环。
1.8 统计学处理
实验数据由SPSS 20.0软件进行单因素方差分析,P<0.05为差异具有统计学意义。

表1 人ALP、BSP、DMP1、DSPP、GAPDH引物序列
2 结 果
2.1 原代人牙髓干细胞的形态学观察
倒置显微镜下观察发现,在原代组织贴壁培养后的第5天可见组织块周围爬出细胞,呈短梭形,少数呈球形,见图1A。常规换液培养后,DPSCs生长较快,大多为短梭形,少数为三角形、多角形。对数生长期细胞生长约80%时进行传代,胰酶消化1min后可见细胞回缩变圆并从瓶壁上脱落,按照1∶3的比例稀释,传代培养,传代后1h开始重新贴壁,细胞形态为长梭形,传代培养的DPSCs生长很快,细胞呈漩涡样生长,见图1B,3~5d可爬满60mm培养皿的皿底,形成单层细胞。
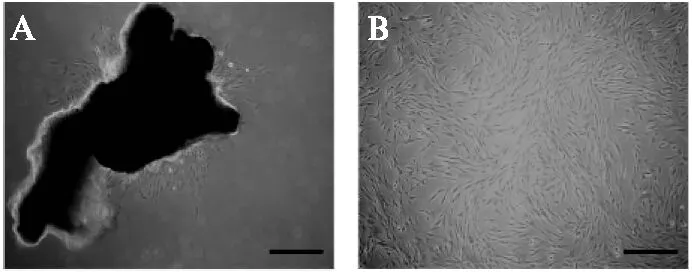
图1 体外培养的人牙髓干细胞Fig.1 Human dental pulp stem cells cultured in vitroA: 原代细胞培养第5天;B: 第三代牙髓干细胞传代培养第2天;标尺: 200μm
2.2 人牙髓干细胞免疫荧光染色结果
免疫荧光染色检测Vimentin、Cytokeratin 19的表达情况,结果显示DPSCs表达间充质细胞标志物Vimentin,见图2A~C,不表达上皮来源细胞表面标志物Cytokeratin,图2D~F。

图2 人牙髓干细胞免疫荧光染色结果Fig.2 Immunohistochemistry staining of human DPSCsA~C: Vimentin免疫荧光染色结果;D~F: Cytokeratin免疫荧光染色结果;标尺: 100μm
2.3 流式细胞术鉴定细胞表面标志物
流式细胞术对DPSCs进行细胞表面标志物鉴定,结果显示,细胞表面标记物CD90、CD105、CD146表达阳性,阳性率分别为98.3%、99.5%和69.9%,见图3A~C;CD34与CD45则几乎不表达,图3D~E。
2.4 LiCl对细胞增殖的作用
通过不同浓度LiCl对人DPSCs增殖影响的比较,发现低浓度(0.1、1mmol/L)LiCl对DPSCs的增殖情况无明显影响,而在较高浓度(5、10mmol/L)LiCl的作用下,随着培养时间增长,DPSCs的生长受到明显抑制。对于本实验研究,浓度为 2.5mmol/L 的LiCl对DPSCs的增殖有较好促进作用,差异有统计学意义(P<0.05)。因此,本实验的体外细胞实验研究中,选用2.5mmol/L作为DPSCs条件培养的最适宜浓度,见图4。
2.5 LiCl对牙髓干细胞矿化作用的影响
2.5.1 茜素红染色结果 DPSCs在矿化诱导培养后,可见2.5mmol/L LiCl处理组与对照组相比,矿化结节染色更深;随着时间推移,培养至21d时,矿化诱导下的2.5mmol/L LiCl处理组深染明显,见图5。
2.5.2 荧光定量PCR检测 DPSCs在诱导培养14d时,在LiCl的作用下,BSP表达明显升高,差异有统计学意义(P<0.05),而经矿化诱导的作用下,ALP与BSP表达均明显升高,差异有统计学意义(P<0.05)。培养后期,与对照组相比,LiCl培养组中BSP表达相对减少,而ALP表达差异无统计学意义。对于成牙本质相关基因DMP1、DSPP,在LiCl以及矿化诱导的作用下,早期表达量明显升高,差异有统计学意义(P<0.05),当培养至后期,DMP1表达量比对照组减少,而DSPP表达量则无明显差异,见图6。

图4 不同浓度LiCl对DPSCs增殖的影响Fig.4 Effect of different concentration of LiCl on the DPSCs proliferation*P<0.05,**P<0.01

图5 LiCl对DPSCs矿化作用(茜素红染色,×40)Fig.5 Effect of LiCl on the mineralization of DPSCs(Alizarin red staining,×40)标尺: 200μm

图6 荧光定量PCR检测LiCl对DPSCs矿化作用Fig.6 Effect of LiCl on the mineralization of DPSCs by qPCRA: 14d;B: 21d;*P<0.05
3 讨 论
成牙本质细胞是一种特殊的牙髓结缔组织细胞,有形成牙本质的作用,是牙髓牙本质复合体的特征性细胞,但它被认为是分裂后细胞或终末细胞,不再有进行有丝分裂的能力。当牙体组织受到损伤而导致牙髓组织暴露时,深层的牙髓干细胞受到浅层细胞凋亡信号的刺激被激活,然后迁移至损伤区域分化形成修复性牙本质来保护牙髓[5-6]。Gronthos等[7]在2000年首次从人第三磨牙牙髓组织中分离培养出牙髓干细胞,并进一步诱导其多向分化,验证其干细胞特性。Iohara等[8]成功分离培养猪牙髓干细胞后与骨成型蛋白2缓释微球相结合,植入活髓切断后的犬牙髓腔内,发现DPSCs向成牙本质细胞分化并促进修复性牙本质的形成。因此,目前对于修复性牙本质形成的研究主要通过诱导DPSCs向成牙本质细胞方向分化来进行。随着研究的进一步深入,Tran-hung[9]等提出,牙髓损伤的恢复还需要牙髓成纤维细胞的增殖分化、神经纤维的生长以及血管的再生;当牙髓发生损伤时,牙髓干细胞利用牙髓成纤维细胞表达的成纤维细胞生长因子-2和血管内皮生长因子促进形成的新生血管,进一步向成牙本质细胞增殖分化,从而形成修复性牙本质。本实验通过分离、培养与鉴定人牙髓干细胞,建立牙髓牙本质复合体再生的细胞研究模型,更能模拟临床中牙髓意外暴露后细胞的增殖与分化过程,为后续的牙髓干细胞生物学行为提供相应的实验基础。
Wnt信号通路分为经典Wnt/β-catenin信号通路以及其他非经典通路。Wnt1、Wnt3、Wnt3a、Wnt7a、Wnt7b、Wnt8a等蛋白分子,能有效激活经典Wnt信号通路。Wnt蛋白的受体是卷曲蛋白(frizzled, Fz),其胞外N端具有富含半胱氨酸的结构域(cystei-nerichdomain, CRD),能与Wnt结合,其胞内区作用于蓬乱蛋白(dishevelled, Dsh或Dvl),Dsh与其他蛋白一起阻断β-catenin的降解途径,从而使β-catenin在细胞质中积累,并进入细胞核,与T细胞因子/淋巴增强子因子(T cell factor/lymphoid enhancer factor, TCF/LEF)相互作用,调节靶基因的表达,此时信号通路被激活[10]。而LiCl作为β-catenin降解蛋白GSK-3β的抑制剂,可以抑制胞质内β-catenin的降解,起到上调经典Wnt通路的作用[11-12]。相关研究[13]表明,一定浓度的LiCl对骨髓间充质干细胞增殖、成骨分化起到促进作用。为此,本课题组猜测LiCl对DPSCs在细胞增殖与细胞分化过程中起到同样的促进作用。
本研究发现低浓度的LiCl(0.1、1.0mmol/L)对DPSCs细胞增殖无明显促进作用,而较高浓度(5.0、10.0mmol/L)则明显抑制细胞增殖。对于本实验研究结果显示,2.5mmol/L浓度的LiCl作用于DPSCs具有明显促进细胞增殖的作用。这与Han等[14]研究结果类似。依据上述结果,本实验选用2.5mmol/L浓度的LiCl探讨其对于细胞成牙/成骨分化的作用,可明显观察到矿化结节的形成。作为DPSCs向成牙本质细胞分化的早期标志物的ALP,参与了早期矿化过程[15],因此ALP的活性升高是牙髓干细胞分化的开始,而BSP则是成骨分化过程中的标志物[16]。作为成牙向分化的标志蛋白,DMP1在体内参与调节牙体生长发育、形态发生以及部分骨组织的形成[17];DSPP在牙本质形成过程中起到重要的调节作用[18]。因此,上述基因的升高均为干细胞成牙/成骨分化的标志。为了证明LiCl在诱导矿化并伴随有成牙本质/成骨基因表达的增加,本研究通过实时定量PCR检测ALP、BSP、DSPP及DMP1的mRNA表达,结果显示LiCl对上述成牙/成骨基因表达均有一定的促进作用,证明了LiCl对DPSCs具有促进矿化的作用。然而,当培养至21d 时,所有基因与对照组相比,较14d表达均有所下调,是由于此时的矿化诱导培养组的细胞已完全长满于孔内,对照组仍有生长的空间,能够缓慢表达相关基因。因此实验组相关基因表达趋势相对减缓可能是培养环境与条件受限有关。
综上所述,本研究认为适宜浓度的LiCl对牙髓干细胞具有良好的促进增殖、成牙/成骨向分化的作用,这可能与其通过激活Wnt/β-catenin信号通路,上调相关基因表达的结果有关,相关机制仍须深入探讨,而对于Lid能否作为有效的盖髓材料则需动物盖髓实验作进一步研究。

