猪圆环病毒1型与2型双重PCR检测方法的建立及应用
王立娇,胡胜云,张 雪, 3,陈天慧,于红欣,周双海*
(1.北京农学院动物科学技术学院,北京 102206;2. 房山区动物疫病预防控制中心,北京 102400;3. 怀柔区动物疫病预防控制中心,北京 101400)
以断奶后多系统衰竭综合征为主的猪圆环病毒(porine circovirus,PCV)疾病是危害当前养猪业的一种重要传染病,猪圆环病毒2型(PCV2)是其必需病原[1]。先于PCV2之前发现的PCV1也存在于一些猪群和传代细胞系中[2, 3],虽然一般认为其无明显致病性,但有研究报道PCV1可能具有潜在致病性或影响疾病的发展[4, 5],且其全基因组核苷酸序列在大多数区域与PCV2具有高度一致性[6],故PCV1的存在或污染很可能会干扰PCV2的检测或研究结果。建立一种快速鉴别PCV1与PCV2的检测方法是必要的。
目前,PCR技术已成为检测病原的快速、特异、敏感的一种方法。虽然荧光PCR方法在敏感性方面有时高于常规PCR方法[7, 8],但其检测成本较高。与单项PCR检测方法相比,多重PCR方法在检测多种病原时可明显提高检测效率。本研究旨在建立一种能够快速鉴别PCV1和PCV2的双重PCR检测方法,并初步进行临床应用。
1 材料与方法
1.1 病毒模板
PCV1、PCV2、猪细环病毒(TTSuV)、伪狂犬病病毒(PRV)等病毒DNA模板由本实验室保存。
1.2 引物设计
根据GenBank中的PCV1和PCV2核苷酸序列,用primer 5.0软件设计2对特异性引物,引物序列分别为1U:5′-CGAAGGCCGATTTGAAGCAGTG-3′、1F:5′-TGCACAGCCCAAAATTATGTGGTAAG-3′和2U:5′-GGTTAGGGCATTGGCCTTT-3′、2F:5′-TCCCGCACCATCGGTTAT-3′,目的片段大小分别为184 bp和264 bp。
1.3 单项PCR方法的扩增产物鉴定及其条件筛选
用2×Taq MasterMix建立25 μL PCR反应体系,其中含有1.5 μL的病毒DNA模板、10 pmol上游引物与10 pmol下游引物。PCR反应程序为:95℃ 4 min;95℃ 30 s,54℃ 30 s,72℃ 30 s,35 cycles;72℃ 10 min。之后取6 μL PCR扩增产物在20 g/L的琼脂糖凝胶上进行电泳观察,并回收纯化目的PCR产物进行克隆与测序,对测序结果在NCBI上进行BLAST比对。同时在此基础上,筛选单项PCR反应的退火温度和引物浓度以确定最佳单项PCR反应条件。
1.4 双重PCR方法条件筛选
以单项PCR反应体系和步骤为基础,在单项PCR方法条件优化结果的基础上对双重PCR反应的退火温度与两种引物浓度比例进行筛选,以确定最佳双重PCR反应条件。
1.5 双重PCR方法的特异性与敏感性试验
用TTSuV1、TTSuV2、PRV等常见DNA病毒模板来检测该双重PCR方法的特异性。选取5个稀释度的PCV1 DNA浓度(1.7×105~1.7×101copies/μL)与PCV2 DNA浓度(4.0×105~4.0×101copies/μL)为模板来检测该双重PCR方法的敏感性。
1.6 临床样品检测与统计分析
采集2013—2017年京津冀地区15个猪场145份断奶仔猪淋巴结,称取0.15 g用1 mL灭菌生理盐水进行研磨,冻融3次,12 000 r/min离心7 min,取200 μL上清,按照天根生化科技公司DNA提取试剂盒说明书提取病毒DNA,溶解于50 μL灭菌ddH2O中。用双重PCR检测方法和单项PCR检测方法分别检测,并随机选取3个检测阳性样品的PCR产物进行测序鉴定。用卡方检验比较两种方法检出的PCV1与PCV2的个体阳性率、猪场阳性率之间的差异和PCV1与PCV2的检出率之间的差异。
2 结果与分析
2.1 单项PCR产物鉴定及其反应条件的优化
以PCV1、PCV2的细胞毒DNA为模板分别进行PCR扩增,扩增出约184 bp和264 bp片段大小的目的产物。回收目的PCR产物后进行克隆与测序鉴定,BLAST比对结果显示目的PCR产物与目标基因序列同源性完全一致,证实扩增片段为PCV1或PCV2的目标序列。
不同退火温度进行的单项PCR扩增结果(见图1)显示,PCV1和PCV2的目的条带分别在退火温度范围为52~56℃、54~56℃之间较亮,故将二者退火温度范围确定为54~56℃。
不同的模板浓度和引物浓度的PCR扩增结果(见图2)显示,PCV1和PCV2的目的条带都是在其引物浓度为10 μmol/L时最亮、5 μmol/L时次之,故将二者引物浓度范围确定为5~10 μmol/L。

注:A是PCV1;B是PCV2;M是DNA Marker;1-4是退火温度分别为50、52、54、56℃;5是阴性对照。Note: A was PCV1;B was PCV2;M was DNA Marker; 1-4 was different annealing temperature (50、52、54、56℃); 5 was negative control.图1 单项PCR退火温度的筛选Fig.1 Screening of annealing temperature for the single PCR

注:A是PCV1;B是PCV2;M是DNA Marker;1-3是引物浓度分别为2.5、5、10 μmol/L。Note: A was PCV1;B was PCV2;M was DNA Marker; 1-3 was different concentration of primer (2.5, 5, 10 μmol/L).图2 单项PCR引物浓度的筛选Fig.2 Screening of primer concentration for the single PCR
2.2 双重PCR方法条件的优化
不同退火温度与不同引物浓度比例的PCR结果显示(见图3)反应,在引物浓度比例固定的情况下,退火温度为55℃时目的条带更亮,故确定为最佳退火温度;在退火温度固定的情况下,PCV1与PCV2的引物浓度比例为5 μmol/L比5 μmol/L时2条目的条带都较亮,故确定为最佳引物浓度比例。

注:M是DNA Marker;1-4、5-8、9-12是退火温度分别为54、55、56℃;1、5、9是PCV1与PCV2的引物浓度比例为5 μmol/L比5 μmol/L;2、6、10是PCV1与PCV2的引物浓度比例为5 μmol/L比10 μmol/L;3、7、11是PCV1与PCV2的引物浓度比例为10 μmol/L比5 μmol/L;4、8、12是PCV1与PCV2的引物浓度比例为10 μmol/L比10 μmol/L;13是阴性对照。Note:M was DNA Marker; 1-4 was annealing temperature of 54℃; 5-8 was annealing temperature of 55℃; 9-12 was annealing temperature of 56℃; 1, 5 and 9 meant that ratio of primer concentration for PCV1 to PCV2 was 5 μmol/L to 5 μmol/L; 2, 6 and 10 meant that ratio of primer concentration for PCV1 to PCV2 was 5 μmol/L to 10 μmol/L; 3, 7, 11 meant that ratio of primer concentration for PCV1 to PCV2 was 10 μmol/L to 5 μmol/L; 4, 8 and 12 meant that ratio of primer concentration for PCV1 to PCV2 was 10 μmol/L to 10 μmol/L; 13 was negative control.图3 双重PCR退火温度与引物浓度的筛选Fig.3 Screening of primer concentration and annealing temperature for the duplex PCR
2.3 双重PCR方法的特异性与敏感性试验
特异性试验结果(见图4)显示,仅含有PCV1、PCV2的DNA模板扩增出特异性目的产物条带,表明建立的双重PCR检测方法具有良好特异性。
敏感性试验结果(见图5)显示,能够扩增出PCV1与PCV2的特异目的产物条带的最低浓度分别为1.7×103、4×103copies/μL,故确定这2个数值为双重PCR检测方法的相应灵敏度。
2.4 临床样品的检测与分析
用单项PCR和双重PCR方法对2013—2017年京津冀地区15个猪场的断奶仔猪临床样品进行检测,结果(见表1)显示,PCV1的单项PCR与双重PCR的检测阳性率分别在0%~37.5%、0%~30.8%之间,其总个体阳性率分别为15.9%、11.7%,二者之间无显著差异(P>0.05),符合率为95.9%;并且2种PCR方法检出的PCV1猪场阳性率都是53.3%。PCV2的单项PCR与双重PCR的检测阳性率都在62.5%~100%之间,其总个体阳性率分别为82.8%、77.2%,二者之间无显著差异(P>0.05),符合率为94.5%;所检出的猪场阳性率均为100%。随机选取3个检测阳性样品的PCR产物进行克隆与测序鉴定,结果显示所克隆序列与相应参考序列的核苷酸同源率均达99%以上,证实PCR检测结果的确为PCV1或PCV2,说明临床检测结果有很好的特异性。
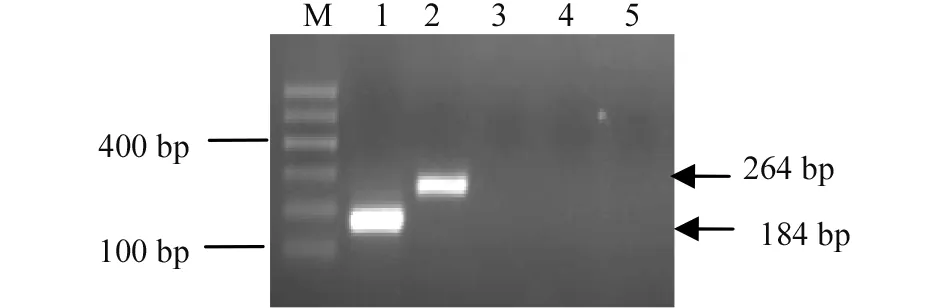
M:DNA Marker;1:PCV1;2:PCV2;3:PRV;4:TTSuV1;5:TTSuV2图4 双重PCR的特异性检测Fig.4 The specificity of the duplex PCR

注:M是DNA Marker;1-5是PCV1和PCV2的DNA浓度分别为1.7×105~1.7×101 copies/μL、4.0×105~4.0×101 copies/μL;6是阴性对照。Note:M was DNA Marker; 1-5 was DNA concentration of PCV1 (1.7×105~1.7×101 copies/μL) and PCV2 (4.0×105~4.0×101 copies/μL); 6 was negative control.图5 双重PCR的敏感性试验Fig.5 The sensitivity of the duplex PCR
进一步分析发现(见表1),PCV2的个体阳性率超过70%而极显著(P<0.01)高于PCV1的不足20%。同时,PCV2的猪场阳性率为100%,极显著(P<0.05)高于PCV1的53.3%。

表1 临床样品中PCV1与PCV2检出率的比较Tab.1 Comparison of detection rate of PCV1 and PCV2
注:同列数据尾部有不同大写字母者表示差异极显著(P<0.01)。
Note:Those data with different capitals at the end of the same column indicated very significant differences (P<0.01).
3 讨 论
建立多重PCR方法时在引物设计环节必须充分考虑目的检测基因序列与实际扩增效果。PCV1与PCV2同属于猪圆环病毒,二者不仅在全基因组大小与组成结构方面相似,还在大多数核苷酸区域具有高度一致性[6],故只能在两段序列一致性较低的区域设计引物,同时还需通过实际扩增来检测引物特异性。经多次试验后,本研究筛选出2对特异性引物,在实际扩增中能够很好区分PCV1与PCV2。
通常情况下,多对引物存在于同一反应体系中容易互相产生干扰作用,使得PCR反应的敏感性降低而造成假阴性结果增多是多重PCR方法的主要缺陷。崔尚金等[9]建立的猪圆环病毒多重PCR检测方法可以检测到10 ng的总DNA浓度,推算出大致相当于107copies/μL病毒DNA;徐磊等[10]建立的PCV1、PCV2a和PCV2b的多重PCR检测方法中灵敏度分别为4.87×107、2.83×107、2.96×106copies/μL病毒DNA;二者较单项PCR方法的灵敏度降低了2个数量级。陈钜豪[11]等建立的PCV1和PCV2双重PCR鉴别诊断方法的灵敏度分别为0.1 ng和0.01 ng病毒核酸,推算出大致相当于104~105copies/μL。本试验建立的方法中PCV1和PCV2的灵敏度分别为1.7×103、4×103copies/μL病毒DNA,显示出较前述研究报道更高的敏感性。对145份断奶仔猪淋巴结的比较检测显示,两种猪圆环病毒的双重PCR检测结果都接近于各自单项PCR检测结果,二者之间的符合率分别为95.9%和94.5%;同时,建立的方法对当前比较流行的猪源DNA病毒的检测结果均为阴性,对临床检测阳性的样品的随机测序鉴定结果全部证实为特异目的产物。这些结果说明建立的双重PCR检测方法具有很好的特异性与较高的灵敏性,可应用于临床检测。
对2013—2017年京津冀地区10个猪场145份断奶仔猪淋巴结进行了PCV1和PCV2的双重PCR检测,结果显示,PCV1和PCV2的猪场阳性率与个体阳性率分别为53.3%、11.7%和100%、77.2%,都是PCV2极显著(P<0.01)高于PCV1,说明当前这些猪场中PCV2感染明显多于PCV1感染。陈钜豪[11]等对广东省98份仔猪临床病料的检测发现PCV1和PCV2的检出率分别为2.0%和38.8%;徐磊等[10]检测了陕西省的56份临床样品,发现PCV1和PCV2的检出率分别为57.14%和44.64%;于红欣等[8]对京津等地40头断奶仔猪和60头肥育猪的血清检测结果显示,PCV1阳性率分别为17.5%和38.3%;马增军等[12]检测了京津冀地区22个猪场398份血清,发现PCV2平均血清阳性率为84.2%。本研究结果与上述报道结果显示,中国大多数猪场存在很高的PCV2感染率,部分猪场还存在一定程度的PCV1感染率,但是PCV2感染在当前多数猪群中较PCV1感染占有明显优势。

