不同载气气氛下煤样热解特性及其动力学参数研究
王小华,赵洪宇,宋 强,李玉环,舒新前
(1.中国矿业大学(北京) 化学与环境工程学院,北京 100083;2.北京科技大学 土木与资源工程学院,北京 100083;3. 内蒙古工业大学 能源与动力工程学院,内蒙古 呼和浩特 010000)
煤热解是在隔绝空气或惰性气氛条件下加热,发生一系列物理、化学变化的复杂反应过程[1,2]。热解所获得产品丰富,既包含高值的可燃煤气和相对清洁的固体燃料,又包含由多种芳香烃化合物组成的焦油等基础化工原料。而包括煤的热解特性、热解动力学、加氢液化和加催化剂等附加条件的热解一直都是研究热点[3-5]。由于热解动力学研究所获得的参数可为煤的热解过程提供反应时间、转化率、热解速度、供热要求等工程设计所需的基础数据。因此,对于煤热解过程中热解动力学参数的研究就显得尤为重要。针对煤在不同热解条件下动力学参数分布规律国内外学者也展开了多参数条件下的的基础和应用研究,获得了很多研究成果。例如,蔡连国[6]等通过煤程序升温与等温热解特性及动力学比较研究发现,等温热解过程中CO2和CO的析出先于CH4和H2,微型流化床等温快速热解的挥发分气体总量析出活化能小于程序升温热解的活化能。刘钦甫[7]等通过煤热解气体主产物及热解动力学分析证实,随着煤化程度增大,热解反应活化能逐渐降低,其热效应强度和发生热解反应的能力逐渐降低。邱朋华[8]等通过碱及碱土金属对准东煤热解特性及动力学影响分析发现,原煤和脱灰煤样品的热解活化能均随转化率的增大而升高。但公开报道的文献更多地集中于反应器类型、原料以及反应参数对热解动力学参数的影响,热解反应气氛的变化对反应过程中的动力学参数的影响缺乏深入探讨。因此,基于目前的研究基础,从载气气氛差异对煤样热解特性层面上探讨以模拟热解气作为载气对烟煤进行热重分析的热转化过程中的动力学参数变化规律是值得深入研究的课题。
为此,本文选用来自陕西榆林(代号:SY)的烟煤,采用热重分析仪(TG)研究了在模拟热解气氛下对煤样热解特性及动力学参数的影响,分析了产生差别的深层次原因,拟为固定床热解烟煤制备高值燃料的工业放大提供基础数据。
1 实验材料与方法
1.1 实验样品
将原煤煤样在实验室进行粉碎和筛分,得到小于1mm的筛下物,然后将上述所得煤样进行研磨和再次筛分,所得筛下物煤样装入密封袋并贴标签,储藏在冰箱中。采用国标GBT212—2008对实验煤样进行工业分析和元素分析,实验结果见表1。
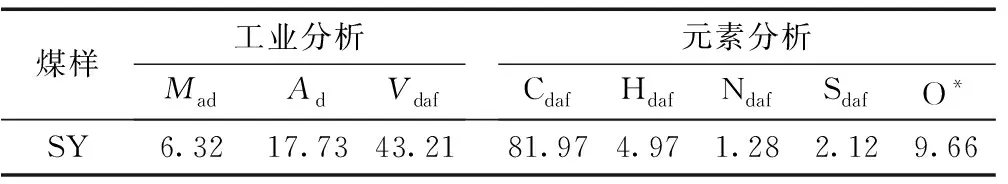
表1 煤样工业分析和元素分析 %
注:*为差减法计算。
1.2 TG分析
采用日本精工电子纳米科技有限公司生产的TGA热重分析仪,实验时取实验样品质量为15mg左右置于热重分析仪的三氧化二铝坩埚内,载气分别为N2、CH4、CO2、H2以及CO2+CH4(体积分数各为50%),流量为100mL/min。待通入将体系内的空气被置换后,以30℃/min的升温速率将样品由室温加热到1000℃。四级杆质谱仪与上述热重分析仪通过不锈钢毛细管相连接,用来分别不同气氛下气相产物释放规律。质谱离子电压为100eV,通过电子碰撞电离析出的气体产物,并对具体质荷比的离子流数据进行分析。所得电信号(离子流强度)经过最大离子流强度和 样品重量归一化后进行比较。
1.3 动力学
煤的程序升温热解实验的动力学处理方法比较常用的有Doyle[9]和Coats-Redfern’s法[10]法等。本实验选用Coats-Redfern’s法处理TG数据。动力学计算方法在以前的研究中已经有所描述[10],这里不在重述。
2 结果与讨论
2.1 煤样热重分析
煤样在不同热解气氛下热重分析结果如图1所示。由图1可知,HL煤样的热解大致可分为三个阶段,第一阶段温度区间为室温~388℃;第二阶段为388~605℃,第三阶段为605~1000℃。在热解反应第一阶段,煤样在不同热解气氛下均出现微小失重,这主要是由于煤吸附的小分子的脱附和一些易发生反应的官能团的分解析出[11]。在400℃之前,除了在H2气氛下煤样失重率较大外,达到18.34%,在其他热解气氛下,煤样失重率相差较小,达到12%左右,这说明在煤样大规模发生热解反应之前,热解气氛对于煤样中挥发分的析出影响不大。在热解反应第二阶段,是快速失重阶段,是煤的热解反应的主要阶段,此时五种气氛下的失重率也相差不大,达到40%左右,通过DTG曲线可知,在480℃左右出现最大失重速率峰,失重速率由小到大依次为0.12(CH4)< 0.17(N2)< 0.20(CO2+CH4)<0.21(CO2)< 0.26(H2)mg/min。这主要是由于在此温度段煤样发生大规模的解聚和分解反应,煤样黏结形成半焦,并在此过程中释放大量气相产物。在热解反应的第三阶段,大部分能发生反应的化学键在这一阶段断裂,包括大分子中的桥键断裂生成自由基,芳香核的脂肪侧链断裂生成挥发性气体和焦油以及部分含氧官能团的断裂。N2、H2以及CH4气氛下煤样的失重速率逐渐降低,而在含有CO2气氛下热解的煤样的失重速率迅速增大,这主要是由于当热解温度高于600℃时,煤样与CO2发生气化反应,使煤样失重率迅速增大。而H2气氛下煤样失重率较大,这可能是由于在较高热解温度下H2与煤中某些碳结构发生加氢反应形成挥发分析出,进而导致煤样失重率增大。由于CO2浓度不同,因此导致单独CO2气氛下气氛下的煤样的失重速率大于CO2+CH4气氛。
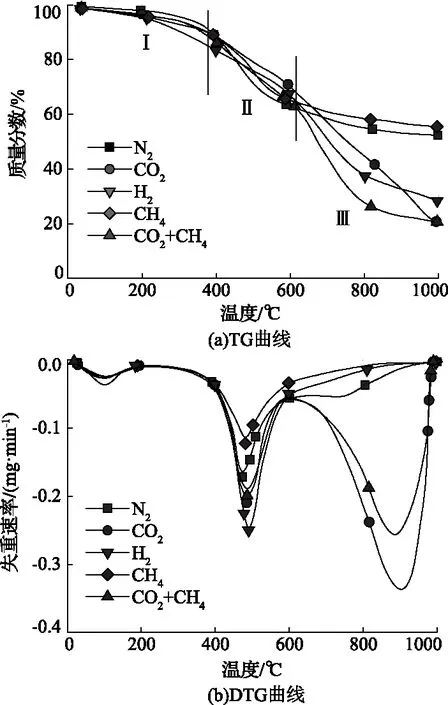
图1 煤样在不同热解气氛下热重分析
2.2 气体产物释放规律
不同热解气氛下热解气体产物释放规律如图2所示。由图2(a)可知,不同热解下气体产物CH4的释放规律基本相同,随着热解温度的升高,释放强度逐渐增大。N2、CO2+CH4混合气氛下达到最大释放强度在505℃左右,而在H2、CH4和CO2气氛下CH4最大析出强度峰向高温段推移,且CO2气氛下CH4最大析出温度推移最多,达到597.68℃。这可能是由于CH4主要来自氢化芳香族官能团的分解,而在CO2气氛下煤热解产率的含氢自由基首先与含氧自由基反应,形成水产物,相当于“延迟”了芳香族官能团中亚甲基与含氢自由基的反应。
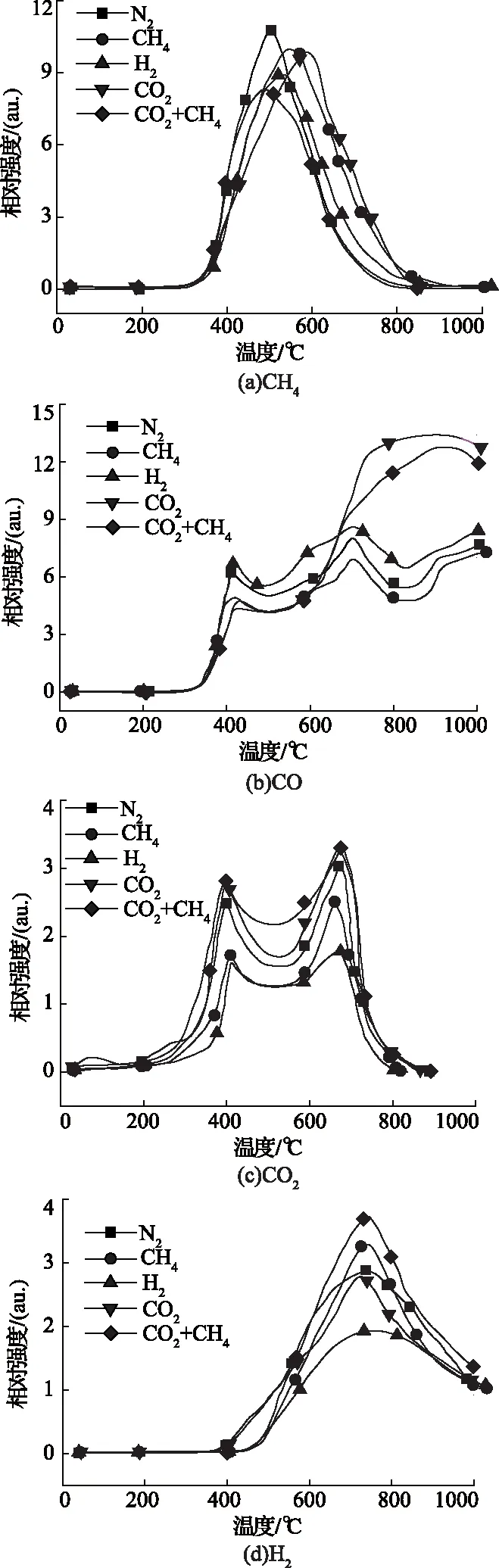
图2 煤样在不同气氛下气体产物释放规律
对比图2(b)和(c)可知,当热解温度低于600℃时,不同热解气氛下热解气体产物CO和CO2释放规律相似,这主要是由于在较低的热解温度下,CO和CO2主要是由羧基和羧基化合物分解产生;而在高温条件下,这两种气体主要是从醚结构、醌类以及含氧杂环化合物的分解。而由图2(b)可以看出,在CO2和CO2+CH4混合气氛下在热解温度大于600℃时,热解气相产物CO释放强度迅速增大,且CO2+CH4混合气氛下CO的释放强度小于CO2气氛下。这主要是由于当热解温度大于600 ℃时,煤样与CO2发生气化反应释放CO,CO2+CH4混合气氛下CO2气体分压小于单独CO2气氛下的分压。
由图2(d)可知,随着热解温度升高,H2析出强度增大,CO2+CH4混合气氛下H2析出强度最大,而在H2气氛下热解产物H2析出强度最小,这主要是由于CO2+CH4混合气氛下CO2和CH4发生重整反应,释放出甲基、亚甲基以及含氢自由基[12],而这些自由基与煤样本身热解产生的含氢自由基反应形成H2,进而导致CO2+CH4混合气氛下H2析出强度最大。
2.3 动力学分析
在本文的研究中,用Coats-Redfern 积分法对不同气氛下煤样热解过程中热解反应初始阶段(Ⅰ)、热解反应第二阶段(Ⅱ)以及热解反应第三阶段(Ⅲ)的动力学参数进行计算。以在N2气氛热解为例,ln[G(x)/T2]与1/T关系如图3所示,反应动力学参数见表2。在本研究中,根据转化率x分别计算出每个热解阶段的动力学参数。由表2可以看出,在N2和CO2气氛下采用一级反应(n=1)和二级反应(n=2)可以更好的表示煤的热解过程,此时R2>0.99。而在CO2气氛下,在热解反应第二阶段和第三阶段,则采用二级反应(n=2)和三级反应(n=3)可以更好的描述煤的热解过程,这主要是由于在CO2气氛下煤样与CO2发生气化反应过程中涉及的反应较多,这与前人的研究结果相一致[13]。在H2气氛下,在热解反应第一阶段,采用一级反应(n=1)可以更好的表示煤的初级热解过程,此时R2>0.99;而随着反应的进行,热解挥发分释放过程中,H2与挥发分中的自由基发生反应,使自由基得到电子形成稳定态。由于热解过程中,析出的挥发分中自由基种类较多,反应过程较为复杂,因此采用三级反应(n=3)可以更好的表示煤的热解过程,此时R2>0.99。
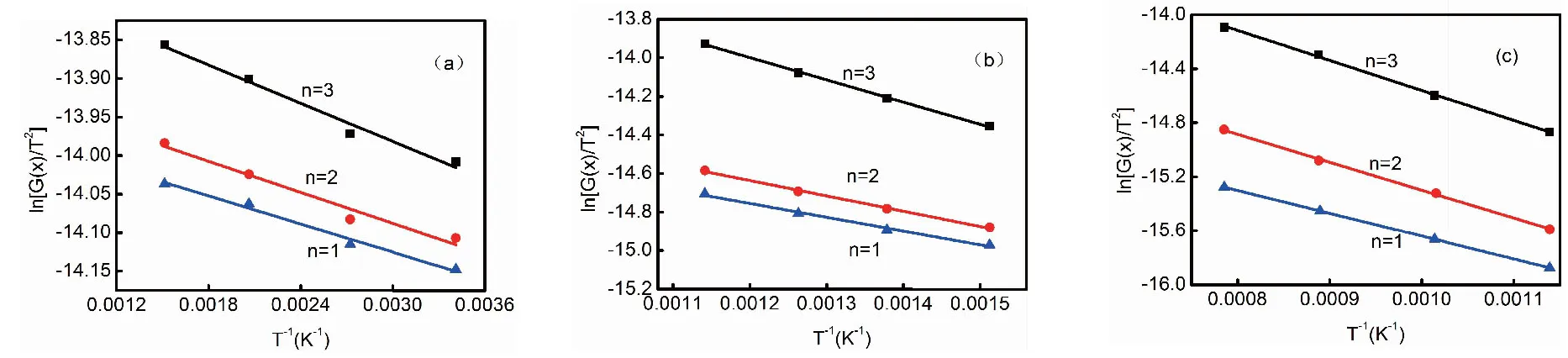
图3 煤样在N2下不同热解阶段的 ln[G(x)/T2]与1/T关系曲线
在CH4气氛下,由于CH4在相对较低的热解温度下(<600℃)性质较为稳定。因此,在热解反应第一阶段和第二阶段均可采用一级反应(n=1)进行描述热解过程;而随着热解温度升高,在热解反应第三阶段,CH4发生分解,形成甲基和含氢自由基,在热解过程过程中,这些自由基与煤热解挥发分形成的自由基反应。因此可采用三级反应(n=3)进行描述该热解反应过程[14]。而在CO2+CH4混合气氛下,在热解反应初始阶段可采用一级反应(n=1)描述热解过程,这与前人在CH4气氛下对煤样进行脱水的动力学研究结果相一致。而随着热解反应温度的升高,在第二热解反应和第三热解反应阶段,采用三级反应(n=3)描述热解过程更为合适,这主要是由于在混合气氛下,CH4和CO2发生重整反应过程中释放出含氢自由基,这些自由基参与了煤热解挥发分中自由基形成稳定化合物的反应进程[15]。
3 结 论
1)在煤样发生热解反应之前,热解气氛对于煤样中挥发分的析出影响不大。在480 ℃左右出现最大失重速率峰,失重速率由小到大依次为0.12(CH4)< 0.17(N2)<0.20(CO2+CH4)<0.21(CO2)<0.26(H2)mg/min。
2)不同热解气氛下,热解气体产物CO和CO2释放规律相似;在CO2和CO2+CH4混合气氛下在热解温度大于600℃时,热解气相产物CO释放强度迅速增大,且CO2+CH4混合气氛下CO的释放强度小于CO2气氛下。
3)在N2和CO2气氛下采用一级反应(n=1)和二级反应(n=2)可以更好的表示煤的热解过程。由于在混合气氛下,CH4和CO2发生重整反应过程中释放出含氢自由基,在第二热解反应和第三热解反应阶段,采用三级反应(n=3)描述热解过程更为合适。

