过表达Periostin蛋白对内皮前体细胞功能影响的实验研究
蔡 瑶,高 涌,余朝文
随着社会工业化、城市化的加速,动脉粥样硬化引起的心脑及外周血管疾病已成为全球人类第一大杀手[1]。在动脉血管内发生的一系列炎症反应,会导致血管内皮的增厚、管腔的狭窄,甚至是完全闭塞[1-2]。研究[3-4]表明,存在于骨髓和外周血中的内皮前体细胞 (endothelial progenitor cells,EPCs)在损伤血管的修复与重塑中起到了重要的作用。Periostin蛋白又名骨膜蛋白,是细胞外基质蛋白家族的一种[5]。有研究[5-7]报道,Periostin蛋白对于恶性肿瘤的转移以及瘤体血管的建立起着重要作用;而用特异性抗体阻断蛋白的表达,将会导致肿瘤细胞及内皮细胞迁移能力的改变。本实验通过分离、培养和鉴定小鼠EPCs,采用CCK-8法、划痕法、Transwell小室法和流式细胞仪检测等方法,探讨Periostin蛋白过表达对EPCs生物学功能的影响,以期为后期深入研究过表达Periostin蛋白的EPCs体内实验和调控机制奠定基础。
1 材料与方法
1.1 主要试剂及材料 DMEM培养基(Gibco公司),内皮前体细胞分离试剂盒及F液(天津灏洋生物),多聚甲醛(国药集团),结晶紫染色液(国药集团),荧光(Cy3)标记羊抗兔 IgG (武汉博士德生物工程有限公司),CD34(种属:兔)抗体(Abcam公司),寡核苷酸Oligos、慢病毒载体质粒Lentivirus5及测序(吉玛基因公司),Matrigel Basement Membrane Matrix(BD公司),Mouse ELISA Kit(ab193727 Periostin),Trypsin-EDTA Solution(Hyclone公司),多标记微孔板检测仪(PerkinElmer EnSpire公司),CCK-8试剂盒(DOJINDO公司),Transwell小室(Corning公司)。
1.2 方法
1.2.1 小鼠EPCs分离、培养和鉴定 取20只C57BL/6小鼠(昆明医学院实验动物中心提供),雌雄不拘,4~5周龄,体质量 18~20 g,饲养于恒温18~20 ℃和恒湿50%~80%条件的SPF级动物实验室,自由摄取标准饲料与无菌水,EPCs的分离、培养及免疫荧光的鉴定参照文献[8-9]进行。
1.2.2 目的基因调取、PCR扩增 通过美国国立生物技术信息中心(NCBI,National Center for Biotechnology Information)查找小鼠Periostin 基因序列信息,ID:50706;Periostin基因长度:2 436 bp。Oligo设计,Periostin基因目的基因上下游引物分别加上NotⅠ和BamHⅠ及保护碱基,将 Oligo溶解成50 μmL后,分别取相同体积至1.5 mL离心管,混合均匀,配成Oligo混合液;用配置好的Oligo混合液行第一轮PCR反应;用Oligo-1和Oligo-64进行第二轮PCR反应,模板为第一轮PCR反应的产物;再用第一轮的PCR产物为模板,通过第二轮PCR则可获得单一的目的基因条带。PCR反应完成后,利用Agarose电泳并切胶回收基因片段。
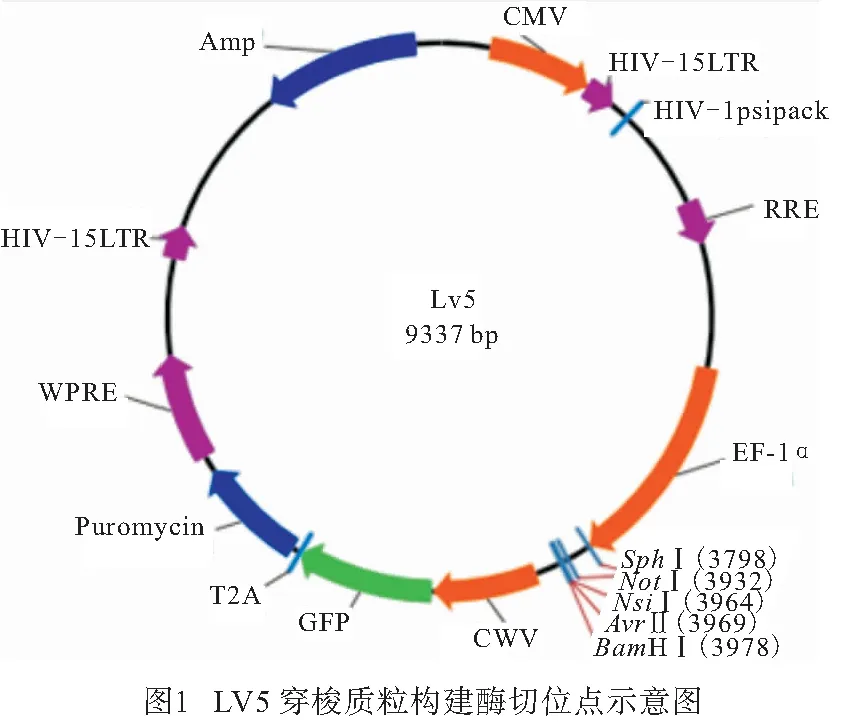
1.2.3 载体的构建及测序验证 用NotⅠ和BamHⅠ对Periostin基因片段慢病毒载体LV5进行酶切,T4 DNA连接双酶切得到的Periostin基因片段和线性化的载体(见图1),用氯化钙法制备感受态细胞,将连接产物转化感受态细胞,取200 μL阳性克隆对应的菌液送测序,并将剩余的菌液用甘油保存;将测序结果与目的基因序列进行对比,正确无误后,用保存的甘油菌液接菌LB培养基,进行大量质粒抽提,得到足够的重组质粒。
1.2.4 慢病毒侵染 取出培养的细胞,镜下确认EPCs生长状态良好,经过消化酶消化后重悬,提取适量细胞接种于6孔培养板中,放置于37 ℃、5%CO2饱和湿度条件下培养箱中继续培养过夜;取慢病毒培养液(Lentivirus-NC病毒液)与细胞共培养24 h;将其放置在荧光倒置显微镜下观察。
1.2.5 Western blotting检测目的蛋白表达 将目的细胞总蛋白转置PVDF膜上,置于含Periostin鼠单抗(1∶500)的封闭液中,4 ℃,24 h后同辣根过氧化物酶标记的相应二抗(1∶600)共同孵育(室温)1.5 h,并与化学发光底物结合5 min。β-actin作内参。
1.2.6 细胞增殖实验 按照实验设计分为过表达慢病毒组、阴性对照组和空白对照组3组,将生长状态良好的EPCs及其稳筛株用消化酶消化后重悬,然后吸取适量细胞按照每组5个复孔,重复接种至96孔培养板中,37 ℃、5%CO2饱和湿度条件下的培养箱中培养24 h,后向每孔中加入10 μL的CCK-8溶液,然后放在培养箱内孵育1 h。孵育1h后用酶标仪测定各组细胞在450 nm处的吸光度,记录吸光度值,得到120 h细胞增殖实验数据。
1.2.7 细胞迁移实验 在12孔培养板的背后用Marker笔划3条水平直线,横穿过孔。按照实验分组将状态良好的EPCs及其稳筛株消化后重悬,接种至12孔培养板中,接种原则为过夜后融合率达到80%以上。待细胞贴壁后,用枪头在每个孔中划2~3条垂直直线,与之前划的直线成垂直关系。更换新鲜无血清培养基,选取3个点拍照。拍照后于37 ℃、5% CO2饱和湿度培养箱中继续培养。24 h后拍照记录。
1.2.8 细胞侵袭实验 将冻存的Matrige稀释成1 mg/mL。取适量稀释的Matrigel铺于Transwell小室聚碳酸酯膜上,放置在37 ℃条件下1 h,等待Matrigel聚合成凝胶状态。再向每孔中加入200 μL DMEM液体培养基,使胶重构。将20% FBS培养基600 μL加入Transwell下室中。按照实验分组将状态良好的EPCs及其稳筛株消化后重悬,在上室孔中加入适量细胞,37 ℃、5% CO2饱和湿度培养箱中培养24 h。加入适量4%多聚甲醛,固定细胞30 min,加入适量结晶紫染色液,染色30 min;用适量PBS反复清洗小室,去除多余的结晶紫染色液;在倒置显微镜下观察拍照,每组3张照片。
1.2.9 细胞凋亡实验 按照实验分组将状态良好的EPCs及其稳筛株消化后重悬,取适量细胞接种至6孔板中。24 h后用Trypsin-EDTA free消化重悬细胞。加入400 μL 1×Binding Buffer悬浮细胞。将悬浮的细胞中加入5 μL AnnexinV-FITC,对其轻轻的混匀后放置于4 ℃避光条件下孵育15 min。再向细胞悬液中加入10 μL PI,再次混匀后置于4 ℃避光条件下孵育5 min。在1 h内,用Accuri C6 个人型流式细胞仪检测各组细胞凋亡的情况。
1.3 统计学方法 采用方差分析和q检验。
2 结果
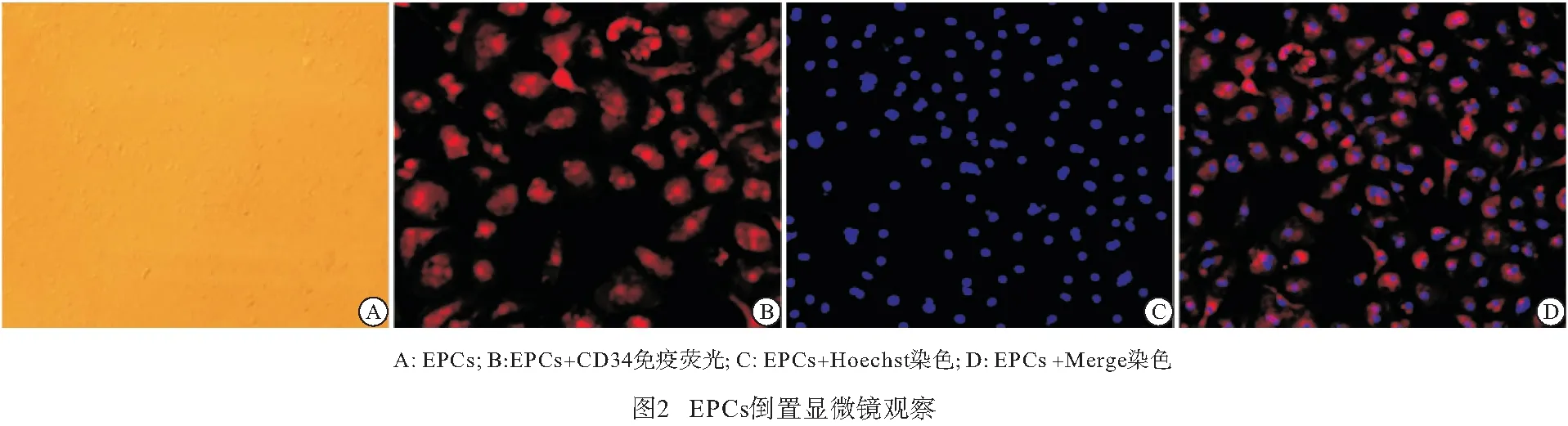
2.1 EPCs分离、培养和鉴定 EPCs在EGM-2培养基中呈“克隆样”生长,3~5 d后细胞融合度超过80%。原代培养 7~10 d与第1代培养2~3 d的EPCs呈“铺路石”样生长,少部分呈梭形和多边形,细胞CD34免疫荧光鉴定中红色荧光为抗原阳性,阳性率>90%,Hoechst染色呈蓝色,Merge染色呈混合色(见图2)。
2.2 目的基因的获取及载体的构建 Agarose电泳结果显示成功获取了目的基因(见图3)。且携带目的基因的LV5/Periostin基因重组慢病毒载体构建成功。

2.3 EPCs的慢病毒侵染 结果显示,未经侵染的EPCs不表达绿色荧光蛋白(GFP),经重组慢病毒LV5/Periostin侵染的 EPCs,荧光倒置显微镜下可见亮绿色GFP表达(见图4)。

2.5 感染株目的蛋白的表达 Western blotting检测显示,与阴性对照组EPCs相比,过表达慢病毒组Periostin蛋白表达显著增高(P<0.05)(见表1、图5)。

2.6 细胞增殖、迁移、侵袭及凋亡实验 实验结果显示,过表达慢病毒组细胞在培养120 h后细胞增殖活性显著低于阴性对照组(P<0.05),而阴性对照组与空白对照组间差异无统计学意义(P>0.05)。在同一重复实验中过表达慢病毒组细胞迁移率、侵袭细胞数及凋亡细胞数均显著大于阴性对照组(P<0.05),且阴性对照组细胞迁移率、侵袭细胞数显著及凋亡细胞数均大于空白对照组(P<0.05)(见表2、图6~8)。

表1 3组EPCs表达 Periostin目的蛋白的Western blotting灰度分析

表2 Periostin目的蛋白过表达对EPCs增殖影响的CCK-8检测分析

3 讨论
成熟的血管内皮细胞(endothelial cells,ECs)的增殖、迁移和重塑是血管发生和生成的基础,当血管发生损伤后,功能性ECs增殖是血管损伤后重建的关键[10]。EPCs是成熟ECs的前体细胞,其增殖、分化能力旺盛,可趋化到血管新生部位并分化为成熟的ECs[3-4]。骨髓和其他一些器官的EPCs通过向远处血管损伤处迁移,并分化成熟,取代衰老和损伤的内皮细胞。这一发现为临床治疗血管损伤、动脉粥样硬化等各种缺血性疾病指明了新的方向。
Periostin蛋白又称骨膜细胞相关蛋白,是一种细胞外基质N-糖蛋白[5],该种蛋白参与细胞增殖、肿瘤的发生发展和炎症反应等过程。其中,在肿瘤组织中,Periostin蛋白的高表达,通过MAPK、Akt等通路使上皮细胞发生表型改变[11-12],从而使得内皮细胞发生迁移活性的改变,而沉默该蛋白表达基因则显著影响细胞迁移的潜力。许多试验[13-14]研究提示,运用RNA重组转染或干扰技术,上调或是降低该蛋白基因的表达,可以显著影响肿瘤组织血管的发生。而Periostin蛋白在血管内皮前体细胞中亦表达。但有研究[15]指出,该蛋白在正常人体组织和生理过程中表达水平很低,且该种蛋白过表达体系对EPCs增殖、迁移和凋亡等生物学功能产生何种影响尚没有明确的实验结果。


在本研究中,我们成功地从小鼠骨髓获得大量的EPCs,并证实EPCs表达干细胞标志CD34。对于EPCs的培养和鉴定,尚没有形成统一的标准。在EPCs表型的鉴定上,没有发现该细胞表达特异且唯一的表面标记。被最早发现的EPCs表面标记是CD34,证明了EPCs是造血干细胞来源。但是随着细胞向成熟的分化,CD34表达水平逐渐下降,而CD133表达则有着一个先上升后下降的趋势。同时,ECs表面抗原CD31、vWF和Flk-1等表达升高[16]。
我们还发现,单纯上调Periostin蛋白基因表达对细胞增殖无明显影响,甚至促进细胞的凋亡,这与我们预期的实验结果有一定不符。但是从细胞迁移、侵袭功能方面看,实验结果可以明确提示,Periostin蛋白基因的过表达,能够显著提高细胞迁移和侵袭的能力,这一实验结果也可为后期的EPCs体内治疗提供了可能。

