超高效液相色谱法测定紫锥菊根末中单咖啡酰酒石酸和菊苣酸的含量
魏秀丽,张志民,张传津*,李有志,李美娣
(1.山东省兽药质量检验所,济南250022;2.山东省畜产品质量安全监测与风险评估重点实验室,济南250022;3.广州华农大实验兽药有限公司,广州510642)
紫锥菊(Echinacea purpurea)是原产美洲的一类菊科植物,因其具有显著的免疫刺激功效,是目前国际上普遍关注的一种免疫促进剂和免疫调节剂。紫锥菊根末为国家二类新中兽药,是由紫锥菊的根,经拣选洗净干燥粉碎过筛制备的粉末,药理研究表明,其活性物质主要包括咖啡酸衍生物、多糖、烷基酰胺类成分,根据新兽药相关技术要求对其进行了药学、药理毒理和临床研究[1-3],证明其安全、有效,在提高猪、鸡免疫功能方面具有显著的临床效果[4-6],并对肉质和口感具有一定的改善作用。紫锥菊根末中活性成分主要包括单咖啡酰酒石酸、菊苣酸,还有少量的绿原酸和咖啡酸,在猪、鸡临床上经饲料拌匀的方式给药,安全有效。美国、英国、欧洲药典和农业农村部2171号公告关于紫锥菊根末含量测定均采用普通高效液相色谱方法[1,7-11],检测时间长。本实验进行了超高效液相色谱-紫外检测法测定紫锥菊根末中单咖啡酰酒石酸和菊苣酸含量的方法学研究。
1 材料与方法
1.1 药品及试剂 菊苣酸对照品,批号11152-201703,含量97.6%,中国食品药品检定研究院。单咖啡酰酒石酸对照品,批号 18101022,含量98%,上海同田生物技术有限公司。乙腈、磷酸均为色谱纯;乙醇分析纯;超纯水。紫锥菊根末,产地来自广东、云南、河北,分别作为样品1、样品2、样品3,除去药材中残留的泥沙、叶子、茎等,水洗至无杂物,40℃以下干燥至含水量低于6%,粉碎过5号筛,置V型混合机中混合10 min,分装。
1.2 仪器 分析天平:感量0.00001 g;Waters AcquityTMUltra performance LC超高效液相色谱仪;waters2695高效液相色谱仪。
1.3 方法
1.3.1 供试品溶液制备 取本品粉末(过5号筛)约0.25 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇25 mL,称定重量,加热回流15 min,取出,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
1.3.2 标准储备液的制备 精密称取单咖啡酰酒石酸对照品、菊苣酸对照品适量,精密称定,加70%乙醇分别制成每1 mL含单咖啡酰酒石酸400μg、菊苣酸100μg的溶液,即得。
1.3.3 标准工作液的制备 取4 mL菊苣酸储备液和0.5 mL单咖啡酰酒石酸储备液,加3.5 mL 70%乙醇,制成每1 mL含单咖啡酰酒石酸25μg、菊苣酸50μg的混合标准工作液。
依次倍比稀释得一系列标准曲线工作液:20μg/mL单咖啡酰酒石酸 40μg/mL菊苣酸、10μg/mL单咖啡酰酒石酸 20μg/mL菊苣酸、5μg/mL单咖啡酰酒石酸10μg/mL菊苣酸、2μg/mL单咖啡酰酒石酸4μg/mL菊苣酸、1μg/mL单咖啡酰酒石酸2μg/mL菊苣酸、0.5μg/mL单咖啡酰酒石酸1μg/mL菊苣酸。
1.3.4 色谱操作条件及参数 色谱柱:C18色谱柱(2.1 mm ×100 mm,1.7 μm);流动相 A:乙腈;流动相B:0.4%磷酸水溶液,进行梯度洗脱;流速:0.35 mL/min;进样量:1 μL;柱温:35 ℃,进样室温度10℃。二极管阵列检测器,检测波长为330 nm。液相色谱梯度洗脱程序见表1。

表1 梯度洗脱条件表Tab 1 Gradient elution condition
1.3.5 重复性试验和精密度试验 精密吸取单咖啡酰酒石酸对照品溶液和菊苣酸对照品溶液,制成每1 mL含单咖啡酰酒石酸10μg、菊苣酸20μg的混合对照品溶液,重复配置6份,进样,计算单咖啡酰酒石酸、菊苣酸峰面积RSD。精密吸取单咖啡酰酒石酸对照品溶液和菊苣酸对照品溶液,制成每1 mL含单咖啡酰酒石酸10μg、菊苣酸20μg的混合对照品溶液,重复进样6次,计算单咖啡酰酒石酸、菊苣酸峰面积RSD。
1.3.6 检测限和定量限的测定 对单咖啡酰酒石酸、菊苣酸的标准工作液,进行UPLC的分析,并逐级降低其浓度,以溶液检测时的信噪比(S/N)分别大于等于3和10作为药物的检测限和定量限。
1.3.7 不同色谱条件样品检测比较 使用高效液相色谱仪和超高效液相色谱仪在不同的色谱条件下运行,对同一样品中两主成分单咖啡酰酒石酸、菊苣酸的含量和出峰时间分别进行比较。
1.3.8 稳定性试验 进样室温度设置到10℃。取“1.3.5”项下10μg/mL单咖啡酰酒石酸20μg/mL菊苣酸溶液,在 10 ℃ 放置 3、6、12、24 h,各进样1μL,计算单咖啡酰酒石酸、菊苣酸各自的峰面积RSD。
2 结果与分析
2.1 色谱分离 在优化的色谱条件下,测得单咖啡酰酒石酸、菊苣酸色谱峰峰形良好,且均达到基线分离,在1.3.4项条件下,菊苣酸、单咖啡酰酒石酸对照品和紫锥菊根末样品待测液,色谱保留时间为2.02 min、6.92 min左右,分离度均满足要求。
2.2 线性 在选定色谱条件下,使用梯度洗脱方法,可以有效分离目的峰,单咖啡酰酒石酸在0.5~25μg/mL范围内的标准曲线:y=8.392668e2+8.83837e3,R2>0.999。 菊苣酸在1~50 μg/mL范围内的标准曲线:y=1.938706e3+1.281296e4,R2>0.999。校正曲线结果见图1和图2。理论塔板数:菊苣酸 83000~87000,单咖啡酰酒石酸51000~54000,分离度3.9~4.8,对称因子1.18~1.27,拖尾因子1.10~1.13。

图1 单咖啡酰酒石酸校正曲线Fig 1 Caftaric acid correction curve

图2 菊苣酸校正曲线Fig 2 Chicory acid correction curve
2.3 重复性试验和精密度试验 配制10μg/mL单咖啡酰酒石酸20μg/mL菊苣酸对照品溶液,重复配置6份,进样,计算单咖啡酰酒石酸、菊苣酸峰面积RSD为0.73%、0.66%,满足实验要求。
取10μg/mL单咖啡酰酒石酸20μg/mL菊苣酸对照品溶液,重复进样6次,计算落单咖啡酰酒石酸、菊苣酸峰面积RSD分别为0.33%、0.29%,满足实验要求。
2.4 检测限和定量限 0.5μg/mL单咖啡酰酒石酸1μg/mL菊苣酸对照品溶液S/N≥3为检出限,1μg/mL单咖啡酰酒石酸2μg/mL菊苣酸对照品溶液S/N≥10为定量限。
2.5 不同色谱条件样品检测结果比较 使用waters超高效液相色谱仪和高效液相色谱仪,对同一样品中两主成分单咖啡酰酒石酸、菊苣酸的含量分别进行了比较,结果见表2。
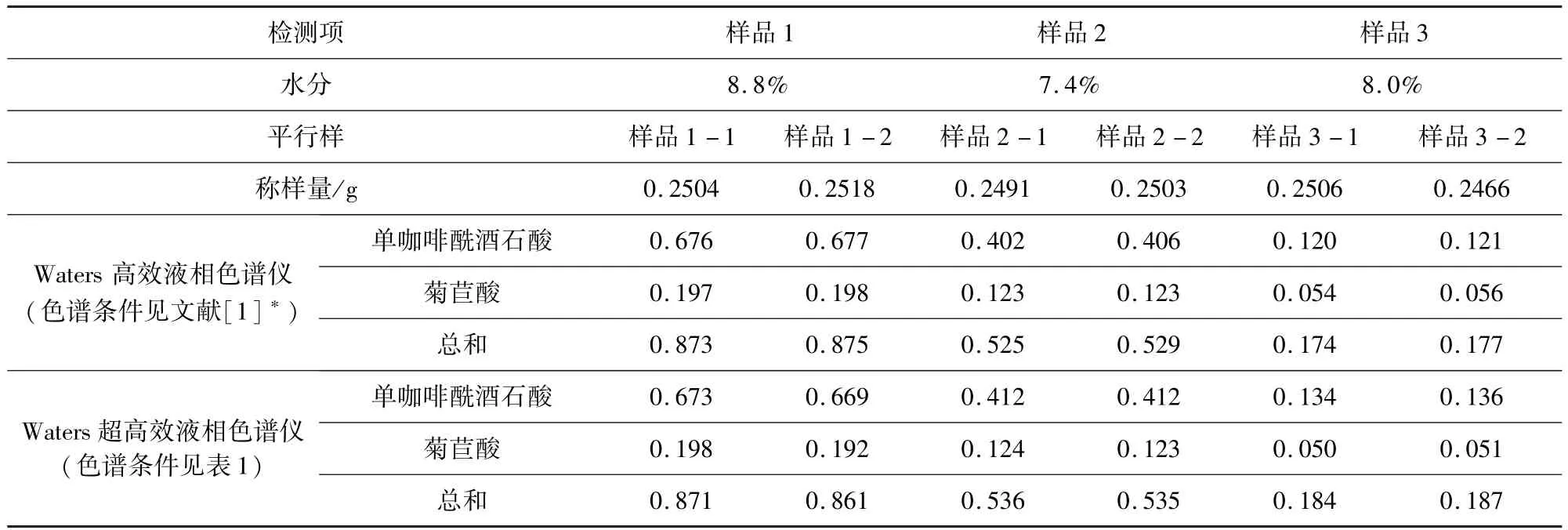
表2 不同色谱条件检测结果表(n=6)Tab 2 Test results using different chromatographic method (n=6)
由于两种色谱方法均已通过其方法学验证,均可以准确控制其指标成分。从检测效率上看,优选超高效法(UPLC)色谱图见图3-图10。从样品噪音和峰形分离度等方面来看,优选超高效液相色谱仪条件,背景更干净,与杂质峰的分离度更好。
2.6 稳定性试验 按照实验方法,将对照品溶液贮存一段时间后,进样,所得到的图谱中单咖啡酰酒石酸、菊苣酸峰面积RSD分别为0.47%、0.58%,说明样品稳定,满足实验要求。
3 讨论与小结
3.1 检测波长的选择 本研究将单咖啡酰酒石酸、菊苣酸的对照溶液利用PDA检测器采集其光谱图,在波长190~400 nm范围内进行扫描,发现单咖啡酰酒石酸在330 nm处有最大吸收,菊苣酸在331 nm处有最大吸收,参考农业部公告2171号紫锥菊根含量测定项中选用的波长330 nm,在本实验中选择330 nm作为紫锥菊根末的检测波长。光谱图见图11-图13。
3.2 流动相流速的比较 超高效液相流动相的流速为0.35 mL/min,需要运行12 min,每针运行需要4.2 mL流动相;普通高效液相色谱仪器流速为1.5 mL/min,运行时间35 min,每针运行需要52.5 mL流动相。超高效液相色谱更节约实验耗材溶剂等,每运行一针流动相节省38.3 mL。在废液处理高成本的今天,超高效液相色谱方法更有优势,更经济和快捷。

图3 10μg/mL单咖啡酰酒石酸20μg/mL菊苣酸对照品UPLC色谱图Fig 3 Chromatogram of reference solution of 10 μg/mL caftaric acid and 20μg/mLchicoric acid

图4 1μg/mL单咖啡酰酒石酸2μg/mL菊苣酸对照品UPLC色谱图Fig 4 UPLC chromatogram of reference solution of 1 μg/mL caftaric acid and 2 μg/mLchicoric acid
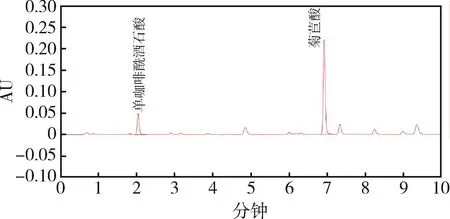
图5 样品1 UPLC色谱图Fig 5 UPLC chromatogram of sample 1
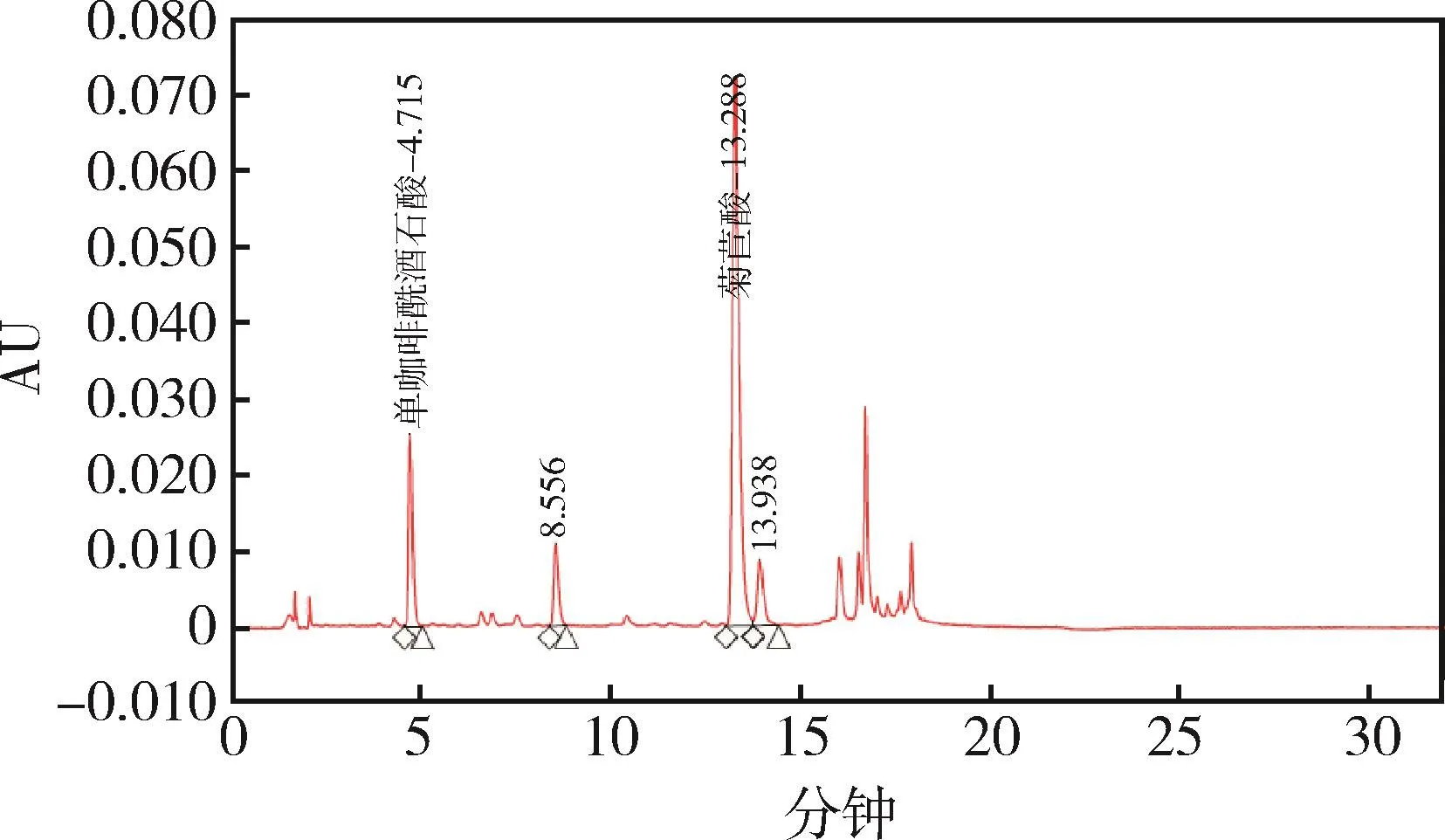
图6 样品1 HPLC色谱图Fig 6 HPLC chromatogram of sample 1
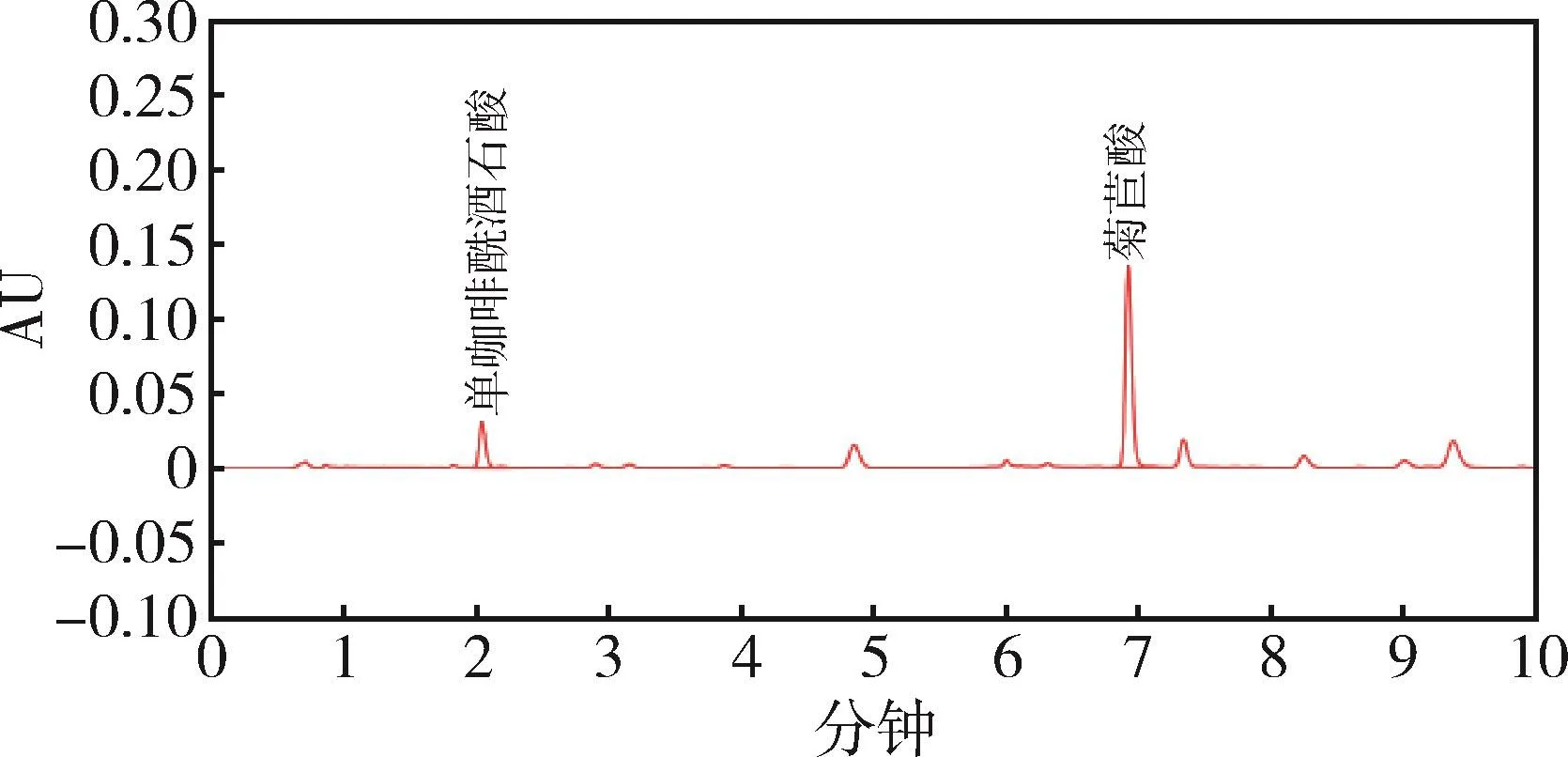
图7 样品2 UPLC色谱图Fig 7 UPLC chromatogram of sample 2

图8 样品2 HPLC色谱图Fig 8 HPLC chromatogram of sample 2

图9 样品3 UPLC色谱图Fig 9 UPLC chromatogram of sample 3
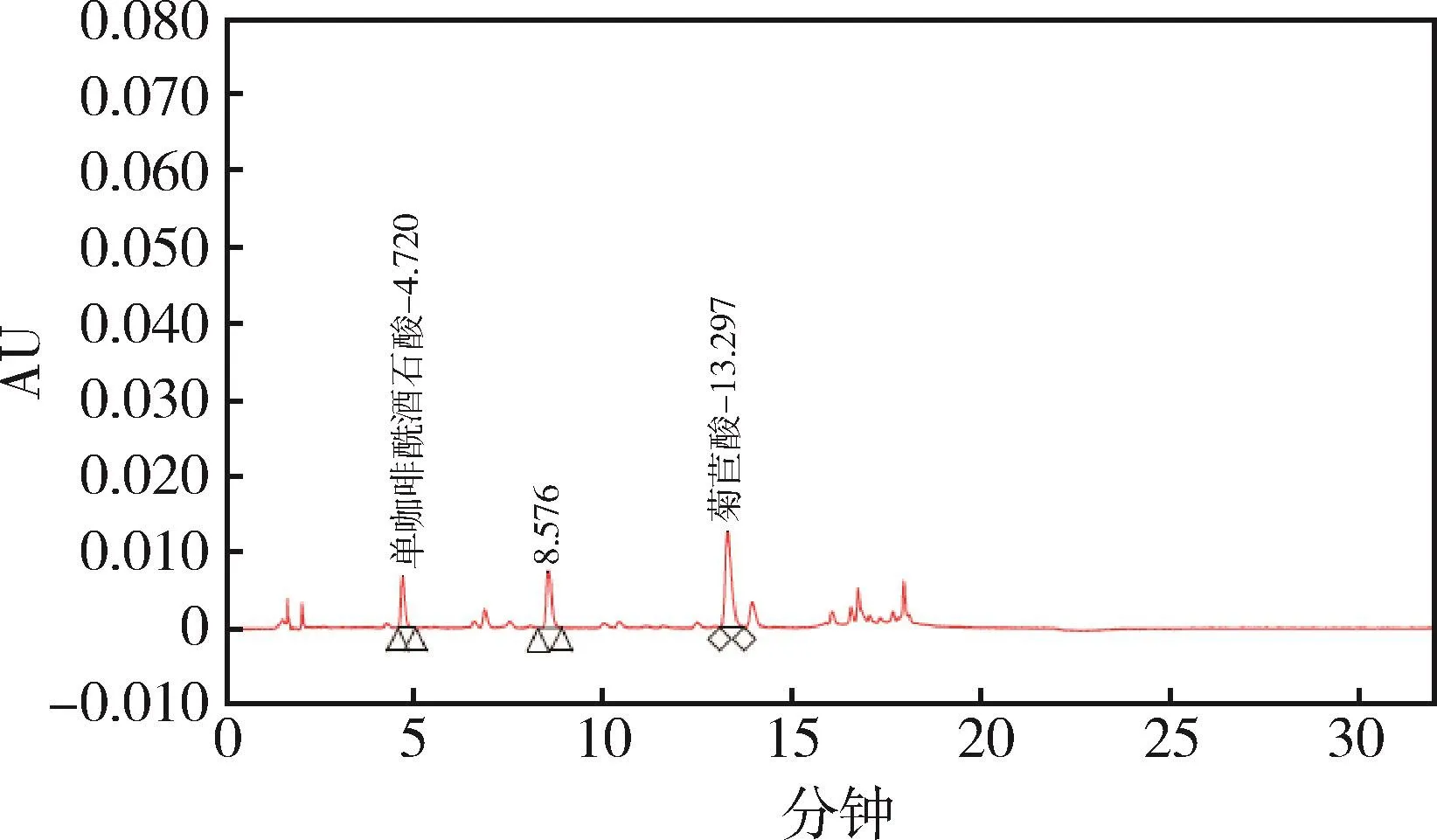
图10 样品3 HPLC色谱图Fig 10 HPLC chromatogram of sample 3
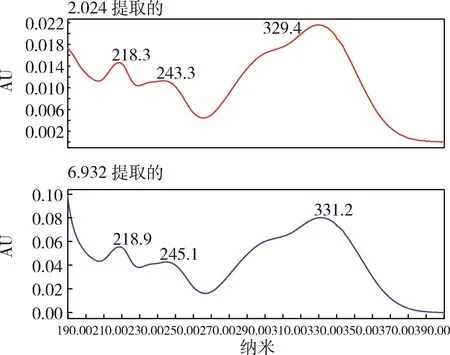
图11 单咖啡酰酒石酸菊苣酸混合对照品光谱图Fig 11 Chromatogram of caftaric acid and chicoric acid mixture

图12 样品1光谱图Fig 12 Chromatogram of sample 1

图13 样品2光谱图Fig 13 Chromatogram of sample 2
3.3 原药材主成分含量参差不齐 本实验选择了三个产地的紫锥菊根末进行含量测定,紫锥菊根末总含量随原料产地变化,含量有一定波动,以及有效期内含量变化,不同时期不同部位的菊苣酸含量存在差异,各部位菊苣酸含量在盛花期达最大值,紫锥菊采收期影响菊苣酸含量;而且一年生紫锥菊10月上旬(即秋季)盛花期采收的药材对动物机体的免疫增强作用优于其它采收期的药材。并考虑大生产实际中药材产地、采收时间、加工炮制等因素的影响,含量结果相差很远[12-14],药效也存在很大有差异。根据批准的新兽药紫锥菊根末标准,本品按干燥品计算,含单咖啡酰酒石酸和菊苣酸的总量不得少于0.50%,河北产地的药材含主成分0.186%,不合格不能投入生产和使用,广东和云南药材含量均合格。所以,制定快速的筛选方法还是非常必要的。
综上所述,使用超高效液相色谱法,对紫锥菊根末中单咖啡酰酒石酸和菊苣酸进行定性和定量测定,方法快速,可以作为企业内控标准方法,在原药材供应商的试验过程中,具备精准快捷、经济环保的特点,有效控制紫锥菊根末的质量。

