盆腔胃肠道间质瘤的MRI 特征
陆媛媛 黄群英 朱家樑 付 玏 张 军 龚华荣
胃肠间质瘤( gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶源性肿瘤,但发生于盆腔比较少见,且容易与来源于子宫和附件的肿瘤相混淆,造成误诊。本文回顾性分析我院经手术病理证实的12例间质瘤的MR表现,并参考相关文献进行鉴别,旨在提高对此病的认识。
方 法
1.临床资料
回顾分析2013 年1 月至2017 年12 月在我院行盆腔MRI 检查、并在2 周内进行手术切除、经病理证实的12 例GIST 病例。患者均为女性,年龄28 ~67 岁,平均年龄50.3 岁。临床表现为下腹痛9例,其中伴恶心呕吐1 例,体重减轻1 例;另3 例为体检发现。
2.MR 检查方法
采用GE Optima MR 360 1.5T磁共振扫描仪,8 通道体线圈。常规依次行:横轴位T1WI、T2WI、DWI 扫描,矢状位FSE T2WI 及增强扫描。DWI 采用单次激发自旋回波-平面回波成像(echo planar imaging,EPI ) 序 列, 扫 描 参 数:TE 78ms,TR 4100ms,层厚8mm,层间距6mm,视野36cm 36cm,b=800s/mm2。对比剂使用钆喷酸葡胺(Gd—DTPA),用量0.1mmol/kg。三维容积超快速成像(LAVA)三期矢状位扫描,先行蒙片扫描,增强扫描从注射对比剂15s 开始,每个序列20s,间隔3 ~5s后连续扫描三个序列,然后再采集延迟期横轴位或冠状位图像。
3.图像分析
所有患者的MRI 资料均在GE 后处理工作站AW 4.6 上由两名有5 年以上MRI 经验的诊断医师进行分析。形态学评估包括病变的大小、形态及边界情况,分析平扫T1WI、T2WI、DWI 的信号强度(以盆壁肌层信号为基准)特点,测量每个肿瘤实性部分平均ADC 值(结合T2WI 图像,分别放置三个类圆形ROI 在肿瘤实性部分的DWI 图像上,避开肿瘤内出血和囊性部分,在ADC图上自动生成三个ADC值,计算平均结果为肿瘤的平均ADC 值)。分析增强后肿瘤强化的程度及曲线特点。观察双侧卵巢静脉及肿瘤引流静脉显示情况。
4.病理诊断
常规测量肿瘤大小,进行HE 染色并在高倍镜下进行核分裂计数,免疫组化染色。病理诊断标准参考2008 年美国国立卫生研究院修订的方案,根据肿瘤的大小、核分裂象数、原发部位及是否破裂分为:高危、中危、低危及极低危4 级[1]。
结 果
1.MRI 影像学表现
12 例GIST 肿瘤均为单发,肿瘤最大直径为5.5 ~27cm,平均值为10.25±7.15cm。MRI 显示肿瘤的最大径、形状、边界情况、构成特征、平均ADC 值及病理结果见表1。除1 例来源于胃的巨大肿块占据腹盆腔外(图1),其余肿瘤均限于盆腔来源于小肠。高危组肿块多表现为分叶状、边界模糊,病灶信号不均匀内见囊变、出血,实性部分ADC 值低于中危组。肿瘤实性成分平扫T1WI 为等低信号、T2WI 为偏高信号、DWI 呈高信号。囊实性及囊性肿块均表现为外周实性成分,囊性部分位于中央或偏心性,呈T1 低信号,T2 高信号,DWI 低信号,如平扫T1WI 上呈高及混杂等高信号,则提示出血。增强后实性部分均明显强化,动脉早期强化后呈持续强化(图2)。9 例患者的双侧卵巢静脉显示,均未见明显增粗。肿瘤表面见明显增粗血管影4 例,均为肠系膜血管(图3)。扫描范围内均未见明显肿大淋巴结。

图1 女,63 岁,绝经10 年,左腹部肿块进行性增大伴消瘦半年,胃间质瘤(高危型)。A.T1WI 横轴位显示肿块外周实性部分呈等信号,中央囊性部分呈偏高信号,表明伴出血;B.压脂T2WI 横轴位显示肿块外周实性部分呈偏高信号,中央囊性部分呈高信号;C.DWI 横轴位显示肿块外周实性部分呈明显高信号;D.矢状位增强显示盆腹腔内巨大肿块位于空虚的胃(箭头)后方,肿瘤实性部分明显强化。U:子宫。
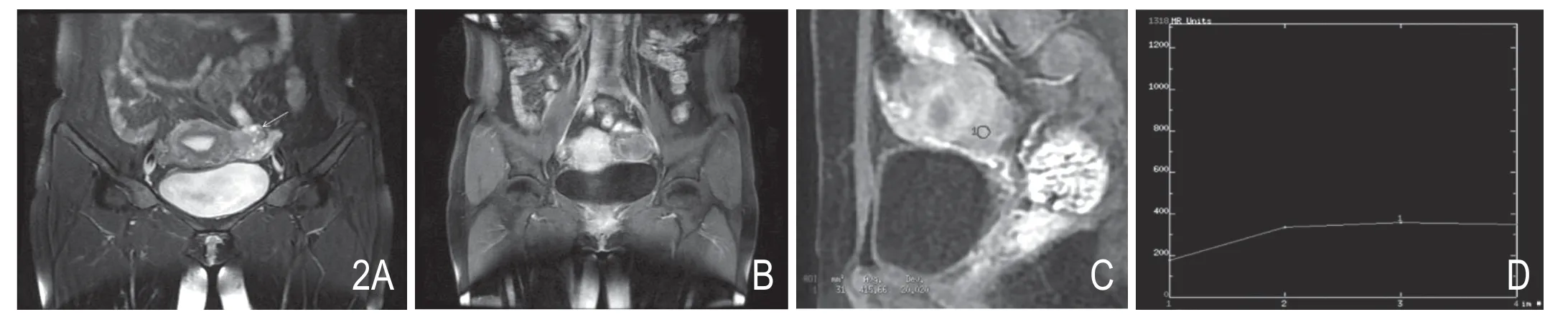
图2 女,42岁,发现盆腔包块伴下腹痛半年余,小肠间质瘤(高危型)。A.压脂T2WI冠状位显示左附件区肿块呈偏高信号,与上方左卵巢(箭头)分界清;B.冠状位增强显示双侧卵巢静脉无明显增粗;C.矢状位增强后在肿块实性部分取ROI。D.增强曲线显示肿块动脉早期明显强化,后持续强化。
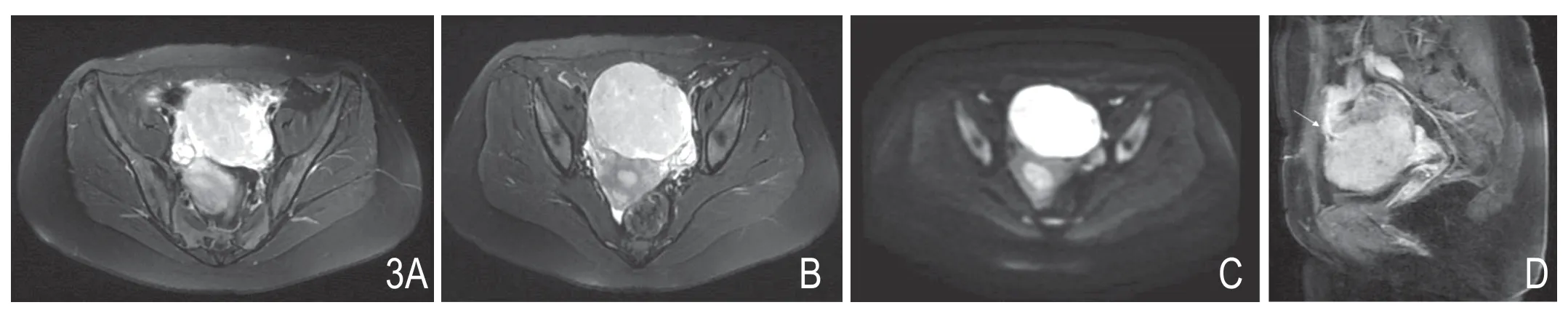
图3 女,25 岁,发现盆腔实质性包块1 年余,小肠间质瘤(高危型)。A.压脂T2WI 横轴位显示子宫前方类圆形实性肿块呈偏高信号,并显示右卵巢;B.下一层图像显示肿块及左侧卵巢;C.DWI 横轴位显示肿块呈明显高信号。D.矢状位增强显示肿块前上方粗大肠系膜引流静脉(箭头)。

表1 GIST 的MRI 表现和病理结果
2.病理结果
肿瘤来源于胃1 例,病理为高危;其余均来源于小肠,其中高危7 例,中危4 例。本组病理中没有低危及极低危病例。12 例肿瘤均CD117 表达阳性,8例CD34 表达阳性。
讨 论
GIST 在1998 年首先被发现是c-kit基因突变引起,在此之前大部分病灶都被归为平滑肌肿瘤或神经源性肿瘤。起源于胃肠道间质Cajal 细胞,为位于固有肌层内的纵行肌和环行肌之间肌间神经丛的起搏细胞[2]。好发于中老年人,但本组患者中有2 名患者年龄小于30 岁,其中1 人有家族史。家族性GIST 是由于c-kit基因或血小板源性生长因子受体(plateletderived growth factor receptor alpha, PDGFRA)基因胚系突变引起,为常染色体显性遗传[3]。GIST 还与其他家族性疾病有关,约7%的神经纤维瘤病I 型患者有此肿瘤[4]。GIST 特征性的表达CD117 和(或)CD34,CD117 是编码酪氨酸激酶受体的c-kit基因的产物,可以被特异性免疫组化标记,以此和其他间质肿瘤鉴别。
GIST 可发生在胃肠道的任何部位,最常见的部位是胃(60%),接下来是小肠(30%)、十二指肠(4 ~5%)、直肠(4%)、结肠和食管,也偶尔发生在网膜、肠系膜或腹膜后。常见的转移部位是肝和腹膜,其他少见部位有肺、胸膜、骨和软组织,一般不伴淋巴结肿大[5]。由于实际上所有的GIST(特别是直径>1cm)都有恶性潜能,无法明确分界恶性和良性[6],因此病理上参考美国国立卫生研究院关于GIST 侵袭行为危险分级诊断标准。判断肿瘤恶性程度的两个最重要的参数是肿瘤大小和在高倍镜下的有丝分裂数[7]。肿瘤直径越大,有丝分裂率越高,表示恶性程度越高。和本研究中高危组肿块明显较大及ADC 值偏低相符合,与之前的研究发现ADC 值与胃肠道间质瘤恶性程度呈负线性相关一致[6,8]。
本研究还发现由于高危组肿块生长速度不均匀,分叶状形态更多见。肿瘤边缘模糊说明病灶突破包膜侵犯周围组织结构,也是恶性程度较高和预后不良的表现[9]。如果肿瘤内部坏死、溃疡与胃肠腔相通,空气进入肿瘤内部,出现气液面,称为Torri-celli-Bernoulli 征,提示肿瘤恶性度高,认为是诊断GIST的可靠征象[10],但显示率低,本组中未见到。GIST还会引起其他并发症,如消化道出血、肠梗阻、肠套叠、肠扭转等,临床体征及影像学表现更为复杂。
对于GIST 实性部分强化程度的研究多为CT 影像分析,MRI 研究较少,意见不一。Zhou 等[6]认为GIST 的强化程度与肿瘤的危险度相关,也有报道不同危险度的GIST 强化程度之间无统计学差异[8-9]。Yu 等的研究表明小于5cm 的GIST 增强后为明显的持续强化,而大于5cm 的肿瘤强化稍低,为不均匀的渐进性强化[8],但以上报道均未对增强曲线进行分析。而本研究将ROI 精确定位于肿瘤的实性部分,发现中高危险度的病灶均呈明显持续强化,说明肿瘤的强化曲线对肿瘤恶性程度的判定没有指导意义。
鉴 别 诊 断
子宫肌瘤是子宫平滑肌瘤的简称,好发于育龄期妇女。根据病灶与子宫壁各层的关系分为肌壁间、黏膜下和浆膜下。与GIST 不易鉴别的是浆膜下子宫肌瘤和阔韧带肌瘤,子宫浆膜下肌瘤由子宫向浆膜发展,突出于子宫表面;如突入阔韧带两层之间生长为阔韧带肌瘤。肌瘤与子宫关系密切,有时可见两者之间有蒂相连。增强后见肿块与正常子宫肌层强化相仿。平滑肌瘤由于纤维成分较多,一般在T2WI 上呈低信号,与GIST 呈偏高信号不同。
卵巢恶性肿瘤常为囊实性肿块,内信号不均匀,与周围组织分界不清伴浸润,多伴有盆腔淋巴结肿大转移,肿瘤同侧卵巢不显示;而GIST 肿块和同侧的卵巢可以同时显示,且出现淋巴结转移非常罕见,可以与其鉴别。对于女性盆腔肿块,寻找引流静脉对鉴别消化道来源的GIST 和妇科来源的肿瘤特别有帮助,卵巢肿瘤引流入卵巢静脉,小肠GIST 引流入肠系膜静脉。GIST 常伴有扩张的供血动脉和引流静脉,提示肿瘤血供丰富,但没有血管侵犯或静脉血栓形成。本组病例中4 例病灶结合多平面图像及MIP 重建,见表面粗大肠系膜血管,才得以明显肿瘤来源。
输卵管癌平均发病年龄为60 岁,临床表现隐匿,晚期有阴道排液和腹痛。典型MRI 表现为腊肠形扩张的输卵管腔内见软组织肿块,DWI 呈高信号,增强后轻微强化。肿瘤分泌的浆液使输卵管扩张,甚至引起宫腔积液和腹水[11]。而GIST 表现为类圆形或分叶状肿块,增强后实性部分可见明显强化,不伴输卵管积液,可与其鉴别。
总之,中老年妇女伴有胃肠道临床症状,发现盆腔肿块实性成分DWI 呈高信号,增强后明显持续强化,不伴周围淋巴结肿大和卵巢静脉增粗,特别是可见粗大肠系膜静脉引流时,要考虑到GIST 的诊断,减少误诊。

