水合氯醛和右美托咪定对新生大鼠海马神经细胞凋亡的影响
王春艳 许学兵 姜涛 于洋 金丹 童庭辉
水合氯醛(chloral hydrate,CHL)是国内小儿手术室外镇静常用药物,作用类似巴比妥类,作用于神经突触,产生镇静催眠抗焦虑作用,但没有文献关注其对神经细胞生长的影响。右美托咪定(dexmedetomidine,DEX)是高选择性α2受体激动剂,也具有镇静抗焦虑、抑制交感神经活动的效应,动物实验发现DEX减轻全身麻醉引起的神经细胞凋亡[1-2]。笔者观察两种药物对体外培养的神经细胞凋亡的作用,评估水合氯醛和右美托咪定对发育阶段的神经细胞功能的影响,以期为临床小儿镇静药物合理选择提供实验基础。
资料与方法
一、材料
Olympus IX70倒置显微镜(日本Olympus公司)。右美托咪定(江苏恩华制药),水合氯醛(广州南方医院制),凋亡蛋白包括半胱氨酸天冬氨酸蛋白酶3(Caspase-3)和激活型Caspase-3(cleaved Caspase-3)兔抗鼠单克隆抗体和羊抗兔二抗(美国Cell Signaling Technology公司),α-tubulin单克隆抗体(美国Santa Cruz公司)。
二、方法
(一)培养基加药
各组药液(等渗盐水稀释)以1:6的体积比例加入神经细胞培养液中,形成含药培养基2 mL。CHL组:0.4%水合氯醛加入后的终浓度3.5 mmol/L;DEX组:0.0001% 右美托咪定加入后的终浓度0.7 μmol/L;C+D组为水合氯醛和右美托咪定等量混合后加入,培养基中两药终浓度同前;NS组:向培养液中加入1份等渗盐水。
(二)实验动物与处理
孕大鼠由广东省实验动物中心提供[使许可证号SYXK(粤)2015-0106],并经本单位实验伦理委员会批准。新生SD幼鼠雌雄不拘,断头后迅速取脑;脑组织置预冷Hank's平衡盐溶液(Hank’s balanced salt solution,HBSS)中,在显微镜下迅速解剖出海马,冷HBSS中清洗并尽量去除海马上的血管膜和其他杂质;将海马分成小块以利消化,转移至盛有胰蛋白酶(Trypsin)的6孔板中,37℃消化30 min;待消化快完成时,在15 mL管中加入3 mL预热的Plating Medium,并准备另一干净15 mL管;消化到时间后,迅速将6孔板由培养箱拿出,倾斜,用枪头将组织转移至15 mL管预热的Plating Medium中,用1 mL枪头轻柔吹打3次,再用1 mL枪头套200 μL枪头轻柔吹打3次;静置2 min,然后将上悬液转移至另一干净50 mL管中;取20 μL细胞悬液计数板计数,按7×105/dish,用Plating Medium稀释至2 mL/dish种于35 mm dish中;2 h后,吸净Plating Medium,轻柔缓慢加入Culture Medium;2~3 d换1次Culture Medium,每次换半液。
原代培养7 d后,观察长势好,吸净原培养基,缓慢轻柔加入含药培养基2 mL,再放回恒温孵育箱进行24h 的培养,以使Caspase-3充分表达,然后将细胞吹下收集洗涤,BCA法测蛋白浓度。Western-Blot法检测Caspase-3和cleaved Caspase-3。实验重复3次。
(三)Western-Blot法检测Caspase-3和cleaved Caspase-3
取50 μg蛋白在10% SDS-PAGE凝胶上电泳,以5%脱脂奶粉封闭后,加入兔抗鼠Caspase-3和cleaved Caspase-3抗体1:10 000,4 ℃摇床孵育过夜;加入羊抗兔二抗1:10 000(in 5%脱脂奶粉),常温孵育2 h曝光成像。Caspase-3和cleaved Caspase-3用SuperSignalTMWEST Pico PLUS(Thermo scientific公司)压片18 min。cleaved Caspase-3吸光度值与内参蛋白α-tubulin吸光度值相比,其比值代表激活型Caspase-3蛋白的表达水平。
三、统计学分析
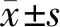
结 果
一、培养细胞显微观察
显微镜下观察各组海马神经细胞长势良好,胞体致密,突触清晰(图1a),加药后20 h,NS组较前继续生长(图1b),DEX组无明显变化(图1c),CHL组细胞胞体松散、空泡透明现象增多,突触减少(图1d),C+D组能看到空泡变化,但较CHL组少(图1e)。
二、Caspase-3和cleaved Caspase3检测结果
Caspase-3正常以酶原(32~35 KD)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17 KD)和两个小亚基(12 KD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。Western Blot 凝胶电泳,CHL组很稳定地检测到cleaved Caspase3条带增强,NS组和DEX组未检测到cleaved Caspase3条带增强,C+D组检测到的cleaved Caspase3较CHL组减轻,提示水合氯醛增加了海马神经细胞凋亡,而加了DEX后细胞凋亡现象减轻。Caspase3是细胞内天然成分,各组条带灰度大致相同。见图2。
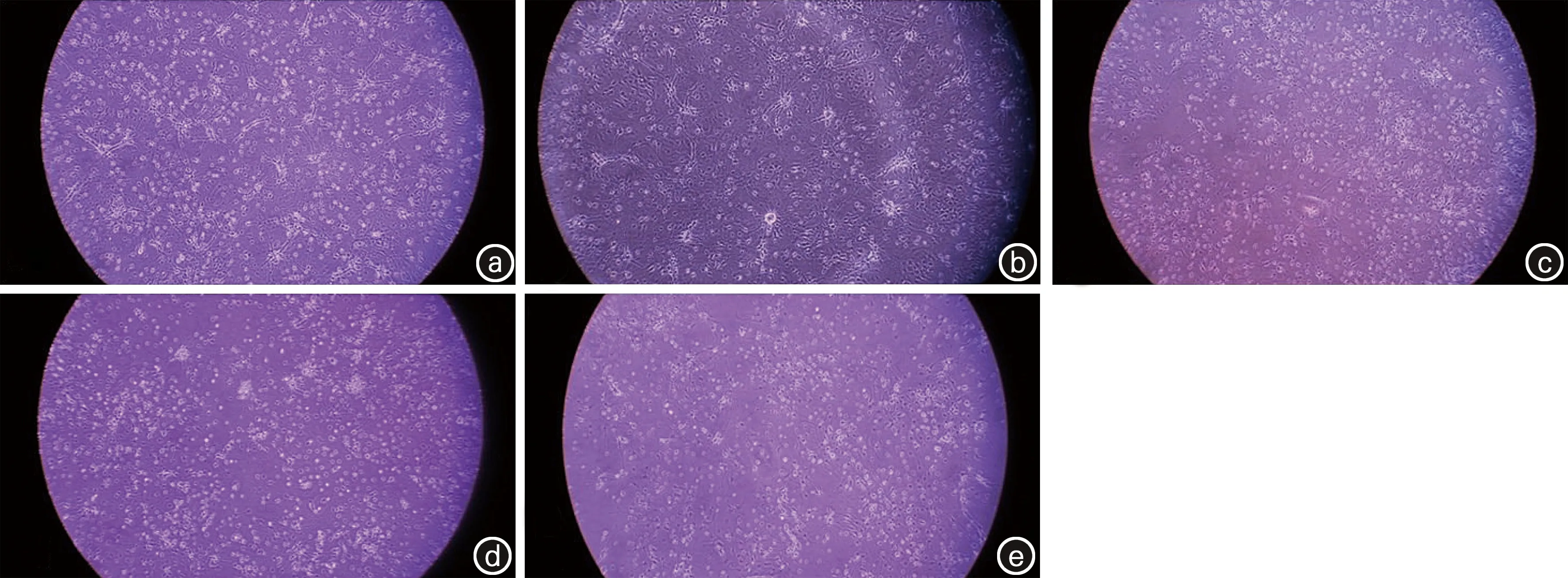
图1 各组原代细胞培养及加药后显微观察(100×)

图2 Western Blot检测原代培养神经细胞Caspase3/cleaved Caspase3表达情况
电泳条带灰度计算,各灰度值由image J软件分析得到。按灰度值计算(cleaved Caspase-3/α-tubulin),NS组、DEX组和C+D组分别为0.15±0.12、0.09±0.05、0.33±0.14,差异无统计学意义,CHL组为1.20±0.00,比对照组显著增加(P<0.01),C+D组0.73±0.14较CHL组降低(P<0.01)。
讨 论
众多动物实验研究证实,大部分全身麻醉药和中枢镇静药(如咪达唑仑)会诱发神经细胞凋亡。全身麻醉药物的神经元毒性与大脑的发育阶段、麻醉药物暴露的剂量、次数及时间等密切相关[3]。目前研究表明,大部分全身麻醉药是作用于N‐甲基天冬氨酸(N-methyl-Daspartate,NMDA)受体和/或兴奋γ-氨基丁酸A(γ-aminobutyric acid,GABAA)受体,后者引起氯离子内流增多,细胞膜超极化。离子通道异常开闭,阻断正常细胞功能,使细胞功能信号传递异常而产生麻醉效果,但同时也诱发了细胞凋亡。
临床上水合氯醛因对呼吸循环干扰轻而被认为是安全的,是小儿镇静术常用药物,但水合氯醛是乙醇的异构体,有研究表明乙醇兴奋神经细胞的NMDA受体后,使钙离子内流增多,导致内质网线粒体损伤,产生凋亡蛋白Caspase3活化[4]。水合氯醛的中枢性镇静作用被认为是由它的代谢产物三氯乙醇所致,其药理作用同是NMDA受体,诱发神经细胞凋亡的机制可能与乙醇等相同。本研究所用水合氯醛药液浓度,参考潘庆军等药理实验研究,模拟体内镇静试验剂量,在体外进行重现,结果证实能诱发发育中的海马神经细胞凋亡[5-6]。除了药理作用外,尚不能确定药物的理化性质在细胞凋亡过程中起了什么作用。文献报道,10%水合氯醛药液pH值是4.0~6.0[7]。在活体生物体中,吸收入血的水合氯醛被缓冲,可能对细胞稳定起到保护作用而不诱发凋亡。
本研究结果显示,培养的神经元细胞接触DEX后没有发生凋亡,培养液中混合了DEX的水合氯醛组凋亡现象也明显减轻,显示DEX对神经细胞的保护作用,这一结果令人兴奋,为临床上幼儿镇静药物选择提供了实验参考。
DEX是α2-肾上腺素能受体激动剂,其神经保护作用的具体机制尚不清楚,可以肯定的是,高选择性α2-肾上腺素能受体激动剂抑制蓝斑核团产生的镇静作用与前述全麻药和中枢镇静药作用于GABA受体或NMDA受体的机制途径不同。有研究发现右美在发挥镇静作用的同时,可改善吸入麻醉药引起的脑源性神经营养因子减少和酪氨酸激酶B抑制[1]。Li等[8]将出生后7 d的SD大鼠暴露于异氟醚6 h,发现DEX能够通过维持PI3K/Akt通路的活性,对异氟醚导致的大鼠海马神经元的凋亡起到保护作用。Zhang等[9]检测体外循环后老年大鼠海马神经元发现,右美托咪定能使β淀粉样蛋白(Aβ),微管相关蛋白P-Tau蛋白表达减少、突触后致密蛋白95(PSD95)蛋白表达增加,前两种蛋白被发现与神经功能萎缩、认知功能障碍有关,具有神经细胞毒性,后一种蛋白则能稳定细胞膜、促使神经递质正常回收释放、突触正常形成和功能传递,行为学研究证实加用右美的体外循环组大鼠认知功能明显改善。
总之,本实验结果提示,水合氯醛直接接触对发育中的神经细胞具有诱发凋亡的作用,而DEX则可减轻凋亡现象。其机制尚需进一步研究,药物的剂量和接触时间也应深入探索。

