胶质母细胞瘤干细胞成球培养与患者预后的相关性研究
宋振宇 马斯奇 罗文正 吴力新
郑州大学第一附属医院神经外科,河南 郑州 450052
胶质母细胞瘤的肿瘤干细胞理论认为在肿瘤细胞中存在一小群具有干细胞特性的细胞,具有真正形成胶质母细胞瘤的能力,被称为胶质瘤干细胞[1-3]。胶质瘤干细胞在体外培养条件下能够自我更新并形成肿瘤球,在体内能够形成肿瘤,临床上被认为是肿瘤难以根治的根本原因[4-6]。但胶质瘤干细胞分裂产生的后代仅用于肿瘤的生长,其成克隆能力明显降低。在此基础上,研究者对肿瘤干细胞模型假说进行了重新审视,提出了更加新颖的观点:肿瘤细胞可以被肿瘤所在微环境调节,使非干性的肿瘤细胞转化成为肿瘤干细胞[7-9]。尽管如此,肿瘤干细胞理论仍然为肿瘤的治疗抗性和复发性提供了理论基础,部分肿瘤中的干细胞也作为主要的治疗靶点对患者进行有效的治疗干预。
虽然对肿瘤干细胞的研究为人们充分理解胶质瘤的生物学特性提供了巨大的帮助,但到目前为止,这些研究结果对临床的转化应用却相当有限。研究发现,在干细胞培养条件下,胶质母细胞瘤细胞形成漂浮的肿瘤球的能力预示着患者较差的预后[8-9]。一些体内和体外实验证明胶质瘤干细胞对于现行的治疗手段具有很强的抗性,包括放疗和TMZ化疗[10]。但最近的研究指出,不论是在放疗后富集了肿瘤干细胞的胶质瘤样本[11],还是在患者原代肿瘤或复发的肿瘤样本中[12],胶质瘤细胞的干性与患者的预后关系远比想象中复杂。确定GSC对放疗和TMZ化疗的抗性与临床疗效之间的关系对于确定分析GSC作为胶质母细胞瘤(glioblastoma,GBM)治疗效果预测的适用性和临床相关性至关重要[13]。本文通过研究部分胶质瘤患者样本体外培养形成的肿瘤球、放疗及TMZ化疗抗性和患者生存率之间的关系,以确定肿瘤球的特性是否能够作为一种可靠的预测治疗效果的工具,为现行或将来的个性化治疗策略提供帮助。
1 资料与方法
1.1一般资料选取手术切除的新鲜胶质瘤样本41例,其中男23例,女18例,年龄23~68岁。样本去除血、坏死等部分,进行后续实验。
1.2方法(1)肿瘤细胞成球培养:肿瘤组织经过解离,消化成单细胞后,接种于无血清培养基中(DMEM/F12,加入终浓度为20 ng/mL的FGF和10 ng/mL的EGF),置于细胞培养箱中培养。隔天换液,每天观察肿瘤细胞的生长和成球情况。(2)肿瘤球的放疗和TMZ处理:肿瘤球以2.5×104个/mL的密度接种在合适的孔板中,放疗肿瘤球以0.8 Gy/min的剂量接受总剂量为1~60 Gy的梯度照射后,培养7 d进行细胞活性的测定;TMZ化疗的肿瘤球,将TMZ在3.9 μmol/L~1 mmol/L的浓度范围稀释成不同的浓度梯度后,处理肿瘤球细胞24 h后,进行细胞活性的测定。
2 结果
2.1肿瘤球的培养及与临床病理特征的关系对41例患者的胶质瘤样本进行体外培养,其中20例能够成功形成肿瘤球,成球时间2~21周。肿瘤细胞能够成球的胶质瘤患者与不能成球患者的年龄、性别、症状持续时间和病灶部位无明显区别,但能够成球的胶质瘤患者的中位生存期和PFS明显低于不能成球的患者(图1)。除整个样本队列,在排除复发性肿瘤或未完成治疗方案的复发性肿瘤病例后,肿瘤球的形成率与患者的生存率具有明显的比例关系。
2.2肿瘤球对于放疗的敏感性及预后关系对肿瘤球进行1~60 Gy剂量的放射处理,在该剂量范围内,能够反映出肿瘤球细胞的半数致死量(LD50)。整体来说,肿瘤球对于单一剂量的放射具有较强的抗性,25%的肿瘤球LD50>50 Gy,约等于患者分次放疗剂量的总和。肿瘤球对于放疗的敏感性与患者的总生存期无一定联系,当以放射剂量12 Gy为截断值时,LD50>该剂量的肿瘤球具有相对较低的PFS(图2)。
2.3肿瘤球对于TMZ的敏感性及预后关系采用3.9 μmol/L~1 mmol/L的TMZ处理肿瘤球,肿瘤球对于TMZ具有很强的抗性,20%的肿瘤球的TMZ IC50值>1 mmol/L。肿瘤球对于TMZ的敏感性与患者的生存期有直接的关系。将180 μmol/L设定为截断值,该浓度是患者化疗时血浆浓度的3倍。通过分析发现,IC50>180 μmol/L的肿瘤球来源患者具有较短的OS和PFS(图3)。
3 讨论
本研究证明了肿瘤球形成及其相关特性与胶质瘤患者预后之间的关系,实验发现肿瘤球的形成率与患者预后之间的具有直接的相关性,而与患者的年龄、性别、术后KPS以及术后放化疗的完成情况无直接关联[14-17]。
本文关注的问题是肿瘤细胞成球率及肿瘤球特性是否可以直接转化为预测治疗结果,但有两个问题限制了这种转化率。第一是技术方面的限制,本研究只能从1/2的胶质瘤样本中培养出肿瘤球,虽然一些特殊的培养条件能够提高成球率,如低氧环境或尽可能去除细胞碎片[18-20],但仍然有很多胶质瘤样本不能形成肿瘤球,提示通过分析肿瘤球的性质预测患者的生存期适用范围有限[21-26]。第二涉及到肿瘤球的临床相关性与肿瘤细胞异质性的问题[27-30]。胶质瘤是具有异质性的实体肿瘤。最近对胶质瘤进行单细胞的RNA测序显示每个肿瘤样本都具有极强的异质性[31-35]。胶质瘤极强的异质性促使研究者们提出了这样一个假说,不同的细胞群可能形成不同性质的肿瘤球,每一类都有自己的致癌途径。但有研究指出,在分离的胶质瘤样本中,肿瘤干细胞转录水平的多样性明显低于其来源的胶质瘤细胞的多样性[36-44],提示与肿瘤相关的信号通路的变化很可能发生在分化程度较高的肿瘤细胞中。本实验也发现来自同一个胶质瘤样本不同区域细胞形成的4例肿瘤球具有十分类似的放化疗抗性,进一步证明具有干细胞特性的肿瘤细胞具有相对均一性[45-51]。
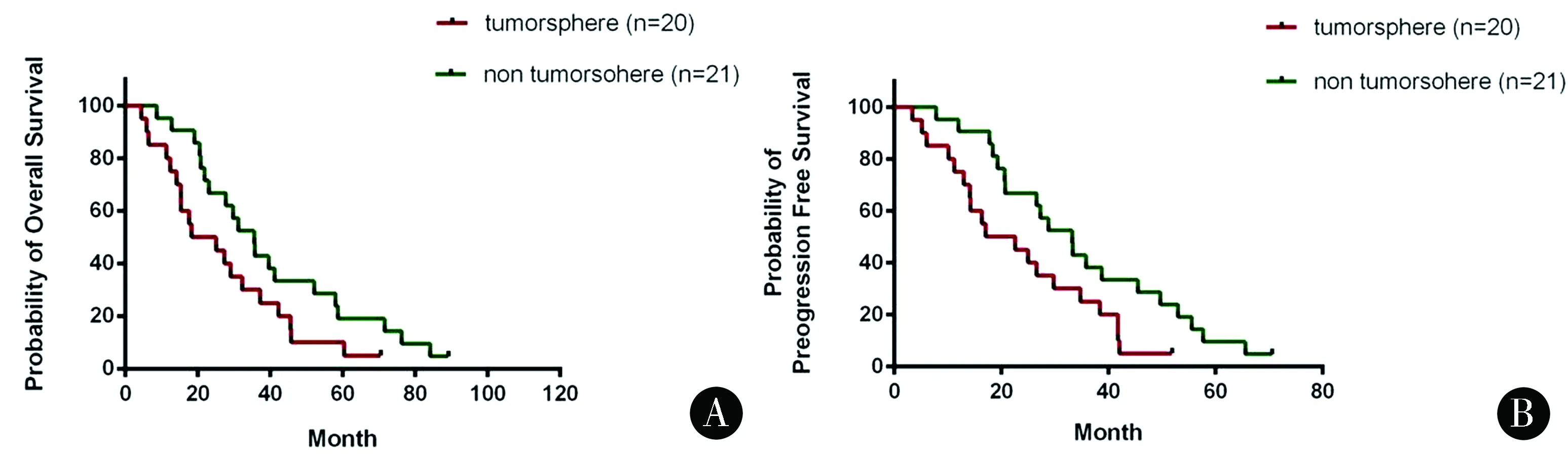
图1 胶质瘤细胞是否形成肿瘤球与患者生存期的关系 A:能够成球与不能成球组织来源患者的总生存期;B:能够成球与不能成球组织来源患者的无进展生存期Figure 1 The relationship between whether glioma cells form tumor globules and patient survival A:Total survival of patients who can and can't form globular tissue;B:Progressive survival of patients who can and can't form globular tissue
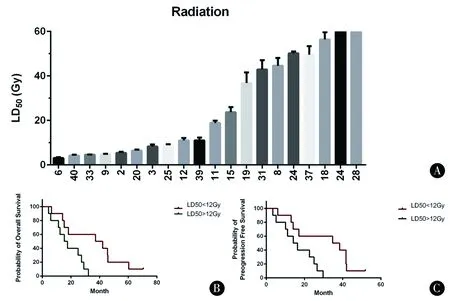
图2 胶质瘤肿瘤球对于放疗的敏感性及相应患者的生存期 A:不同患者来源的胶质瘤细胞形成的肿瘤球对于放疗剂量的LD50值;B:以LD50=12 Gy为截断值分析患者的总生存期差异;C:以LD50=12 Gy为截断值分析患者的无进展生存期差异Figure 2 Sensitivity of glioma spheres to radiotherapy and survival time of corresponding patients A:LD50 value of glioma spheres formed by glioma cells from different patients for radiation dose;B:LD50=12 Gy as truncation value to analyze the difference of total survival time of patients;C:LD50=12 Gy as truncation value to analyze the difference of progression-free survival time of patients
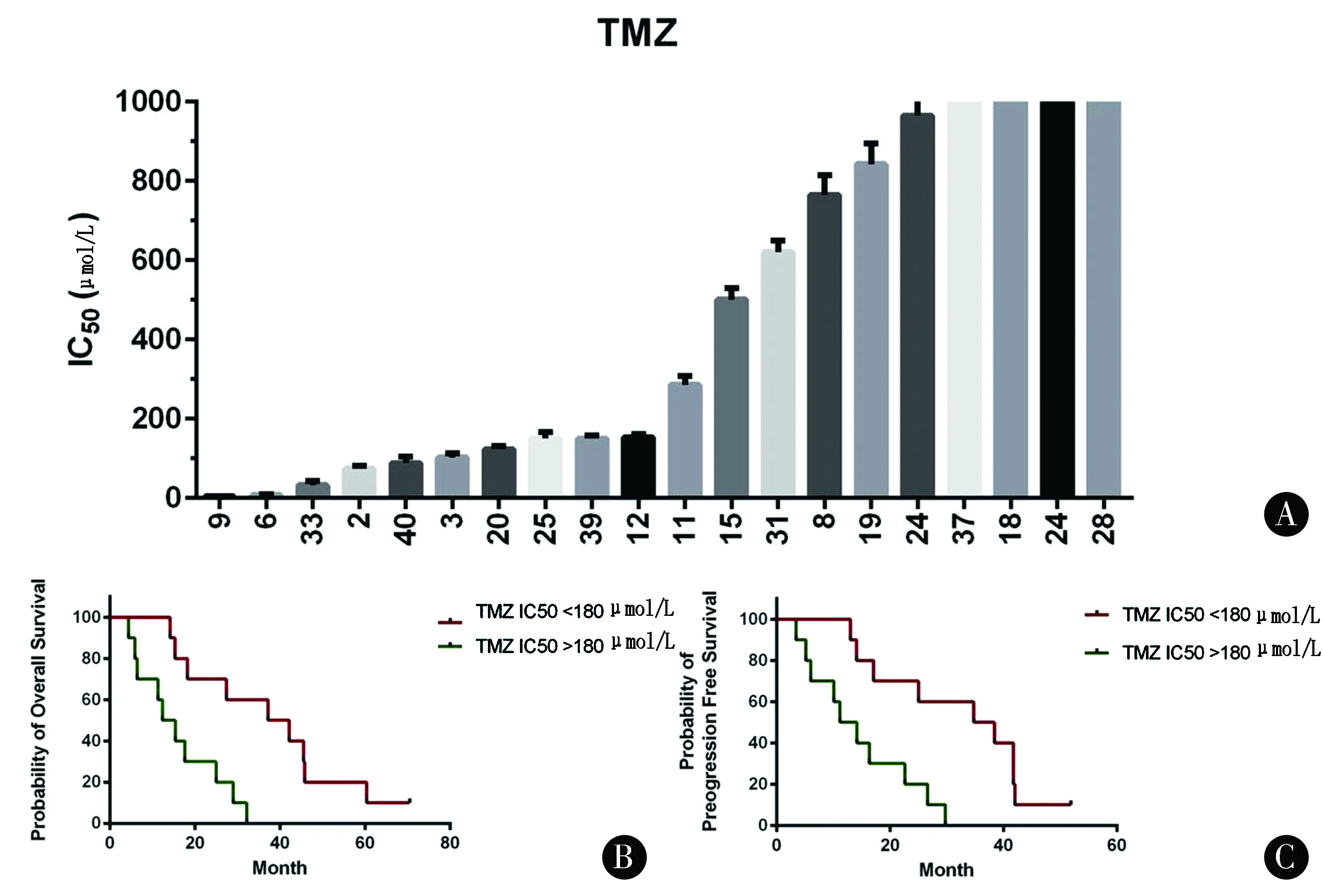
图3 胶质瘤肿瘤球对于TMZ的敏感性及相应患者的生存期 A:不同患者来源的胶质瘤细胞形成的肿瘤球对于TMZ剂量的IC50值;B:以IC50=180 μmol/L为截断值分析患者的总生存期差异;C:以LD50=180 μmol/L为截断值分析患者的无进展生存期差异Figure 3 Sensitivity of glioma tumour spheres to TMZ and survival time of corresponding patients A:IC50 value of TMZ dosage for glioma spheres formed by glioma cells from different patients;B:IC50=180 μmol/L as truncation value to analyze the difference of total survival time of patients;C:LD50=180 μmol/L as truncation value to analyze the difference of progression-free survival time of patients
本研究发现,当肿瘤球的放射LD50>12 Gy,TMZ处理剂量的IC50>180 μmol/L时,该肿瘤球来源的患者对于现行治疗方案效果较差。大部分肿瘤球对于放化疗有明显的抗性,这可能是由于早期DNA检查点被破环以及某些基因的的表达变化造成的[52-55]。此外,实验中观察到肿瘤球经过血清培养后对于TMZ的敏感性明显降低,一方面可能是因血清能够抑制肿瘤干细胞增殖而促进其分化,使其转化为终末分化的肿瘤细胞造成的;另一方面,也可能是由于血清中含有大量的黏附及促生存因子导致的[56-61]。
本研究通过分析肿瘤细胞的成球能和放化疗敏感性,以评估患者的肿瘤性质和生物学特性,为临床制定更为有效的治疗方案,选择更为有效的药物和合适的治疗周期提供帮助。

