miR-378a-5p下调人肝脏星形细胞系LX-2中鞘胺醇激酶1的表达
祁长波 常 娜 杨 琳 李丽英
(首都医科大学细胞生物学系‘肝脏保护与再生调节’北京市重点实验室,北京 100069)
在肝纤维化/肝硬化的过程中,肝脏肌成纤维细胞(hepatic myofibroblasts,hMFs)合成大量细胞外基质成分,致使其在肝脏中过量沉积,导致肝纤维化的发生[1]。有文献[2]报道,hMFs具异质性,而肝脏星形细胞(hepatic stellate cells, HSCs),是其重要来源之一,在肝纤维化的发生、发展过程中至关重要。肝损伤发生时,HSCs活化,转变成hMFs。活化的HSCs导致肝纤维化的发生,因此了解HSCs活化的分子机制对阐明肝纤维化发病机制乃至转归尤为关键。本研究中笔者采用人肝脏星形细胞系(LX-2细胞)来进行相关研究。
Li等[3-6]的前期研究结果已证实鞘胺醇激酶1(sphingosine kinase 1, SphK1)及其产物鞘胺醇-1-磷酸(sphingosine 1-phosphate, S1P)组成的SphK1/S1P系统,能够显著影响LX-2细胞的活化及肝纤维化的发病进程。有文献[7-8]报道,转化生长因子β1(transforming growth factor-β1,TGF-β1),在HSCs活化的过程中发挥重要作用。本课题组[9-11]的前期实验也证实,TGF-β1促进SphK1表达并以SphK1依赖的方式诱导细胞向hMFs活化。那么在HSCs活化的过程中,是否还有其他调控因子参与了TGF-β1调控SphK1表达的过程,目前尚不清楚。
转录后调控是近年来基因调控研究的热点,作为重要的转录后调控因子,microRNA(miRNA)对于许多病生理过程均有重要调控作用。文献[12-15]报道,miRNA可以通过调控不同靶基因的表达参与HSCs活化过程,并促进或抑制肝纤维化发病的进程。研究[16-19]显示,miR-125b、miR-101、miR-506以及miR-124可在多种肿瘤发生的过程中调控SphK1表达。同时,TGF-β1也可以通过miRNA调控下游基因的表达[20-21]。例如在肾纤维化中,TGF-β1上调了细胞内miR-21水平,且这一过程与SphK1/S1P系统密切相关[22]。那么miRNA是否参与了TGF-β1诱导的SphK1表达调控过程,进而影响HSCs活化呢?为了探究这一问题,本研究通过生物信息学数据库miRWalk (http://129.206.7.150/)和Targetscan (http://www.targetscan.org/vert_71/)预测可能靶向SphK1 mRNA的miRNAs,取交集后在小鼠肝脏组织中检测各miRNA的表达,筛选出miR-378a-5p作为研究对象,并在LX-2细胞中探究其是否能够调控SphK1 mRNA的表达。
1 材料与方法
1.1 试剂与仪器
DMEM培养基(Gibico公司,美国);胎牛血清(Excell公司,中国);青/链霉素、胰蛋白酶(Gibico公司,美国);TGF-β1(PeproTech公司,美国);M-MLV反转录试剂盒(Invitrogen公司,美国);TRIzol试剂及相分离管体系(TRIzol Reagent and Phasemaker Tubes Complete System)(Invitrogen公司,美国);RNA提取纯化试剂盒(Gene JET RNA Purification Kit)(Invitrogen公司,美国);microRNA模拟物及抑制剂(micrONTM miRNA mimic/micrOFFTM miRNA inhibitor)(广州市锐博生物科技有限公司,中国);miRNA实时荧光定量核酸扩增检测试剂盒(Bulge-LoopTM miRNA qRT-PCR Kit)(广州市锐博生物科技有限公司,中国);SYBR Green聚合酶链式反应混合试剂(SYBR Green PCR Master Mix)(ABI公司,美国);脂质体转染试剂(Lipofectamine RNAiMAX)(Invitrogen公司,美国)。
CO2细胞培养箱BB16(Heraeus公司,德国);实时荧光定量PCR仪ABPrism 7300(ABI公司,美国)。
1.2 动物模型
采用4周龄ICR小鼠进行造模,共12只小鼠,对照组、实验组每组各6只。查正态曲线下面积表得出把握度>0.90,符合实验设计要求。采用数字表法将小鼠随机分为对照组和造模组。模型组:橄榄油按照体积比1∶9稀释四氧化碳(carbon tetrachloride, CCl4),腹腔注射(10 mL/kg),每周注射2次。对照组:腹腔注射相应体积的橄榄油(olive oil, OO)。处死小鼠当天注射最后1次。饲养4周完成模型制作,后处死小鼠获取肝脏样本,处死前禁食6 h,常规饮水。
1.3 细胞培养
LX-2细胞采用含10%(体积分数)胎牛血清、1%(质量分数)青/链霉素的DMEM培养基,置于37 ℃、5%(体积分数)CO2细胞培养箱中进行培养。接种密度为1×106/大皿(r=10 cm)或7×105/中皿(r=6 cm)。当细胞汇合度达到90%时进行传代,取处于对数生长期的细胞进行实验。
1.4 MicroRNA模拟物及抑制剂的转染
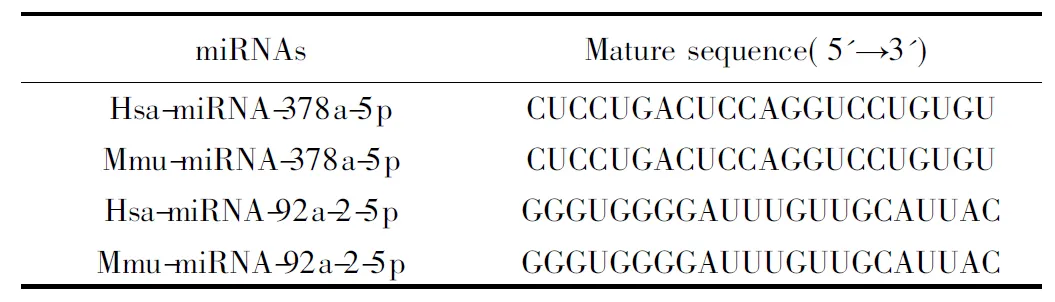
转染前1 d接种4×105个细胞于6 cm细胞培养皿,当细胞汇合度到达50%~60%时进行转染;转染步骤参照脂质体转染试剂(Lipofectamine RNAiMAX)说明书。MicroRNA模拟物转染终浓度为50 nmol/L,microRNA抑制剂转染终浓度为100 nmol/L。6~8 h后换为完全培养基。成熟miRNAs的序列见表1。
1.5 细胞总RNA提取
弃旧培养基,每中皿加500 μL TRIzol 试剂,混匀收集细胞样品至分离管,静止5 min;加0.2 mL氯仿,用力摇晃15 s,25 ℃静置2~3 min;4 ℃ 12 000 g离心15 min,将最上层水相转移至新的EP管;加0.5 mL的100%(体积分数)异丙醇,倒置轻轻混匀,25 ℃静置10 min;4 ℃ 12 000 g离心10 min,弃上清;加 1 mL的75%(体积分数)乙醇,短暂漩涡,4 ℃ 7 500 g离心5 min,弃上清;无RNA酶洁净空气干燥5~10 min,加50 μL的无RNA酶水溶解,55~60 ℃孵育10 min。检测定量进行后续反转录。
1.6 实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)
采用RNA提取纯化试剂盒(Gene JET RNA Purification Kit)提取细胞RNA。检测定量后取1 μg RNA进行反转录(不加反转录酶作为阴性对照,即No-RT)。采用反转录后的cDNA原液进行相应倍数的稀释,进行qPCR。该过程中使用的引物序列见表2。检测的临界点设定在PCR扩增过程中,荧光信号由本底进入指数增长阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标,熔解曲线分析采用默认条件。结果以18S rRNA进行校正,用ΔΔCt法计算相对基因表达量。

PCR: polymerase chain reaction;SphK1:sphingosine kinase 1;TNF-α: tumor necrosis factor-α.
1.7 统计学方法
2 结果
2.1 预测可能调控SphK1 mRNA表达的microRNA
采用生物信息学数据库TargetScan和miRWalk对可能调控SphK1的microRNA进行预测。由TargetScan Human获得143个miRNA,miRWalk获得387个miRNA,两者结果取交集,获得34个miRNA(图1)。由于后续工作中将在造模小鼠肝脏组织中检测miRNA的表达情况,故在这些miRNA中选取人鼠同源的miRNA,结果为miR-378a-5p、miR-92a-2-5p和miR-708-5p。
2.2 参与肝脏纤维化microRNA的筛选
在造模小鼠肝脏组织样本中检测以上3种miRNA的表达状况。与对照组miR-378a-5p的表达相比,CCl4组miR-378a-5p的表达下调至0.56倍(P<0.05);与对照组miR-92a-2-5p的表达相比,CCl4组miR-378a-5p的表达下调至0.98倍(P<0.05);与对照组miR-708-5p的表达相比,CCl4组miR-708-5p的表达上调至9.82倍(P<0.05)(图2A)。
同时,在造模小鼠肝脏组织样本中检测炎性反应及纤维化相关的指标。与对照组相比,CCl4组小鼠肝脏中TNF-α mRNA的表达上调至6.30倍(P<0.05)(图2B),Col α1(Ⅲ) mRNA的表达上调至3.96倍(P<0.05)(图2C)。此外,miR-378a-5p的表达与Col α1(Ⅲ)的表达呈负相关,相关系数为-0.751(P<0.01)(图2D)。根据miRNA负调控靶基因的先决条件,以及miR-378a-5p与Col α1(Ⅲ)的表达呈负相关,选取其作为后续研究对象,miR-92a-2-5p作为阴性对照。
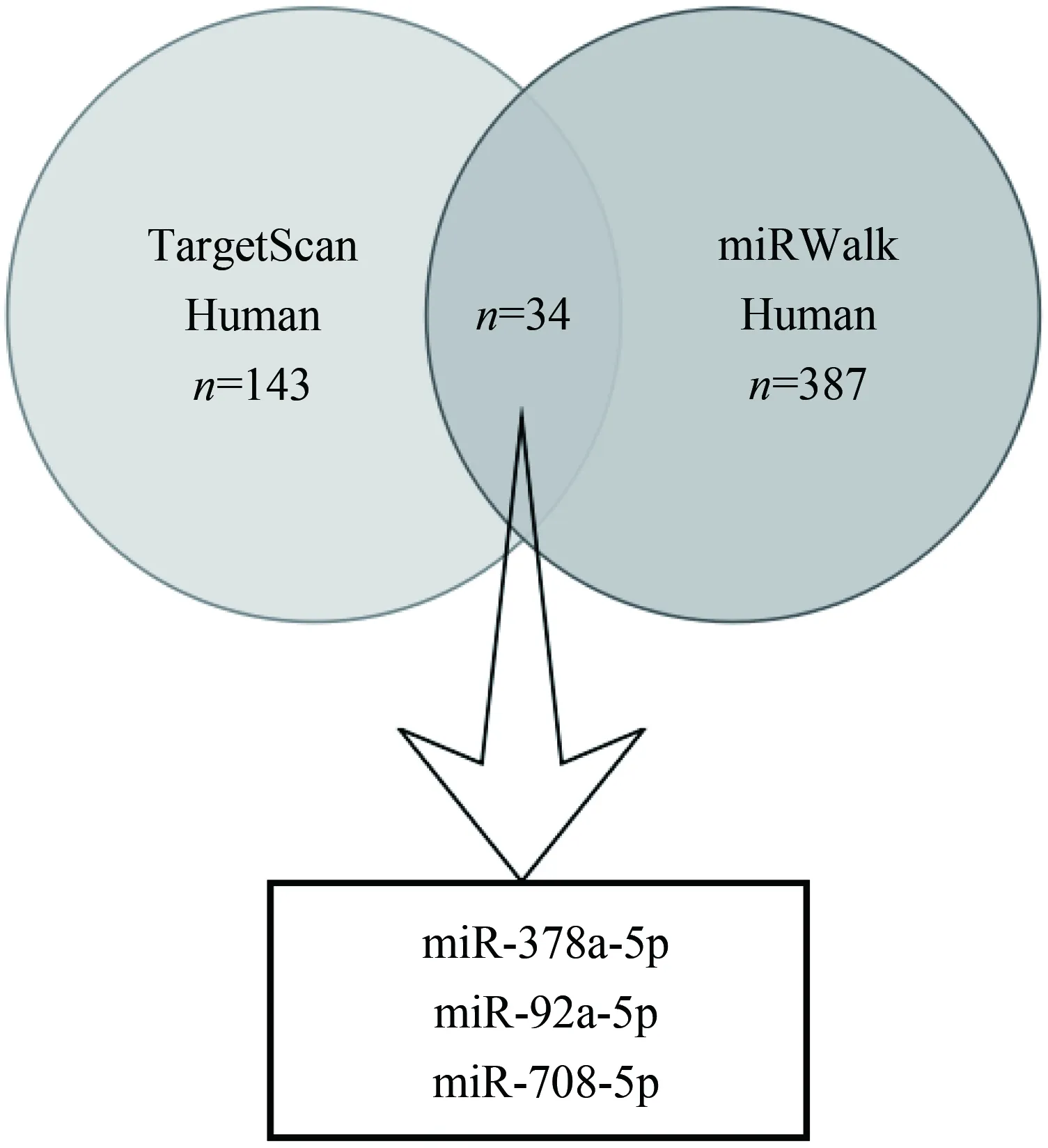
图1 生物信息学预测可能调控SphK1 mRNA的microRNAFig.1 Predict results for microRNA that may regulate SphK1 mRNA
2.3 miR-378a-5p和miR-92a-2-5p与SphK1 mRNA预测的结合位点
作为重要的转录后调控因子,成熟的microRNA可以招募Ago蛋白,形成RISC复合体,通过与靶基因mRNA的3’UTR区域结合,抑制其翻译或降解其mRNA,从而调控该基因的表达。由TargetScan数据库得到,miR-378a-5p和miR-92a-2-5p与SphK1 mRNA 3’UTR的预测结合关系如图3所示。
2.4 miR-378a-5p抑制LX-2中TGF-β介导的SphK1 mRNA表达上调
为了研究miR-378a-5p是否影响SphK1 mRNA的表达,对LX-2进行microRNA模拟物转染的实验。在转染后第24小时换无血清培养基,加入TGF-β1(终浓度10 mg/L),刺激24h后收集细胞,提取RNA进行反转录,后通过RT-qPCR检测SphK1 mRNA的表达。结果表明,TGF-β1能够明显上调LX-2中SphK1 mRNA的表达,使其上调至3.99倍(P<0.05)。miR-378a-5p可以抑制这一过程(图4)。

图2 miR-378a-5p参与CCl4诱导的肝脏纤维化Fig.2 miR-378a-5p participated in CCl4-induced liver fibrosis
A:Relative miRNA expression was examined in the liver tissues of CCl4-treated mouses. miR-378a-5p, miR-92a-2-5p and miR-708-5p were detected, respectively;B:expression of TNF-α mRNA in the CCl4-treated mouse liver;C:expression of Colα1(Ⅲ) mRNA in the CCl4-treated mouse liver;D:correlation between miR-378a-5p expression and SphK1 mRNA expression;*P<0.05.CCl4:carbon tetrachloride;TNF-α:tumour necrosis factor-α;OO: olive oil;SphK1:sphingosine kinase 1.
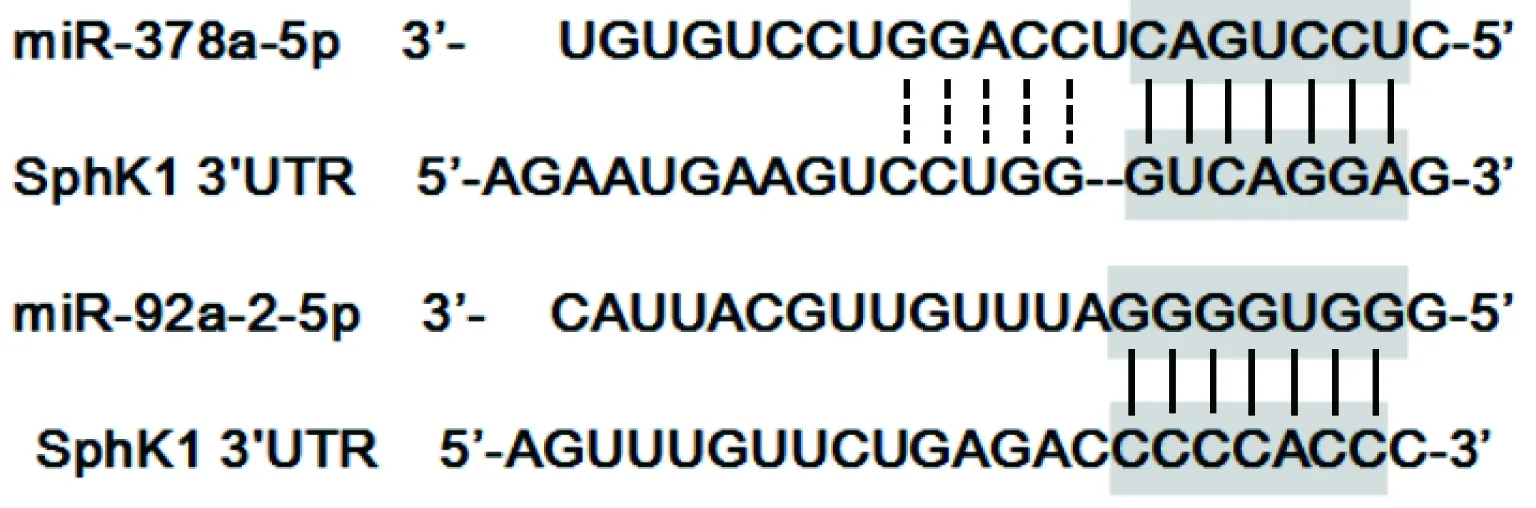
图3 miR-378a-5p/miR-92a-2-5p与SphK1 mRNA 3’UTR的预测结合位点Fig.3 Predicted binding sites between miR-378a-5p/miR-92a-2-5p and SphK1 mRNA 3’UTR
2.5 miR-378a-5p作用被抑制剂阻断后LX-2中SphK1 mRNA表达上调
为了进一步研究miR-378a-5p调控SphK1 mRNA的表达,对LX-2进行miR-378a-5p抑制剂转染的实验。在转染后第48小时收集细胞,提取RNA进行反转录,后通过RT-qPCR检测SphK1 mRNA的表达。结果表明,采用miR-378a-5p抑制剂抑制miR-378a-5p的作用后,SphK1 mRNA的表达显著上调,至对照组的2.16倍(P<0.05)(图5)。

图4 miR-378a-5p能够抑制LX-2中由TGF-β1引起的SphK1 mRNA表达上调Fig.4 miR-378a-5p suppress the increase of SphK1 mRNA expression caused by TGF-β1 in LX-2
*P<0.05vsmimic Ctrl vehicle group,#P<0.05vsmimic Ctrl TGF-β1 group;SphK1:sphingosine kinase 1;TGF-β1:transforming growth factor-β1;Ctrl:control.

图5 阻断miR-378a-5p作用后SphK1 mRNA表达上调Fig.5 Increase of SphK1 mRNA expression caused by inhibition of miR-378a-5p in LX-2
*P<0.05;SphK1:sphingosine kinase 1.
3 讨论
鞘胺醇激酶(sphingosine kinase, SphK)包括两种亚型,SphK1和SphK2,均能催化鞘胺醇的磷酸化,产生脂质分子 S1P。近几年来,研究[23-25]结果表明SphK1参与了肝脏、心脏、肺脏等多种纤维化疾病的过程,并在其中发挥重要的作用。文献[24]报道,TGF-β-SphK1 /S1P信号通路能够促进肾小管上皮细胞的纤维化。也有研究[25]显示,靶向SphK1可以缓解博来霉素诱导的肺纤维化。通过以上证例可见详尽探究SphK1参与纤维化过程分子机制的重要性,且相关研究可为纤维化疾病的治疗提供新的思路。
有文献[26]报道,SphK1能够被多种因子激活,包括表皮生长因子、血管内皮生长因子、血小板衍生生长因子、激素及TGF-β1。TGF-β1是重要的促纤维化细胞因子之一,在HSCs的活化和肝纤维化过程中发挥重要作用。研究[27-31]显示,在肺脏、心脏及胚胎的成纤维细胞中,TGF-β1能够增强SphK1 mRNA及蛋白的表达,促进纤维化的发生。本实验室[9-11]前期结果也证实,TGF-β1诱导hMSCs及hHSCs分化为集成纤维细胞,并且上调hMSCs及hHSCs中SphK1的表达和活性。
近年来miRNA因参与转录后调控而备受关注,作为重要的转录后调控因子,miRNA与多种疾病的发生、发展紧密相关,也为疾病的筛查和治疗提供新的策略。miRNA是由内源基因编码的、长度约为22个核苷酸的非编码单链RNA分子。在细胞内,miRNA与Dicer酶,AGO蛋白等生物大分子形成RNA诱导沉默复合体(RNA-induced silencing complex, RISC)并结合于靶标mRNA的3’-非翻译区(3’-untranslated regions, 3’-UTR),主要通过促进mRNA降解、抑制翻译的方式抑制靶基因表达[12]。
miR-378a为miR-378家族的一员,在CCl4肝纤维化模型中,miR-378a与另两个家族成员miR-378b、miR-378d表达下降;且当miR-378a过表达时,HSCs活化被抑制,肝纤维化程度减轻[32]。此外,miR-378还可以对心肌纤维化过程进行负调控[33]。而miR-92a则可以在肺纤维化过程中抑制TGF-β1诱导的WNT1诱导型信号通路蛋白1(WISP1)表达[34-35]。
本研究结果显示,miR-378a-5p、miR-92a-2-5p和miR-708-5p与SphK1 mRNA 3’-UTR存在结合位点(生物信息学数据库预测)。在造模小鼠肝脏组织样本中,miR-378a-5p的表达明显下调,miR-92a-2-5p的表达略微下调,miR-708-5p的表达显著上调,根据miRNA负调控靶基因的先决条件,选取miR-378a-5p在LX-2细胞中进一步进行验证。结果表明,miR-378a-5p能在LX-2细胞中调控SphK1 mRNA的表达。生物信息学数据库预测的结果,仍需要细胞实验的进一步验证。

