2型糖尿病患者肾脏病变与听力损失的相关性
赵明月 刘 博 王 鹏 杨 毅
(1.北京航天总医院干部医疗科, 北京 100076;2.首都医科大学附属北京同仁医院,耳鼻喉头颈外科 北京市耳鼻咽喉科研究所, 北京 100730;3.首都医科大学附属复兴医院综合科, 北京 100038;4. 首都医科大学附属北京同仁医院内分泌科, 北京 100730)
糖尿病(diabetes mellitus,DM)是一组由多病因引起的以慢性高血糖为特征的代谢性疾病。在社会经济快速发展的今天,随着生活水平的提高、人口老龄化进程加快,我国糖尿病的发病率与患病率急剧增加,从1980年的0.67%飙升至2013年的10.4%[1]。糖尿病可以引起多系统损害,对患者的生命和生活质量影响极大,已经成为继肿瘤、心血管病变之后第三大严重威胁人类健康的慢性疾病[2]。 近年来,糖尿病患者出现头晕、耳鸣、听力下降等报道[3-4]增多,糖尿病引起的听力损害逐渐引起人们的重视。美国健康与营养调查机构的一项大样本调查[2]显示,糖尿病患者更容易发生内耳的损害,听力损失的发生率高于非糖尿病患者,糖尿病可作为听力损害的独立危险因子。糖尿病患者的听力损失有多种不同类型,其中最常见的是进行性、逐步发展的双侧感音神经性耳聋,以高频听力下降为主。但其发病机制尚不清楚,目前认为主要与非酶糖化、二酰甘油-蛋白激酶C、多元醇通路、炎性反应损伤、活性氧等有关,其共同特点是通过多种途径直接或间接累及内耳神经及滋养神经的微血管,最终导致听力减退。研究[3-6]显示,糖尿病患者听力损失的发生率可能与患者的血糖控制情况、病程、脂代谢紊乱、年龄、性别及噪声等有关。
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最严重微血管合并症之一,其典型病理生理改变为微循环障碍和微血管基底膜增厚。已有研究[3-5]表明,糖尿病听力损害多发生在伴有严重合并症的糖尿病患者。Sunkum等[3]的研究显示,合并糖尿病合并症及血糖控制不佳的糖尿病患者听力损失发病率高。Satofumi等[4]研究发现血糖控制不佳的糖尿病患者,其听力损害与糖尿病视网膜病变、糖尿病肾病、糖尿病神经病变相关。以上资料[3-4]表明,DN可能与糖尿病听力损失密切相关,并可能间接的预示糖尿病患者出现听力损失的风险。
本研究旨在通过检测纯音测听、声导抗评估受试者听功能情况,探讨2型糖尿病人群在不同肾脏病阶段的听功能变化规律。初步探讨DN与糖尿病听力损失的相关性,为进一步研究2型糖尿病人群听力损失的发病机制提供科学依据。
1 对象与方法
1.1 研究对象
选取2014年10月至2015年10月于首都医科大学附属北京同仁医院内分泌科病房住院的2型糖尿病患者95例为研究对象,其中糖尿病未合并肾病组(DM组)40例、早期糖尿病肾病组(DN Ⅲ组)28例、临床期糖尿病肾病组(DN Ⅳ组) 27例,考虑到尿毒症期影响听功能的因素较多,故该期肾病患者不纳入本研究。所有入选对象均愿意配合本研究,接受问卷调查、听功能测试及相应的实验室检查,提供完整的调查资料。本研究获得首都医科大学附属北京同仁医院伦理委员会的批准,所有受试者均签署知情同意书。
1)纳入标准:①年龄在20~60岁;②确诊为2型糖尿病的患者,糖尿病诊断标准根据1999年世界卫生组织(World Health Organization,WHO)[6]糖尿病诊断标准,即空腹血糖≥7.0 mmol/L或者口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L或者随机血糖≥11.1 mmol/L。③糖尿病肾病分期的诊断:早期糖尿病肾病期(DNⅢ期):尿白蛋白排泄率(urinary albumin excretion rate,UAER) 20~200 μg/min,微量白蛋白尿期;临床糖尿病肾病期(DNⅣ期):UAER>200 μg/min,大量蛋白尿期。
2)排除标准:①1型糖尿病、糖尿病酮症酸中毒、糖尿病高渗状态或有严重低血糖发作等疾病。②主诉或检查存在中耳疾病。③有耳部外伤和(或)手术史。④有其他明确致内耳损伤病因: 如噪声损害,耳毒性药物使用,梅尼尔病,良性阵发性位置性眩晕,前庭神经炎等。⑤血压高于160/100 mmHg(1 mmHg=0.133 kPa)。⑥患有严重的肝、肾、心脏疾病以及其他全身疾病。
1.2 检测方法
1.2.1 一般资料收集
由同一研究者对每个受试者进行一般情况调查并填写调查表。调查内容包括:性别、年龄、病程、平常降糖措施、合并症情况、既往病史(高血压、冠状动脉粥样硬化性心脏病、高脂血症、脑供血不足等)、耳科疾病史、有无耳科症状。所有受试者均检测身高、体质量、血压、腰围、臀围,并计算体质量指数(body mass index, BMI=体质量/身高2)。
1.2.2 糖脂代谢及临床生物化学指标检测
所有受试者均于6∶00 am抽取空腹静脉血,检测项目包括空腹血糖(fasting blood glucose,FPG)、糖化血红蛋白(glycosylated hemoglobin A1c, HbA1c)、血清总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C),以及血肌酐浓度(creatinine,Cr)。
1.2.3 UAER及肾小球滤过率的检测方法
1)UAER检测:受试者在晚10点排尿弃去,开始留取8 h全部尿液(包括次日凌晨6点),混匀后测量总尿量,再取混匀尿10~20 mL,于干净容器内送检,通过化学发光免疫分析法测定。所有受试者在2周内测定2次UAER取平均值,UAER<20 μg/min为正常,20~200 μg/min为微量白蛋白尿,UAER>200μg/min为大量蛋白尿。
2)肾小球滤过率(glomerular filtration rate,GFR)检测方法:采用单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)测定。受试者饮食如常,于显像前30 min饮水300~500 mL,检查前排尿。用SPECT仪对满针注射器计数 1 min。取仰卧位,以受试者肾为视野中心,进行前臂弹丸式静脉注射99m锝-二乙三胺五醋酸(99mTc-DTPA)5 mCi后动态采集20 min,作分肾血流及动态功能显像,并绘制曲线。通过计算机定量分子软件的方法得到GFR值,并用体表面积标准化(1.73 m-2)。
1.2.4 眼科检查
眼底照相由3位接受培训的眼科专业人员操作,对受试者行CR6.45NM型免扩瞳眼底照相系统(日本佳能公司)检查,照相方法为:(1)眼底照相标准:视盘位于鼻侧野1/2,居中;周边曝光均匀、对称;大血管模糊、瞳孔直径较小者需拍外眼照片。(2)外眼照相标准:角膜居中,反光环居中、清晰;能提供白内障/角膜病的证据。(3)在暗室中暗适应5 min后拍照。并由经验丰富的临床眼科医生出具报告并对受试者进行直接检眼镜检查,最终判定受试者是否合并糖尿病视网膜病变(diabetic retinopathy,DR)。
1.2.5 耳科检查
1)声导抗检测:所有受试者首先进行该项检测,测试采用美国GSI 公司Tymp-Star 综合中耳分析仪测定。鼓室图的测量是以220 Hz的探测音进行测试,外耳道压力设置为1.96~-1.96 kPa表现出连续性变化,从而将各压力下的声顺值相连得出鼓室图曲线,其可表现出A、B和C 3种曲线,其中A型又可分As和Ad 2个亚型。本研究中所有受试者的声导抗检测鼓室图均为A型。
2)纯音测听:采用Conera型纯音听力计(丹麦Madsen 公司)在隔音室测试两耳纯音听阈。测试方法采用降10升5法。测试双耳气导(250~8 000 Hz)和骨导(250~4 000 Hz)阈值。根据测定结果将听力情况分为:传导性听力损失、感音神经性听力损失、混合性听力损失。患者的听力损失与否从以下3方面进行评估:①任一频率听力阈值>25 dBHL 则认为存在听力损失。②患者任意一耳在250、500、1 000、2 000 Hz平均听阈高于25 dBHL 定义为低/中频听力损失; 任意一耳在4 000、8 000 Hz 平均听阈高于25 dB HL 定义为高频听力损失。③平均听力损失评价参照世界卫生组织(World Health Orgnization,WHO)[6]1997年制定的标准,气导纯音测听500、1 000、2 000、4 000 Hz 4个频率的平均听阈为依据,将听力损失进行如下分级:0级(正常):≤25 dBHL;1级(轻度):26~40 dBHL;2级(中度):41~60 dBHL;3级(重度):61~80 dBHL;4级(极重度):≥81 dBHL。
1.3 统计学方法

2 结果
2.1 糖尿病各组临床资料的比较
3组病程、收缩压、高血压病史、糖尿病视网膜病变患病率比较,差异有统计学意义(P均<0.05),DNⅢ组、DNⅣ组与DM组相比,病程相对较长,高血压病及收缩压水平相对较高,糖尿病视网膜病变患病率较高。此外,年龄、性别、BMI、HbA1c、FPG、高脂血症、脑供血不足、周围神经病变等各组间比较,差异无统计学意义(P>0.05),详见表1。
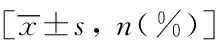
表1 各组临床指标的比较Tab.1 Comparison of clinical data among three groups
2.2 各组听力损失检出率的比较
DM组、DNⅢ组、DNⅣ组受试者中存在听力损失者分别为24例、20例、25例,且均以高频听力损失为主,其中高频听力损失者分别为21例、19例、25例,3组受试者听力损失检出率分别为60.0%、71.4%、92.6%,高频听力损失检出率分别为52.5%、67.9%、92.6%;经χ2检验,差异均有统计学意义,进一步χ2分割发现DNⅣ组的听力损失检出率分别高于DM组和DMⅢ组,详见表2。
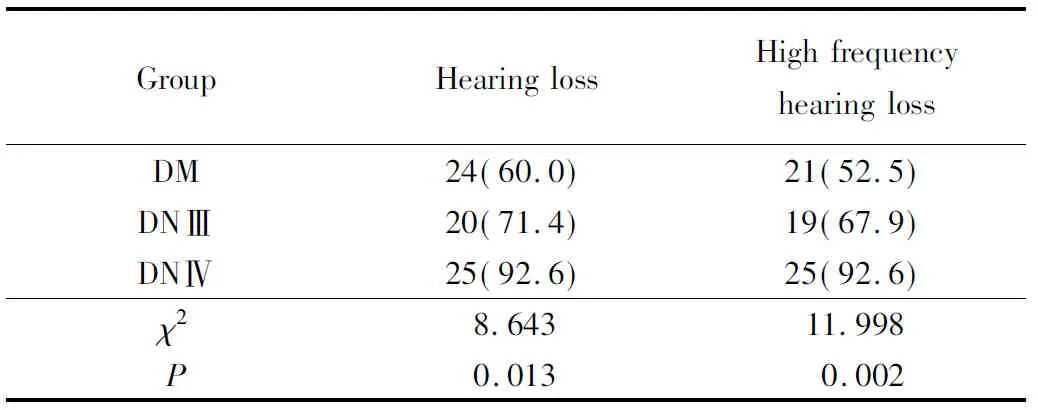
DM:diabetes mellitus;DN:diabetic nephropathy.
2.3 各组纯音测听结果比较
将各组受试者左、右耳各频率的听阈均值进行比较,左、右耳各频率平均听阈值间差异无统计学意义(P>0.05),故取各频率的平均听阈作为单一阈值进行比较。随着检测频率的增高,各组受试者的听阈值均呈升高趋势。进一步比较各组受试者在每个频率听阈的差异,如图1所示,DN Ⅲ组、 DN Ⅳ组在所有频率的听阈均高于DM组(P=0.000),在250、500、1 000、4 000 Hz范围内,各组的听阈DN Ⅳ组高于DN Ⅲ组高于DM组(P=0.000),在2 000、8 000 Hz范围内,DNⅢ组、 DNⅣ组间,差异无统计学意义(P>0.05)。
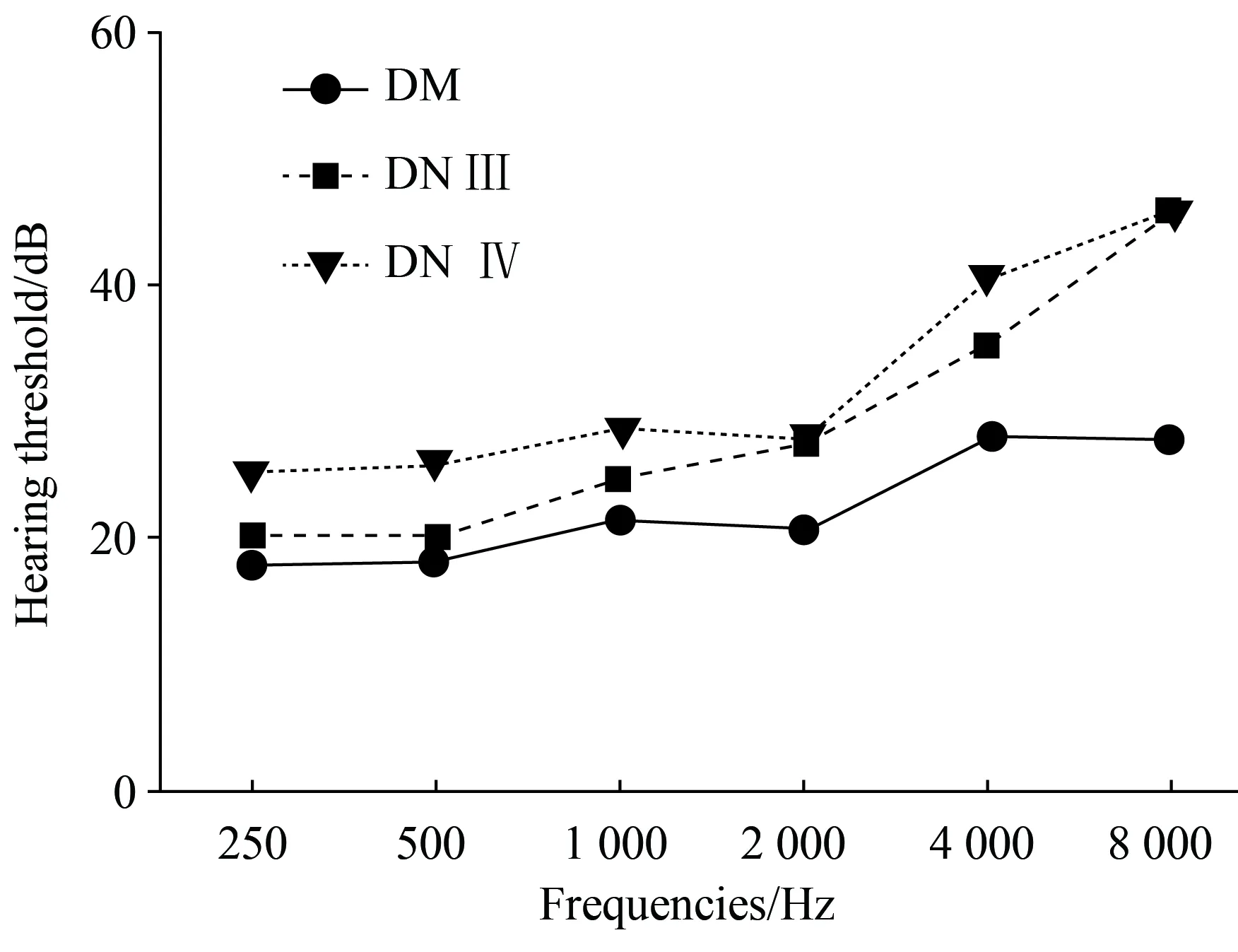
图1 各组受试者在不同频率纯音听阈的比较Fig.1 Comparison of pure tone hearing thresholds at different frequencies in each group
DM:diabetes mellitus;DN:diabetic nephropathy.
2.4 糖尿病患者听力损失程度与肾功能指标的相关性分析
糖尿病患者发生的听力损失以高频听力为主,将受试者高频平均听阈值分别与UAER、GFR、Cr做直线相关分析,结果显示,高频平均听阈与UAER水平呈正相关(r=0.346,P=0.001),与GFR水平呈负相关(r=-0.230,P=0.025),与Cr水平无相关性(r=0.133,P=0.199)。
3 讨论
随着对糖尿病合并症研究的深入,糖尿病引起的听力损害逐渐引起人们的重视。研究[6]显示糖尿病患者更易发生内耳的损害,听力损失的发生率高于非糖尿病患者,糖尿病可作为听力损害的独立危险因子。研究[7-9]显示听力损失和糖尿病之间的关系可能只是一种老化现象。Chika等[7]发现糖尿病与听力损失的关系在年龄≤60岁时更明显。美国健康与营养调查机构[8]的数据也显示年龄<60岁时糖尿病人群听力损失的患病率较非糖尿病者更高,可见糖尿病引起的听力损害在年龄较小的人群中更加明显。Akinpelu等[9]对8个糖尿病相关听力损害研究的实验数据进行Meta分析后得出结论,2型糖尿病听力损失发病率在44%~69.7%。本研究中,DM组、DNⅢ组、 DNⅣ组受试者听力损失检出率分别为60.0%、71.4%、92.6%,较Akinpelu 等[9]的Meta分析结果略高,原因可能与本研究受试者均为2型糖尿病有关。
糖尿病患者听力损失多发生在高频听阈,而人们进行语音交流的频率在500、1 000、2 000 Hz 这3个频率,所以当听力损失没有累及低中频之前,患者常无明显自觉症状。Bainbridge等[2]的研究表明,成年糖尿病患者低中频和高频的听力损害发生率分别为21.3%和54.1%。一项关于糖尿病和听力损失的前瞻性研究发现<60岁的糖尿病患者比正常人更早发生高频听力损失[10]。此外龚敬等[11]发现主诉听力正常的糖尿病患者经纯音测听证实有50%存在听力下降。本研究中,3组受试者均以高频听力损失为主,高频听力损失检出率分别为52.5%、67.9%、92.6%。高频听力相比低频听力更容易受损,这是由其解剖和生理上的特点造成的[12]。当声音经鼓膜及听骨链自前庭窗进入耳蜗时,首先到达感受高频的耳蜗基底膜的底回,同时耳蜗中央部的耳蜗螺旋动脉经底回到达顶部,如果出现噪声、感染、或药物中毒等因素刺激,不论是经前庭窗,还是血行进入耳蜗,都是首先到达底回。Seidman等[13]的研究发现,微血管病变、神经纤维减少和毛细胞缺失在耳蜗底回尤为明显。
尽管糖尿病患者的听力损害已经引起关注,但糖尿病听力损失的原因尚不明确,目前主要有内耳微血管病变和神经病变两种学说[14-19]。Tomisawa[15]通过对糖尿病者和非糖尿病者的颞骨进行研究,发现糖尿病患者内耳组织的耳蜗血管纹及基底膜血管壁明显增厚,且耳蜗底回和顶回的外毛细胞缺失、毛细胞内环境紊乱。研究[17]显示,糖尿病周围神经病变可波及听神经和前庭神经,造成患者耳鸣、听力下降、眩晕等位听功能减退症状。目前研究[18-20]显示糖尿病周围神经病变与微血管病变有关。长期的代谢紊乱导致血管基底膜增厚,微血管供应区神经缺血、缺氧,神经脱髓鞘改变及髓鞘空泡样改变,引起糖尿病神经病变。此外,滋养神经的微血管受累可引起单神经病变或多发神经病变。Howes等[18]研究显示,糖尿病所致听力损失可能与基因异常表达有关,母系遗传性糖尿病伴耳聋 (maternally inherited diabetes and deafness,MIDD)与线粒体DNA发生3243A-G点突变有关,其听力丧失的进展可能与线粒体DNA异质性程度相关。
DN是DM的常见的微血管合并症之一,我国约20%~40%的糖尿病患者合并糖尿病肾病,现已成为慢性肾脏病和终末期肾病的主要原因[20-21]。DN的基本病理变化在肾脏微血管及肾小球,组织学表现为基底膜样物质增多,并累及系膜细胞,同时有毛细血管基底膜增厚。在 DN 的发生、发展中,除了肾小球病变,肾小管和间质也可发生病理改变,起着重要的作用[22],远端肾小管细胞肿胀,上皮细胞空泡变性,基膜增厚,间质纤维化,晚期可见肾小管萎缩,基膜增厚和管腔扩张。糖代谢异常、细胞因子、氧化应激、遗传因素以及继发的肾脏血流动力学改变在 DN 的发生、发展中起着非常重要的作用。糖尿病所致肾损害的发生、发展可分为5期:(1)Ⅰ期:糖尿病初期,肾小球超滤过,肾小球滤过率(glomerular filtration rate,GFR)明显升高;(2)Ⅱ期:肾小球毛细血管基底膜增厚及系膜基质轻度增宽,UAER多正常,GFR轻度增高;(3)Ⅲ期:早期糖尿病肾病期,出现持续微量白蛋白尿,UAER持续在20~200 μg/min,GFR仍高于正常或正常;(4)Ⅳ期:临床糖尿病肾病期,肾小球病变更重,肾小管萎缩及间质纤维化;尿蛋白逐渐增多,UAER>200 μg/min,GFR下降;可伴有水肿和高血压;(5)Ⅴ期:尿毒症期,多数肾单位闭锁,UAER降低,血肌酐升高,血压升高。本研究中,DNⅢ组、DNⅣ组与DM组相比,病程较长,高血压病患病率及收缩压水平较高(表1)。糖尿病视网膜病变常早于糖尿病肾病发生,大部分糖尿病肾病患者患有糖尿病视网膜病变[23],本研究中,DNⅢ组及DNⅣ组受试者眼底照相证实均有不同程度的视网膜病变。
内耳和肾脏在解剖结构上存在相似性。研究[23]显示,内耳的血管纹与肾脏的肾小球都是与微血管密切相关的上皮结构。研究[24]显示,内耳血管纹、毛细血管基底膜与肾小球基底膜具有相同抗原。发生微血管病变的肾脏与听力损失的内耳均会出现毛细血管基底膜变厚,管腔狭窄,血管通透性增高。这些观察数据表明,糖尿病肾病与糖尿病引起的听力损害在病理过程上有相似之处,糖尿病听力损害多发生在合并症严重的患者。Sunkum等[3]研究显示,糖尿病患者人群中,出现糖尿病合并症及血糖控制不佳的患者听力损失发病率较高。Lin等[25]关于糖尿病突聋的相关危险因素的大样本研究中,糖尿病患者听力损失发病率比正常人群高1.54倍,伴有DR的患者有更高的听力损害风险,而且多发生在糖尿病合并症严重的患者。Satofumi等[4]研究了血糖控制不满意的糖尿病住院患者,其听力损害与糖尿病视网膜病变、糖尿病肾病、肌酐清除率、糖尿病神经病变相关。以上资料表明,DN可能与糖尿病引起的听力损失密切相关,并间接提示糖尿病患者发生听力损害的风险,本研究中出现高频听力损失的受试者中DN的患病率较高,且合并肾脏病变者的听力损失发病率较高,提示二者之间存在相关性,而目前尚未见有关不同阶段DN与听力损失的相关性研究。
本研究中,从DM组到DNⅣ组听力损失发病率逐渐升高,分别为60.0%、71.4%、92.6%,高频听力损失发病率的升高尤为明显,依次为52.5%、67.9%、92.6%,差异均有统计学意义(P<0.05),进一步两两比较发现DNⅣ组的听力损失检出率分别高于DM组和DMⅢ组(表2)。进一步比较该人群中不同频率范围的听阈,纯音测听结果显示,随着检测频率的增高,各组受试者的听阈值均呈升高趋势;进一步比较各组受试者在每个频率听阈的差异,DNⅢ组、 DNⅣ组在所有频率的听阈均高于DM组(P=0.000),在250、500、1 000、4 000 Hz范围内,各组的听阈DNⅣ组高于DNⅢ组高于DM组(P=0.000),在2 000、8 000 Hz范围内,DNⅢ组、 DNⅣ组间比较,差异无统计学意义(P>0.05)。相关分析显示,糖尿病患者高频平均听阈与UAER呈正相关(r=0.346,P=0.001),与GFR水平呈负相关(r=-0.230,P=0.025),提示随着2型糖尿病患者肾损害程度的加重,听力损失风险增高。由此推测在2型糖尿病患者中,DN与听力损失存在相关性。
Shen等[26]通过对32例有听力损害和36例无听力损害的2型糖尿病患者研究发现,听力损害的程度与尿蛋白的增加是正相关的,通过在有尿蛋白的患者中进行听力筛查有助于发现早期的听力损害。这与本研究结果一致。研究[27-29]显示,随着肾功能及肾小球滤过率的下降,机体代谢产物潴留、肌酐、尿[3,24]水平升高,对内耳的毒性作用加大,可抑制听神经传导功能,影响Na+/K+-ATP酶、Mg+-ATP酶活性而影响听力,听力损害的程度加重。糖尿病微血管合并症与听力损失之间的这种相关性可能是因为微血管病变引起了耳蜗功能的下降[7],耳蜗相关神经细胞受损[30-31],传音系统结构功能受损[32],毛细血管的基底膜增厚、血管内皮细胞的增生、管腔的狭窄、糖蛋白沉积以及滋养神经的微血管受累[33-35],从而导致了听力的损害。基于肾脏和内耳在解剖和生理学上的密切关系,本研究也提示糖尿病肾病可能是听力损失一个相关因素,但是具体的机制仍然不太清楚,有待于今后进一步的研究探讨。对UAER、GFR等糖尿病肾病相关指标的监测可能有助于听力损失的早期防治。
本研究不足之处在于没有正常人群对照组,听力损失检出率可能偏高。样本量相对较小,不能完全反映整个群体的特征,后期研究可进行大样本人群研究。本研究进一步证实了2型糖尿病患者听力损失风险增高,主要表现为高频听力损失,听力损失与肾脏病变存在相关性,随着肾脏病变的加重,听力损失发生的风险增高。在合并DN的2型糖尿病患者中,应积极进行听力筛查以便能早期发现听力问题并给予及时的干预措施。

