气相色谱法测定食品中甜蜜素前处理优化研究
□ 刘本发 聂巍巍 刘宪军 沧州市产品质量监督检验所
甜蜜素化学名称为环己基氨基磺酸钠,是一种人工合成的非营养的甜味剂,甜度为蔗糖的30~50倍,易溶于水,是一种高甜度、无热值、安全卫生的甜味剂。但摄入过量对人体的肝脏和神经系统造成危害。因此,GB 2760-2014《食品安全国家标准 食品添加剂使用标准》[1]中规定了其使用范围和最大使用量。
目前,国内外食品中甜蜜素检测的方法主要有比色法[2-3]、薄层层析法[4]、气相色谱法[5-10]、高效液相色谱法[11-14]、气质联用法[15-17]、液质联用法[18-19]和离子色谱法[20-21],但应用最广泛的还是气相色谱法。在实际工作中,根据GB 5009.97-2016《食品安全国家标准 食品中环己基氨基磺酸钠的测定》[22]第一法检测,甜蜜素衍生物有2个色谱峰分别是环己醇亚硝酸酯和环己醇[23],而且随着时间迁移环己醇亚硝酸酯不断的分解为环己醇,而2个色谱峰的大小也会不断发生变化,直接导致2个色谱峰面积不确定,无法准确定量。当甜蜜素的使用量接近使用限量值时,国家标准方法中甜蜜素衍生物色谱峰峰面积随时间变化的充满不确定性,会为检验人员带来极大的困扰,导致无法判定该食品是否合格;而且随着食品安全关注度的提高,检验人员每天要处理几十个样品,进样时间高达10 h,环己醇亚硝酸酯在此期间不稳定得问题急需解决。既然甜蜜素衍生物环己醇亚硝酸酯与正庚烷中少数水分反应水解为环己醇和亚硝酸,那么根据酯水解的化学反应平衡原理,在样品上气相色谱分析以前,对检测甜蜜素衍生物的正庚烷萃取液进行脱水处理,降低溶液中的水分含量,应可大大抑制环己醇亚硝酸酯的分解速度,从而能使甜蜜素的检测结果稳定性进一步加强。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
Agilent 7890气相色谱仪:附氢火焰离子化检测器(FID),Agilent Technologies;Agilent 10 μL微 量进样针:货号P/NG4513-80203,Agilent Technologies;电子天平:型号YP5002,常州市衡正电子仪器有限公司;电子天平:型号FA2004,上海良平仪器仪表有限公司;快速混匀器:型号SK-1,江苏中大仪器厂;高速冷冻离心机:型号TGL16M,沙湘智;台式高速离心机:型号TGL16,金坛市科析仪器有限公司。
1.1.2 试剂
正庚烷(分析纯,天津市科密欧化学试剂有限公司)、氯化钠(分析纯,天津市科密欧化学试剂有限公司)、无水硫酸钠(分析纯,天津市百世化工有限公司)、50 g/L亚硝酸钠溶液、200 g/L硫酸溶液、200 g/L亚铁氰化钾溶液、300 g/L硫酸锌溶液、10.0 mg/mL环己基氨基磺酸钠标准溶液[坛墨质检,GBW(E)082260b,批号 A1712077]。
1.2 试验方法
1.2.1 样品前处理
①液体样品。称取液体样品5.00 g于50 mL比色管中,加水30 mL,加入2.0 mL亚铁氰化钾溶液,2.0 mL硫酸锌溶液后用水定容至50 mL备用。
②固体样品。称取打碎混匀的固体样品5.00 g于50 mL比色管中,加水30 mL,加入2.0 mL亚铁氰化钾溶液,2.0 mL硫酸锌溶液后定容50 mL,超声提取20 min,混匀,过滤清液备用。
1.2.2 样品衍生化
吸取1.2.1的清液10.0 mL于50 mL带盖离心管,离心管置试管架冰浴中5 min后,准确加入5.00 mL正庚烷,加入2.5 mL亚硝酸钠溶液,2.5 mL硫酸溶液,盖紧离心管盖,摇匀在冰浴中放置30 min,期间振摇3次,加入2.5 g氯化钠盖上盖后置涡旋混合器上振动1 min,低温离心10 min,取上层萃取液1.5 mL于带盖离心管中(离心管中事先加入1.0 g无水硫酸钠)涡旋混匀15 s后8 000 r/min离心,取上层清液以备进样。
1.2.3 不脱水标准样品的制备
分别准确移取1.00 mg/mL环己基氨基磺酸标准溶液0.10、0.25、0.50、1.00、2.0、5.0 mL和 10.0 mL于 25 mL容量瓶中,加水定容,配成标准溶液系列浓度为0.004、0.01、0.02、0.04、0.08、0.20 mg/mL和 0.40 mg/mL。准确吸取标准系列溶液10.0 mL于50 mL带盖离心管。离心管置试管架冰浴中5 min后,准确加入5.00mL正庚烷,加入2.5mL亚硝酸钠溶液,2.5mL硫酸溶液,盖紧离心管盖,摇匀在冰浴中放置30 min,期间振摇3次,加入2.5 g氯化钠盖上盖后置涡旋混合器上振动1 min,低温离心10 min,取上层萃取液以备进样。
1.2.4 脱水标准样品的制备
取同(1.2.1)处理样品1.5 mL上层萃取液于2 mL带盖离心管中(离心管中事先加入1.0 g无水硫酸钠)涡旋混匀15 s后8 000 r/min离心,取上层萃取液以备进样。
1.2.5 色谱条件
色谱柱:Agilent 19091N-213;柱温:65 ℃保持2 min,然后以10 ℃/min升到110 ℃,保持2 min;进样口温度:230 ℃;进样量1 μL,分流进样,分流比1∶10;FID检测器温度:300 ℃;载气流速:1 mL/min;氢气30 mL/min;空气300 mL/min。
2 结果与分析
2.1 标准样液在0~110 min内的色谱峰面积
0.4 mg/mL标准样液的脱水萃取液与未脱水萃取液在0~110 min内色谱峰面积对比如图1所示,经过脱水处理的甜蜜素衍生物萃取液(简称脱水萃取液)与未经过脱水处理的甜蜜素衍生物萃取液(简称未脱水萃取液)同样连进12针,每一针时间间隔约10.3 min。未脱水萃取液在不到2 h的时间内峰面积缩小了将近15%,而脱水萃取液在110 min内色谱峰面积只缩小了不到3%。这说明,甜蜜素衍生化溶液经过脱水,因为溶液中的水分含量过低,直接影响了环己醇亚硝酸酯水解速度,与酯水解的化学反应平衡原理相符。
2.2 标准样液在0~10 h内的色谱峰面积
标准系列的未脱水萃取液和脱水萃取液在0~10 h的色谱峰面积数据表格的对比见表1。由表1可知,在2.5 h时,所有浓度标准系列的未脱水萃取液峰面积都已经衰减了将近15%,而且可以看出,标准样液的脱水萃取液浓度越高,衰减越快。
而如表2所示,在10 h内,所有浓度标准系列的脱水萃取液峰面积衰减不足6%。
通过表1和表2的RSD对比可以看出,脱水萃取液稳定性远高于未脱水萃取液。
2.3 脱水萃取液和未脱水萃取液的标准系列曲线对比
如表3所示,脱水萃取液的标准系列溶液的标准曲线和未脱水萃取液的标准系列溶液的标准曲线R2分别为0.999 7和0.999 6。这说明经过脱水处理,无水硫酸钠对环己醇亚硝酸酯吸收的影响微乎其微,标准溶液萃取液并不实际测定的精度和准确度。
2.4 脱水和未脱水样品加标回收率对比
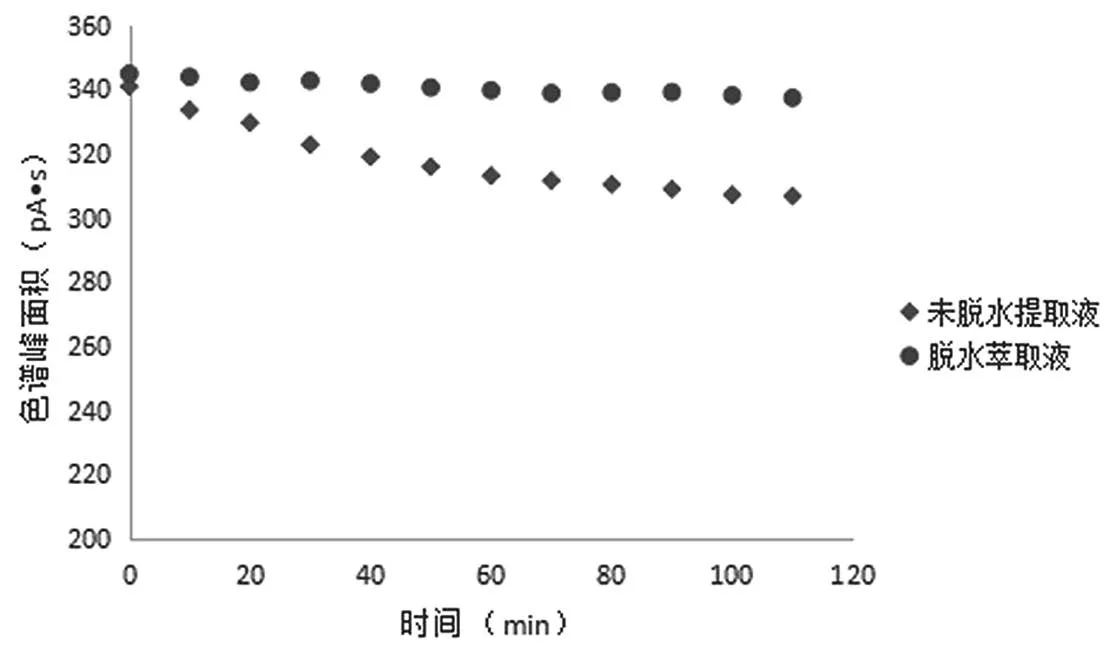
图1 浓度为0.4 mg/mL的标准样液的脱水萃取液与未脱水萃取液在0~110 min内色谱峰面积

表1 标准系列溶液的未脱水萃取液在10 h的色谱峰面积

表2 标准系列溶液的脱水萃取液在0~10 h的色谱峰面积
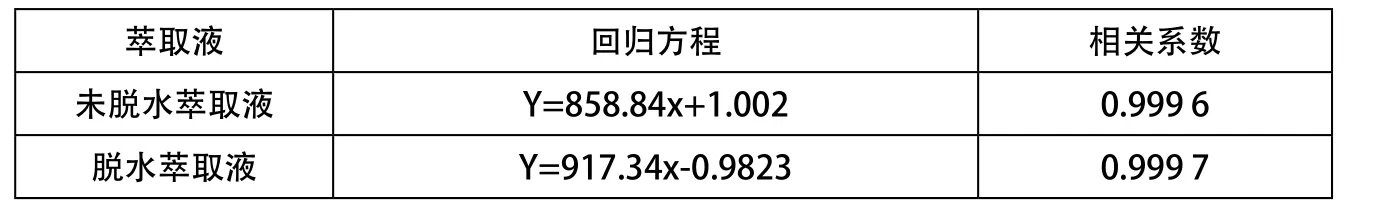
表3 标准回归曲线

表4 方法回收率
取不含饮料并分为3份,分别加入低、中、高3种浓度的标准溶液,经处理测定,结果见表4。
3 结论
甜蜜素国家标准规定的气相色谱检验方法,在硫酸介质中生成甜蜜素衍生物环己醇亚硝酸酯,通过测定萃取液正庚烷中的环己醇亚硝酸酯的色谱峰对甜蜜素定性和定量。但在实际工作中,甜蜜素萃取液中有2个色谱峰,而且随着时间变化2个色谱峰的大小也会发生变化,影响了结果的稳定性和准确性。通过实验研究,①确定通过在甜蜜素衍生物的萃取溶液中加入无水硫酸钠进行脱水能有效延缓甜蜜素衍生物环己醇亚硝酸酯的分解速度;②未脱水萃取液,则萃取液中的己醇亚硝酸酯在0~2.5 h内会衰减15%,在此期间测定甜蜜素,测定结果偏差较大,直接影响测定的准确度和精确度;③如果经过脱水处理,则萃取液中的己醇亚硝酸酯在0~10 h内相对比较稳定,色谱峰面积衰减不足6%,对甜蜜素测定不准确性的影响很小;④脱水方法的回归曲线R2为0.999 7,回收率在96.7%~104%。
综上所述,通过增加脱水处理萃取液的方法改进国家标准,步骤简单、效果明显,尤其是在大批量检测时,帮助更大,是一个比较实用的改进方法。

