超声处理对转谷氨酰胺酶交联乳清分离蛋白的结构特性和凝胶保水性的影响
孙 佳,王春燕,皮若冰,李 桐,刘 飞,姜瞻梅
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江哈尔滨150030)
乳清是生产干酪或干酪素的副产物,从乳清中制得的蛋白质产品有乳清浓缩蛋白(WPC)和乳清分离蛋白(WPI),乳清蛋白因其丰富的营养价值和功能特性被广泛应用在食品工业中[1]。WPI具有良好的凝胶性,但其凝胶保水性较差,在食品工业上的应用具有一定的局限性。目前,常见的蛋白改性方法主要有物理方法、化学方法和酶法。比较而言,酶法改性条件温和,副产物较少。在食品酶改性方面,转谷氨酰胺酶已经成功地运用到大豆分离蛋白、小麦面筋蛋白等蛋白的改性[2-3]。
转谷氨酰胺酶(TGase,EC2.3.2.13)是一种催化酰基转移反应的转移酶,它可以催化肽结合的赖氨酸残基的ε-氨基和肽结合的谷氨酰胺残基的γ-羧酰胺基之间的酰基转移反应,导致形成ε-(γ-谷氨酰胺)赖氨酸共价键[4]。TGase对蛋白质的主要作用有催化蛋白质分子内和分子间的交联,从而改变蛋白质的功能特性,如凝胶性、乳化性、起泡性和热稳定性等[5-6]。Wang 等[7]研究表明,含有 TGase 的小麦面筋蛋白凝胶在离心后可以保留住更多的水分,添加TGase可以显著改善凝胶的保水性。此外,Lorenzen[8]研究表明,在预热和 TGase交联的加工条件下,复原脱脂乳和乳清蛋白的功能特性(如表观粘度、保水性和热稳定性)增加。但是,由于WPI的主要成分α-乳白蛋白(α-La)和 β-乳球蛋白(β-Lg)的刚性球状结构,TGase交联的位点以及空间位阻等原因,WPI不是TGase作用的良好底物,因此需要用物理手段处理WPI,以促进TGase的交联反应。新兴的物理改性手段主要有超声、高压和微波等方法[9-10],超声处理作为一种新兴的技术,可以促进蛋白质分子的展开,减少蛋白粒径,暴露出更多的游离巯基和疏水性基团[11]。同时,通过超声处理可以有效暴露酶交联反应位点,促进交联程度的提高及增加交联产物的产量[12]。
本研究采用超声波与TGase交联相结合的方法,研究两者的联合作用对WPI的分子量分布、粒径大小、荧光强度和凝胶保水性的影响,建立物理结合酶技术,生产具有优良凝胶保水性的改性蛋白质的工艺过程,为工业化生产提供理论基础和技术支撑。
1 材料与方法
1.1 材料与仪器
WPI(蛋白质含量93.5%) 美国Mullins Whey公司;转谷氨酰胺酶(酶活100 U/g) 江苏一鸣生物股份有限公司;Marker(14~120 kDa) 上海Novoprotein公司;十二烷基硫酸钠(SDS)、三羟甲基氨基甲烷(Tris)、β-巯基乙醇和8-苯胺-1-萘磺酸(ANS) 美国Sigma-Aldrich公司;丙三醇 天津市天力化学试剂有限公司;浓盐酸 哈尔滨理工化学试剂有限公司;溴酚蓝 天津市永大化学试剂有限公司;其他试剂 均为分析纯。
DY-1200Y超声细胞破碎仪 中国上海德阳仪邦仪器有限公司;Nano-ZS90激光粒度仪 英国Malvern公司;1658050Bio-Rad电泳仪 美国 Bio-Rad公司;F4500荧光分光光度计 日本日立公司。
1.2 实验方法
1.2.1 超声和TGase联合处理WPI样品的制备 将乳清分离蛋白(WPI)12.5 g溶于100 mL去离子水中,室温下置于磁力搅拌器搅拌2 h使蛋白充分溶解,得到浓度为125 mg/mL的蛋白溶液。将所得WPI溶液用1 mol/L的NaOH溶液调整pH为7.0。将溶解好的WPI溶液在400 W(20 kHz)的条件下超声处理 0、10、20、30、40 min(工作时间为 2 s,间歇时间4 s),样品溶液超声过程中置于冰水浴中,以保证样品温度不超过30℃。分别添加35 U/g的TGase于预处理好的蛋白溶液中,于50℃水浴锅中分别反应4 h,取出后立即置于75℃水浴锅中灭酶15 min,于室温冷却,将酶反应后的蛋白溶液冻干,所得冻干粉于-20℃冰箱中冷冻以备后续测定。空白组是单独超声处理的WPI。
1.2.2 分子量分布 根据Cura等[13]的方法进行了改进,通过聚丙烯酰胺凝胶电泳(SDS-PAGE)估算样品的分子量分布。在实验中使用4%的浓缩胶与12.6%的分离胶。用去离子水将样品溶液稀释至浓度为2.5 mg/mL,取10μL的5×SDS样品缓冲液(0.6 mL浓度为1 mol/L的Tris-HCl缓冲液(p H6.8),2.0 mL浓度为100 mg/mL的 SDS溶液,5.0 mL浓度为50%的甘油,1.0 mL浓度为10 mg/mL的溴酚蓝,0.5 mLβ-巯基乙醇,0.9 mL去离子水)加入到40μL的样品中,混合均匀,进行沸水浴处理5 min,冷却后上样。用10μL微量进样器吸取蛋白质样品,进行上样。蛋白质条带通过考马斯亮蓝R250染色。
1.2.3 粒径分布 样品按质量比为1∶50用去离子水稀释,稀释至浓度为1 mg/mL,通过0.45μm过滤器过滤,采用粒度分布仪测定样品中粒子大小及其体积分布情况。
1.2.4 荧光光谱扫描 根据Liu等[14]的方法进行了改进,通过荧光分光光度计对样品进行固有荧光扫描。样品用0.01 mol/L磷酸盐缓冲液(p H7.0)稀释至终浓度为1 mg/mL。扫描的激发波长为280 nm,发射波长为290~420 nm。激发和发射的狭缝宽度均为5 nm,扫描速率为240 nm/s。
1.2.5 表面疏水性的测定 根据Chandrapala等[15]的方法进行了改进,以1-苯胺基-8-萘磺酸盐(ANS)为荧光探针,测量蛋白的表面疏水性值。用0.01 mol/L磷酸盐缓冲液(pH7.0)将蛋白质量浓度调为1~5 mg/mL,然后将20μL的 ANS(8 mmol/L在0.01 mol/L p H为7.0的磷酸盐缓冲液中)加入到4 mL蛋白质稀释液中,并在黑暗中保持15 min,然后进行测量。激发和发射波长为390、470 nm。激发和发射的狭缝宽度均为5 nm。荧光强度与蛋白质浓度线性回归的初始斜率为表面疏水性。
1.2.6 凝胶保水性(WHC)的测定 根据Yuan等[16]的方法测定样品的凝胶保水性。取15 mL反应后的蛋白溶液于25 mL烧杯,用保鲜膜封口,之后置于95℃的水浴锅中加热30 min,取出后立即放入冰水浴中冷却30 min,存放在4℃冰箱中过夜。将上面制备的乳清分离蛋白酶改性凝胶置于离心管中,在8000 r/min条件下离心30 min。离心后倒置排出水分,残留的水分使用干燥滤纸小心去除。装有凝胶样品的离心管在离心前后都进行准确称量,两者差值作为释放的液体重量,WHC计算如下:
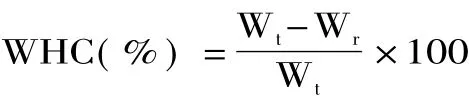
式中,Wt表示样品中的液体的总质量;Wr表示样品离心后去除液体后的总质量。
1.3 数据处理
每个试验重复三次,结果表示为平均值±标准差。所有数据采用SPSS 22.0软件进行单因素分析,Duncan多重分析,p<0.05为差异显著。
2 结果与分析
2.1 超声处理对TGase交联WPI产物分子量分布的影响
在还原条件下,通过SDS-PAGE研究超声处理对WPI的TGase催化的交联反应的影响。由图1泳道1~5可以看出,超声处理对WPI的分子量分布并没有明显的影响;泳道6~10加入TGase后,在分子量为120 kDa处有新的条带生成,并且WPI的主要成分 α-乳白蛋白(α-La)和 β-乳球蛋白(β-Lg)的含量较未加TGase组相比明显减少,证明加入TGase后有新的大分子聚合物生成。同时,由图1泳道6~10可以看出,随着超声处理时间从0 min增加至40 min,分子量为120 k Da附近的条带颜色逐渐加深。且在超声30 min(条带9)和超声40 min(条带10)后TGase交联的WPI,由于聚合物相对分子量的增加,交联后产物的溶解度降低,生成了少量不溶性的大分子聚合物,以至于不能很好进入浓缩胶界面(即图中泳道6~10顶端黑色条带)。证明超声处理能够更好地促进TGase交联,且随着超声处理时间的延长,生成的大分子聚合物的量逐渐增多。这可能是超声的空化效应作用于蛋白质分子,使蛋白质分子的粒度减小(由图2A可以看出),能够暴露出更多的反应位点,更有利于 TGase交联反应的进行[17-18]。

图1 超声处理后的TGase交联WPI产物的SDS-PAGEFig.1 SDS-PAGE of the TGase-catalyzed cross-linking of WPI products with the ultrasound pretreatment注:条带M为Marker;泳道1~5分别是WPI超声处理0、10、20、30、40 min;泳道6~10 分别是 WPI超声处理0、10、20、30、40 min 后进行 TGase 交联。
2.2 超声处理对TGase交联WPI产物粒径分布的影响
将WPI溶液超声处理后再进行TGase交联,得到的样品溶液稀释一定的倍数后,测定其粒径体积分布情况。由图2(A)可以看出,超声处理会导致WPI分子的粒径减小,并且随着超声处理时间延长至40 min,WPI的粒径达到最小。这可能是因为,超声处理的空化效应产生的微流束作用、高剪切力、湍流和涡旋等作用,减弱了蛋白质分子间的相互作用,从而降低了蛋白质分子的聚集程度[19-20]。由图2(B)可以看出,TGase交联后WPI的粒径均呈增大的趋势,并且超声处理后TGase交联的WPI的粒径明显高于未经超声处理的蛋白的粒径。这是因为,TGase交联后生成了大分子聚合物,并且随着超声处理时间的延长,生成的大分子聚合物的量逐渐增多,从而证明超声处理能够暴露出TGase作用的反应位点,更有利于交联反应的进行,从而生成粒径较大的交联产物。
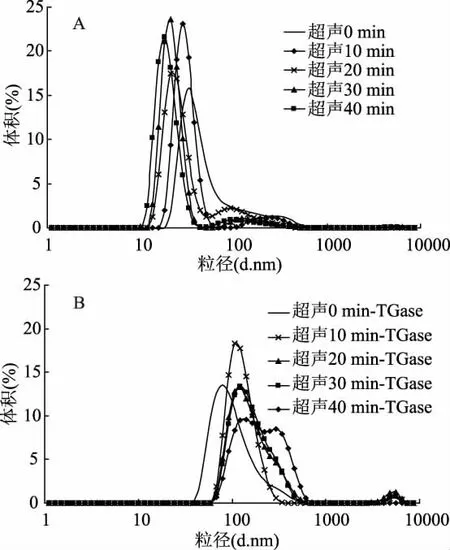
图2 超声处理对TGase交联WPI产物的粒径分布的影响Fig.2 Effect of ultrasound pretreatment on partical size distribution of TGase-catalyzed WPI cross-linking product注:A是超声处理WPI的粒径分布图;B是WPI超声处理后TGase交联的粒径分布图。
2.3 超声处理对转谷氨酰胺酶交联乳清分离蛋白产物荧光强度的影响
将WPI溶液超声处理后再进行TGase交联,得到的样品溶液稀释一定的倍数后,测定其荧光强度和表面疏水性的变化情况。对反应前后的样品进行荧光扫描,通过疏水性氨基酸的发射峰强度(色氨酸、酪氨酸和苯丙氨酸)来判断蛋白质三级结构的变化情况。由图3可以看出,随着超声处理时间的延长(0~40 min),TGase催化交联的WPI和未经TGase催化交联的WPI的荧光强度均呈增加的趋势,在超声时间为40 min时荧光强度达到最大。同时,由图4可以看出,随着超声处理时间的延长,未经TGase交联的 WPI的表面疏水性逐渐增加,超声处理10、20 min的疏水性差异不显著(p>0.05);加入TGase后表面疏水性显著增加(p<0.05),并且表面疏水性随着超声处理时间的延长而逐渐增大,但在超声处理10、20和30 min时差异不显著(p>0.05)。这可能是因为,超声处理能够从蛋白质分子内部暴露出更多的疏水性氨基酸残基,主要是色氨酸残基(蛋白质分子中发生了从酪氨酸残基到色氨酸残基之间的能量转移,导致酪氨酸残基的荧光猝灭和色氨酸残基的荧光增强[21])。同时由于超声处理导致蛋白质分子一定程度的展开,从而导致更多的疏水基团和分子内部区域暴露于极性更强的环境中,蛋白质分子的表面疏水性增强[22]。此外,TGase催化交联的WPI的荧光强度明显高于未经TGase催化的乳清分离蛋白,且加TGase后荧光峰发生了红移(由338 nm移到342 nm),这可能是因为,TGase交联导致蛋白质分子结构的伸展,芳香族氨基酸的极性环境增大,从而导致更多的疏水性氨基酸的暴露和表面疏水性的增加[23]。
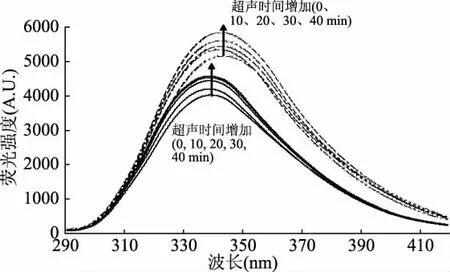
图3 超声处理对TGase交联WPI产物的荧光强度的影响Fig.3 Effect of ultrasound pretreatment on fluorescence intensity of TGase-catalyzed WPI cross-linking product
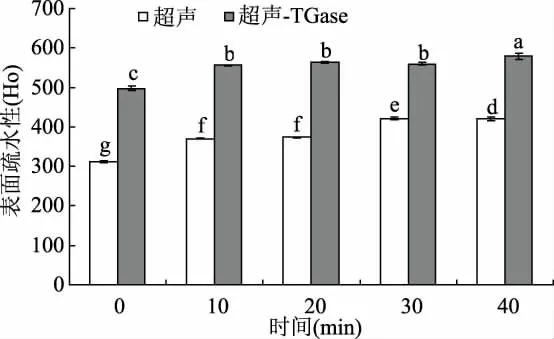
图4 超声处理对TGase交联WPI产物的表面疏水性的影响Fig.4 Effect of ultrasound pretreatment on surface hydrophobicity of TGase-catalyzed WPI cross-linking product
2.4 超声处理与TGase交联对WPI产物凝胶保水性的影响
将WPI溶液超声处理后再进行TGase交联,得到的样品溶液在加热条件下形成凝胶,测定其凝胶保水性。由图5可以看出,随着超声处理时间的延长,TGase催化交联的WPI和未经TGase催化交联的WPI的凝胶保水性均呈一定程度的增加。未经TGase催化交联的WPI的凝胶保水性在超声处理20、30和40 min时没有显著差异(p>0.05),但与超声0 min的样品相比,超声处理20、30、40 min均能显著增加蛋白的凝胶保水性(p<0.05)。加入TGase后,TGase催化交联的WPI的凝胶保水性显著增加(p<0.05),且超声处理40 min后,交联的WPI的凝胶保水性较超声处理后未经TGase催化交联的WPI提高了约39.66%。超声处理40 min后,TGase交联产物凝胶保水性的增加可能是因为,交联反应的进行使蛋白质结构展开,暴露出了疏水性基团,且WPI经超声预处理后暴露出的疏水性基团的量更多(图4),导致蛋白质分子间非共价作用得到了增强,从而形成了更为致密的凝胶网络结构,且形成的凝胶网络具有更小的孔隙,可以集合更多的水,且能够更紧密结合,进而增加了凝胶的保水性[24-26]。
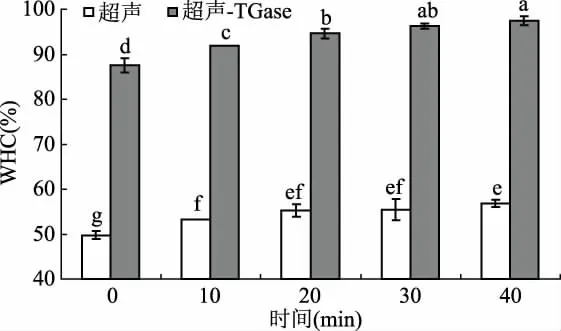
图5 超声处理对TGase交联WPI产物的凝胶持水性(WHC)的影响Fig.5 Effect of ultrasound pretreatment on gel water holding capacity of TGase-catalyzed WPI cross-linking product
3 结论
WPI经超声预处理后,随着超声时间的延长(0~40 min),TGase交联程度逐渐变大,生成的大分子聚合物逐渐增多;TGase催化交联的WPI产物具有较好的凝胶保水性,并且随着超声时间的延长,凝胶保水性逐渐提高,在超声30、40 min时,交联产物的凝胶保水性最高;WPI在超声处理后TGase酶交联能够使荧光强度增加,暴露出更多的疏水性基团,表面疏水性增大,且随着超声处理时间的延长,表面疏水性逐渐升高,在超声时间为40 min时,产物的表面疏水性最高,暴露出的疏水性氨基酸的量最大,更有利于形成均匀、致密的凝胶网络,提高WPI的凝胶保水性。

