高效提取3种不同类型植物叶片色素的方法
周武先,段媛媛,卢 超,2,艾伦强,2, 何银生,2,张美德,2
(1.湖北省农业科学院 中药材研究所,湖北恩施 445000; 2.湖北省农业科技创新中心 中药材研究分中心,湖北恩施 445000)
高等植物叶片色素的构成主要包括叶绿素和类胡萝卜素,叶绿素主要分为叶绿素a和叶绿素b,类胡萝卜素主要分为胡萝卜素和叶黄素。叶绿素是植物进行光合作用的重要成分,也是反映植物生理状况的重要指标[1]。王春明等[2]的研究结果显示,葡萄叶片叶绿素总质量分数的降幅与叶片病情指数呈显著正相关,表明葡萄叶片叶绿素总质量分数降幅可作为葡萄对霜霉病抗性鉴定的辅助指标。类胡萝卜素作为光合作用中的辅助色素,不仅参与光能的吸收和传递,还具有抗氧化[3]、抗癌[4]及抗辐射[5]的作用。因此,叶绿素和类胡萝卜素的提取及测定在相关科研工作和生产中尤为重要。提取植物组织中色素的主要有机溶剂包括氯仿、石油醚、丙酮、乙醇和二甲基亚砜等[6-8],通常使用丙酮和乙醇按一定比例混合或其水溶液提取植物色素[9-10]。目前丙酮提取法使用最广泛,最早于1941年由Mackinney[11]提出,1949年Arnon对此法进行解释和推导[12]。该法的产生革新了最早的叶绿素皂化测定法,操作相对简单,耗时大幅缩短。丙酮提取法主要是使用80%丙酮进行研磨,然后经过洗转、过滤和定容等步骤,过程较为复杂,且色素测定值偏低[13]。舒展等[13]将此法进行改进并提出叶绿素简化提取法,即将植物绿色组织剪碎后直接使用80%丙酮浸提。这一方法大大简化操作过程,节省植物材料和试剂的用量,但提取时间过长,一般需要24~72 h才能提取完全[14]。邱念伟等[14]发明DMSO-80%丙酮两步快速提取法,先用DMSO高温提取叶绿素,再用80%丙酮稀释浸提,可以有效减小测定误差,加快测定速度,将提取时间缩短至3 h。吴志旭等[15]改用热丙酮浸提叶绿素,使浸提时间缩短为1.5~2.5 h。即便如此,以上方法仍较为繁琐,提取时间较长或存在安全隐患,客观上难以做到避光操作,因而色素提取效率不高。
本研究综合以上测定方法的优缺点,旨在建立一种高效快速测定植物叶片色素的方法,简称液氮法,即使用液氮对植物叶片进行快速冷却,使用钢珠或研钵迅速粉碎植物叶片组织,再使用溶剂进行提取。该法对角质层薄、细胞排列松散的叶片组织色素提取可以做到完全避光,防止色素降解;对角质层较厚、细胞排列紧密的叶片,也可有效提高色素提取效率。使用该法筛选不同类型叶片色素提取的最佳溶剂、温度和时间及确定叶片与溶剂的最佳质量体积比,即可精确快速测定不同类型叶片组织中的色素含量。
1 材料与方法
1.1 材 料
中华蚊母树(Distyliumchinense(Fr.) Diels)、栀子树(GardeniajasminoidesEllis)和油麦菜(Lactucasativavarlongifoliaf. Lam)的叶片分别作为典型的角质层厚、细胞排列紧密(叶片硬厚),角质层中等、细胞排列较紧密(叶片较厚)和角质层薄、细胞排列松散(叶片软薄)的 3 种叶片类型,用于不同结构叶片的色素提取效率研究。中华蚊母树叶片采自华中药用植物园,栀子树叶片采自湖北省农业科学院中药材研究所,油麦菜叶片购自恩施市菜市场,均于2018年4月10日完成采摘或购买。选用颜色均一、去除叶脉的成熟叶片,使用前充分剪碎、混匀,每个处理设置3个重复。
1.2 方 法
1.2.1 叶片的横切面结构 采用卡宝品红染色法[16]观察 3 种不同类型叶片的横切面结构。将叶片洗净,吸水纸擦干,切薄片置于载玻片,滴适量卡宝品红染色液,染色3~5 min,盖上盖玻片,使用尼康生物显微镜(NIKON Eclipse E200)观察叶片横切面结构。
1.2.2 提取方式 分别采用液氮法、研磨法和浸提法3 种方式对3种不同类型叶片中的色素进行提取,筛选不同类型叶片色素的最佳提取方法。液氮法(MLN):称取0.1 g叶片(角质层薄、细胞排列松散)到装有钢珠的10 mL离心管中,倒入液氮,在液氮刚好挥发完时盖上离心管盖置于涡旋仪上涡旋,重复以上操作直至叶片充分粉碎,用锡箔纸裹住离心管,加入8 mL提取溶剂,4 ℃避光提取10 min;或称取0.1 g叶片(角质层较厚、细胞排列紧密)加入到事先预冷(4 ℃)的研钵中,倒入少许液氮进行充分研磨,使用8 mL提取溶剂分4次将研磨液转移至10 mL离心管中,4 ℃避光提取10 min;液氮法提取色素的过程中反复颠倒离心管3~5次。研磨法(MG):称取0.1 g叶片到研钵中,加入少许石英砂充分研磨,使用8 mL提取溶剂进行洗转,常温(25 ℃)下避光提取30 min。浸提法(ME):将叶片充分剪碎,称取0.1 g叶片到离心管中,加入8 mL提取溶剂,常温避光提取24 h。
1.2.3 提取溶剂 分别使用8种有机提取溶剂对不同类型植物叶片的色素进行提取。8种溶剂为A:φ=80%丙酮;B:φ=95%乙醇;C: 丙酮∶乙醇= 1∶1(体积比);D∶丙酮∶乙醇= 2∶1 (体积比);E: 丙酮∶乙醇= 1∶2 (体积比);F: 丙酮∶乙醇∶水= 6∶3∶1 (体积比);G: 丙酮∶乙醇∶水= 3∶6∶1(体积比);H: 丙酮∶乙醇∶水= 4.5∶4.5∶1(体积比)。称取0.1 g 3 种不同类型的植物叶片,统一采用液氮法对叶片进行处理,分别使用8种溶剂,4 ℃避光提取10 min后测定各色素质量分数。
1.2.4 环境因素 研究不同温度、光照条件及提取时间对不同类型植物叶片色素提取的影响。温度分别设置-20、4、25和37 ℃ 4 个梯度,光照度设置0、100、1 000 lx 3 个梯度,提取时间设置1、3、5、10、20、30、60 min 7 个梯度。溶剂统一使用φ=80%丙酮,分别提取3种不同类型叶片的色素。
1.2.5 质量体积比 为确定不同类型叶片色素提取过程中叶片质量与提取溶剂的最佳比例,按叶片质量(g)与溶剂体积(mL)分别为1/25、1/50、1/100、1/200、1/400设置,使用液氮法进行色素提取,在最佳提取溶剂、温度、光照条件及最适提取时间下探索不同类型叶片色素提取的最佳质量体积比。
1.3 叶绿素和类胡萝卜素的测定
赵先明等[9]和杨敏文[17]的研究结果显示,叶绿素在8 种不同溶剂中的光吸收特性类似,因此可使用Arnon公式计算叶绿素和类胡萝卜素的质量分数,均以鲜质量计。但研究表明,Arnon法在吸收波长和计算公式方面均有较大误差[14],为了提高效率和研究方便,本研究采用Wellburn等[18]于1984年修正的叶绿素和类胡萝卜素的质量分数计算公式。
1.4 数据处理
利用Excel 2007、SPSS 19.0进行数据处理和统计分析,使用origin 8.1作图。
2 结果与分析
2.1 3 种不同类型叶片的剖面结构
从图1可以看出,中华蚊母树的叶片角质层厚、细胞排列紧密(图1-A);栀子树的叶片角质层中等、细胞排列较紧密(图1-B);油麦菜叶片的角质层薄、细胞排列松散、无规则(图1-C)。

1.角质层 Cuticula;2.上表皮 Upper epidermis;3.叶肉组织 Mesophyll tissue;4.下表皮 Lower epidermis
2.2 最佳提取方式
由表1可知,液氮法提取的中华蚊母树叶片中的叶绿素a质量分数显著高于其他提取方法(P<0.05),达到0.55 mg·g-1,总叶绿素和类胡萝卜素的质量分数相比于浸提法分别高出100.0%和212.5%,但与研磨法差异不显著(P>0.05)。使用 3 种不同提取方式提取的栀子树叶片各色素质量分数存在显著性差异(P<0.05),液氮法的提取效率最高,叶绿素a、叶绿素b及类胡萝卜素的质量分数相比于研磨法和浸提法分别高出32.9%、58.6%、27.9%和109.6%、411.1%、129.2%。油麦菜叶片中的色素以液氮法提取效果最好,但几种提取方式提取的叶绿素a、叶绿素b及类胡萝卜素质量分数无显著性差异。

表1 不同提取方式下中华蚊母树、栀子树以及油麦菜叶片色素的质量分数Table 1 Effects of different extraction methods on extraction efficiency of extracting pigments from leaves of Distylium chinense, Gardenia and lettuce
注:每种叶片类型的结果显著性差异单独分析;同列不同小写字母表示不同处理差异显著(P<0.05);下同。
Note: Results of leaves of each type are analyzed separately, different lowercase letters in same column indicate significant difference among various treatments(P<0.05); the same below.
2.3 最佳提取溶剂
如图2,中华蚊母树叶片的最佳提取溶剂为丙酮∶乙醇:水= 4.5∶4.5∶1的混合溶液(图2-A),叶绿素a、叶绿素b和类胡萝卜素的质量分数分别为0.55、0.17 和0.21 mg·g-1,提取效果显著高于φ=80%丙酮、φ=95%乙醇及丙酮∶乙醇∶水= 6∶3∶1的混合溶液。栀子树叶片以丙酮∶乙醇∶水= 4.5∶4.5∶1的混合溶液浸提效果最好(图2-B),叶绿素a、叶绿素b及类胡萝卜素的质量分数分别为1.20、0.30 和0.43 mg·g-1,提取效果与φ=95%乙醇及丙酮∶乙醇= 1∶1的混合溶液差异不显著(P>0.05),但显著高于其他提取溶剂。油麦菜叶片色素的最佳提取溶剂为φ=95% 乙醇(图2-C),叶绿素a、叶绿素b和类胡萝卜素的质量分数分别为1.58、0.48 和0.65 mg·g-1,以丙酮∶乙醇∶水=4.5∶4.5∶1的混合溶液提取效果最差,叶绿素a、叶绿素b和类胡萝卜素的质量分数分别为1.31、0.30和0.50 mg·g-1,色素提取效率显著低于φ=95%乙醇溶液(P<0.05)。
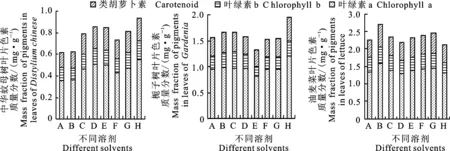
图2 不同溶剂对中华蚊母树、栀子树以及油麦菜叶片色素提取效率的影响Fig.2 Effects of different extraction solvents on efficiency of extracting pigments from leaves of Distylium chinense, Gardenia and lettuce
2.4 最佳提取温度、时间及光照条件
表2显示, 3 种不同类型叶片色素的最佳提取温度均为4 ℃。当温度为-20~4 ℃时,随着温度升高,色素提取效率逐渐增加;当温度为4~37 ℃时,随着温度升高,色素提取效率逐渐降低,说明温度过低或过高都会影响叶片中各色素的溶出效率。
从表3可得,随着光照强度的增加, 3 种不同类型叶片中的色素提取量逐渐降低。黑暗条件下各色素的提取效果最好,叶绿素a和类胡萝卜素质量分数显著高于1 000 lx光照度处理(P<0.05),不同光照度处理下叶绿素b的提取效率差异不显著(P>0.05)。

表2 不同温度下中华蚊母树、栀子树及油麦菜叶片色素的质量分数Table 2 Effects of different extraction temperatures on efficiency of extracting pigments from leaves of Distylium chinense, Gardenia and lettuce
从图3可以看出,随着浸提时间的延长,不同类型叶片中各色素的提取量逐渐增加。中华蚊母树叶片和栀子树叶片研磨提取10 min后色素提取量达到最大,随后基本保持不变;油麦菜叶片浸提5 min后提取量达到最大,叶绿素a、叶绿素b和类胡萝卜素的质量分数分别为1.25、0.40和 0.57 mg·g-1,浸提时间超过5 min后,各色素提取量基本保持不变。

表3 不同光照度下中华蚊母树、栀子树以及油麦菜叶片色素的质量分数Table 3 Effects of different extraction light intensities on efficiency of extracting pigments from leaves of Distylium chinense,Gardenia and lettuce
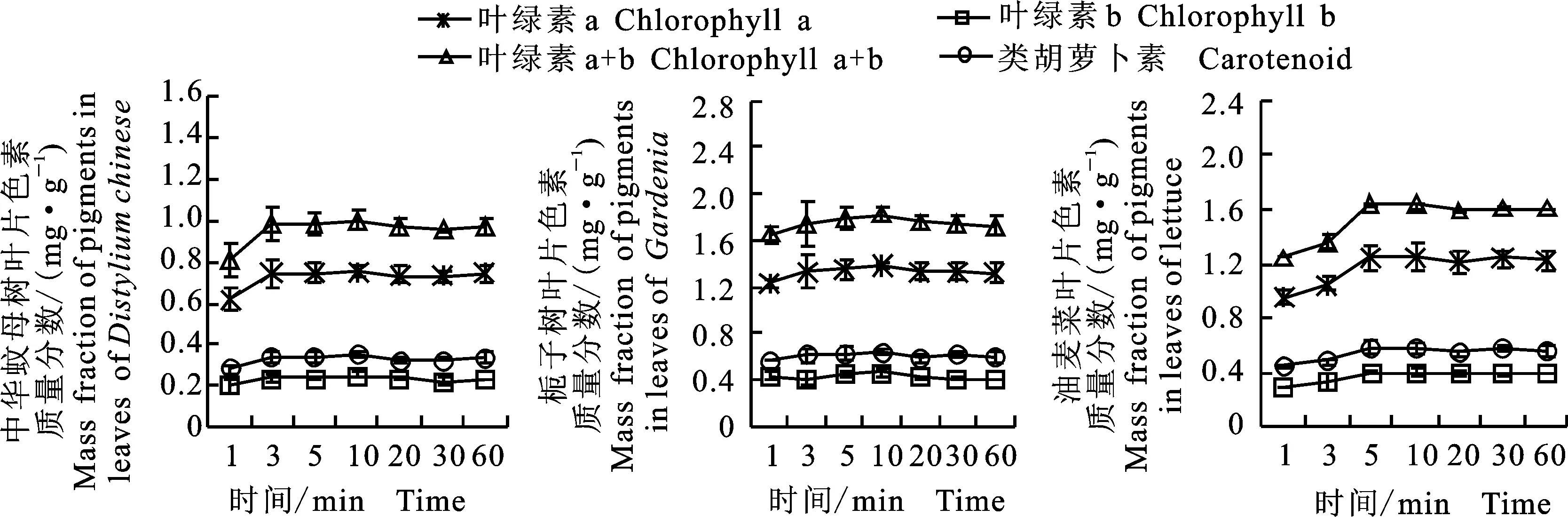
图3 不同浸提时间对中华蚊母树、栀子树以及油麦菜叶片色素提取效率的影响Fig.3 Effects of different extraction time on efficiency of extracting pigments from leaves of Distylium chinense,Gardenia and lettuce
2.5 最佳质量体积比
从图4可以看出,3 种不同类型的叶片质量与提取溶剂的比例为1∶100时,叶片中的各色素提取量最大。当叶片与溶剂的质量体积比大于1∶100时,各色素的提取量随质量体积比减小而增加;而当叶片与溶剂质量体积比小于1∶100时,色素的提取量随质量体积比减小而减小,并在1∶400时最低。叶片与溶剂的质量体积比为1∶200~1∶50时各色素提取量无显著性差异(P>0.05),是浸提 3 种不同类型叶片色素较为理想的范围。
3 讨 论
本研究中3种不同类型叶片的横切面结构显示,中华蚊母树叶片的角质层最厚,且细胞排列紧密;栀子树叶片的角质层厚度次之,细胞排列较紧密;油麦菜叶片的角质层最薄,细胞排列松散、无规则;因此以上 3 种植物叶片可作为色素提取效率研究的良好材料。
植物组织中色素的提取方式不同,色素的提取效果也不一样[9, 19]。本研究中 3 种不同类型的叶片色素提取效率均以液氮法最佳。推测原因如下:叶片的形态、温度及光照条件均会不同程度影响叶片色素的提取或降解。叶片使用液氮处理后,易于充分粉碎并缩短色素提取操作时长,减少曝光时间,降低色素的降解速度;同时,液氮可瞬间凝结叶片,降低叶片温度,防止因温度过高造成色素降解。不同叶片类型使用同一提取方式的效果不同。本研究中角质层厚的蚊母树叶片和栀子树叶片使用研磨法提取的效率高于浸提法,这可能与蚊母树和栀子树叶片角质层厚、细胞排列致密且表层具有较厚的蜡质层而导致浸提过程中色素无法充分溶出有关。油麦菜叶片因角质层薄、细胞排列松散,色素提取溶剂易于渗入叶片细胞,色素溶出率高,同时使用浸提法可避免研磨法操作过程中因光照和洗转造成色素损失,因而油麦菜叶片使用浸提法提取色素的效率高于研磨法。

图4 叶片与溶剂的质量体积比对中华蚊母树、栀子树及油麦菜叶片色素提取效率的影响Fig.4 Effects of different mass/volume ratios of leaves to solvents on efficiency of extracting pigments from leaves of Distylium chinense, Gardenia and lettuce
本研究中中华蚊母树叶片和栀子树叶片的最佳提取溶剂均为丙酮∶乙醇∶水= 4.5∶4.5∶1的混合溶剂,这与张秀君等[19]和李得孝等[20]关于菠菜和玉米的色素提取研究结果类似,最佳提取溶剂均为混合溶剂,说明丙酮∶乙醇∶水= 4.5∶4.5∶1的混合溶剂对中华蚊母树和栀子树叶片色素的协同萃取效果较好。而油麦菜叶片中的色素以φ=95%乙醇提取效果最好,丙酮∶乙醇∶水= 4.5∶4.5∶1混合溶剂的色素提取效果最差,说明油麦菜叶片色素在φ=95%乙醇中的溶出率较高,混合溶剂对油麦菜叶片色素的协同萃取效果较差,这可能与植物叶片细胞的构造差异有关。 3 种不同类型叶片色素提取效率从高到低的溶剂排序分别为:(1) 中华蚊母树,丙酮∶乙醇∶水(4.5∶4.5∶1)>丙酮∶乙醇( 2∶1)>丙酮∶乙醇(1∶2)>丙酮∶乙醇∶水(3∶6∶1)>丙酮∶乙醇(1∶1)>丙酮∶乙醇∶水(6∶3∶1)>φ=95%乙醇>φ=80%丙酮;(2) 栀子树,丙酮∶乙醇∶水(4.5∶4.5∶1)>φ=95%乙醇>丙酮∶乙醇(1∶1)>丙酮∶乙醇= 2∶1>丙酮∶乙醇∶水(6∶3∶1)>丙酮∶乙醇∶水(3∶6∶1)>φ=80%丙酮>丙酮∶乙醇(1∶2);(3) 油麦菜,φ=95%乙醇>丙酮∶乙醇(2∶1)>丙酮∶乙醇(1∶1)>丙酮∶乙醇∶水(3∶6∶1)>丙酮∶乙醇∶水(6∶3∶1)>丙酮∶乙醇(1∶2)>丙酮∶乙醇∶水(4.5∶4.5∶1)>φ=80%丙酮。从中可得,中华蚊母树和栀子树叶片色素以丙酮∶乙醇∶水= 4.5∶4.5∶1混合溶剂的提取效果最佳,而油麦菜叶片色素以丙酮∶乙醇∶水= 4.5∶4.5∶1的混合溶剂提取效果最差,说明同一溶剂对不同类型叶片中的色素提取效果不同;另外可看出,φ=80%丙酮对不同类型叶片色素的提取效果均较差,因此在科研工作或工业生产中要求精确测定植物色素时应避免使用。
在提取植物组织中的色素时,提取温度、时间和叶片与溶剂的质量体积比都会影响色素的提取效果[9]。中华蚊母树叶片和栀子树叶片色素的最佳提取温度、时间和叶片与溶剂的质量体积比分别为4 ℃、10 min和1/100;油麦菜叶片色素的最佳提取温度、时间和叶片与溶剂的质量体积比分别为4 ℃、5 min和1/100。小于或超过最佳条件均会不同程度影响色素的提取效果,这与张秀君等[19]的研究结果相似。说明植物叶片色素的溶出效率和降解速度与提取温度、时间及叶片与溶剂的质量体积比有关;油麦菜叶片色素的提取时长比中华蚊母树和栀子树叶片更短,说明色素的溶出效率与植物叶片的结构有关,角质层薄、细胞排列松散的叶片比角质层厚、细胞排列紧密的叶片色素溶出速度快。此外,光照会引起色素的快速降解,光照强度越大,色素降解速度越快,因此提取色素的过程中应尽量避免光照。
本研究采用中华蚊母树、栀子树及油麦菜的叶片作为 3 种不同类型的叶片代表,用于探索高效快速提取植物叶片色素的最佳方式,发现不同类型叶片色素的提取均以液氮法提取效率最高,且整个测定过程时间最短。对于角质层薄、细胞排列松散的植物叶片,色素的提取过程可完全避免光照,防止色素降解,增加色素的提取效率,同时大幅缩短提取时间。以油麦菜叶片为例,色素提取完全仅需5 min。对于角质层较厚、细胞排列紧密的植物叶片,液氮气化过程能瞬间凝结叶片并降低叶片组织的温度,有利于提高研磨效率并使研磨更加充分,同时研磨过程保持在较低温度下进行,可以有效防止色素降解,以中华蚊母树和栀子树叶片为例,整个色素提取过程不超过10 min。相比以往的色素提取研究,该法提取过程操作简单、耗时短、效率高、测定结果稳定,可用于科研工作和工业生产中对植物叶片色素的快速提取与精确测定。

