三七总皂苷对转化生长因子—诱导人胚肺成纤维细胞增殖分化及胶原蛋白合成的影响
耿德海 ,郭文龙 ,王 强 ,刘志勇 ,薛 娟 ,孙晓芳 ,谷 雨 ,刘未华 ,段 斐
(1.河北省保定市第二医院,河北 保定 071051; 2.河北省保定市涞水县医院,河北 保定 074100;3.河北省保定市法医医院,河北 保定 071000; 4.河北大学医学院,河北 保定 071000)
肺纤维化是多种慢性肺疾病的共同结局,其发病机制至今不明。有研究发现,肺纤维化后期主要表现为正常肺组织逐渐被增殖分化的成纤维细胞和过度聚集的胶原蛋白等细胞外基质替代[1]。因此,肺成纤维细胞的增殖在肺纤维化的发生过程中起重要作用,而由其分泌的Ⅰ型胶原蛋白和Ⅲ型胶原蛋白是细胞外基质的主要结构蛋白,其含量的变化和比例的改变是肺纤维化的主要病理学基础。三七总皂苷是三七主要有效药用成分,具有活血祛瘀、通脉活络等功效,并能抗肿瘤、抗纤维化、抑制血小板聚集和增加脑血流量等[2]。本课题组前期研究发现,三七总皂苷对肺上皮细胞的凋亡,肺纤维化状态的氧化应激反应,以及肺组织中基质金属蛋白酶(MMPs)的表达均有抑制作用,说明三七总皂苷有预防肺纤维化的作用[3-6]。本研究中通过体外培养人胚肺成纤维细胞MRC-5,研究三七总皂苷对MRC-5的增殖分化及胶原蛋白表达的影响,以探讨三七总皂苷阻断肺纤维化进程的体外细胞分子机制。
1 材料与方法
1.1 仪器与试药
仪器:日产超净工作台(日本 Airtech公司);HF90型CO2培养箱(香港力康生物医疗科技有限公司);CKX41型倒置显微镜(日本Olympus公司);ZHWY-10X型恒温水浴箱(上海申安医疗器械厂);BIORAD680型酶标仪(伯乐生命医学产品有限公司)。
试药:人胚肺成纤维细胞系(北京协和细胞资源中心,细胞株编号为MRC-5);DMEM/EBSS细胞培养基(美国Gibco公司);NEAA培养基(北京协和细胞资源中心);胎牛血清(浙江天杭生物科技有限公司);三七总皂苷注射液(昆明制药集团股份有限公司,批号为20150313,规格为每支 5 mL ∶250 mg);二甲基亚砜、四氮唑(MTT)均由美国Sigma公司提供;胰蛋白酶(美国Amresco公司);即用型免疫组化试剂盒、辣根过氧化物酶显色(DBA)液均由武汉博士德生物工程有限公司提供。
1.2 方法
细胞分组及给药:将体外培养的人胚肺成纤维细胞MRC-5分为4组:正常对照组,不做处理;模型组,加入转化生长因子-β(TGF-β,质量浓度为1ng/mL);阳性药物对照组(地塞米松组),加入TGF-β(质量浓度为1 ng/mL)+地塞米松(质量浓度为 0.05 g/L);三七总皂苷组,加入TGF-β(质量浓度为 1 ng/mL)+三七总皂苷(质量浓度为1 g/L)。将细胞接种于96孔板,每组各5个复孔。加药后充分混匀,孵育24 h。
MTT比色法检测细胞增殖情况:MRC-5培养24 h后,各组加入相应药物干预,分别孵育24 h和72 h后,采用MTT比色法检测。于试验前4 h取出96孔板,避光条件下加入质量浓度为5g/L的MTT20 μL,放入培养箱,孵育4 h,弃去上清液,每孔加入二甲基亚砜150 mL,振荡混匀10 min后放入酶标仪,读取490 nm波长下各孔光密度(OD)值,计算各组细胞生长抑制率。
免疫细胞化学法检测细胞各指标表达情况:将细胞浓度调整到约为 1×105个/mL,37℃ 培养 24 h。各组加入相应药物,正常对照组加入等量培养基,共孵育72 h。取出后弃去培养基,用磷酸盐缓冲液(PBS)冲洗3遍,每孔加入冷丙酮2 mL,放入4℃固定10 min,弃去丙酮,取出细胞爬片,染色,脱水,封片,采用免疫细胞化学检测(SP)法检测各组α-平滑肌肌动蛋白(α-SMA)和胶原蛋白表达情况,按试剂盒说明书进行操作,显微镜下观察细胞染色情况;采用Image pro-plus图像分析系统,每张爬片选取5个不同视野检测,计算各组累积光密度值(IOD),以此为蛋白表达水平。
1.3 统计学处理
2 结果
2.1 对细胞增殖的影响
与正常对照组比较,模型组MRC-5 24 h和72 h后增殖明显;地塞米松组和三七总皂苷组成纤维增殖显著受到抑制,且抑制程度随干预时间的延长而增强,但组间无显著差异。详见表1。
表1 三七总皂苷对MRC-5增殖比的影响(s,n=5)

表1 三七总皂苷对MRC-5增殖比的影响(s,n=5)
注:与正常对照组比较,#P< 0.05;与模型组比较,P <0.05。表 2 同。
组别正常对照组模型组地塞米松组三七总皂苷组24 h 0.282 ± 0.025 0.366 ± 0.036#0.314 ± 0.005 0.305 ± 0.101 72 h 0.367 ± 0.176 0.436 ± 0.028#0.358 ± 0.012 0.356 ± 0.009
2.2 对细胞 -SMA蛋白表达水平的影响
模型组有大量棕褐色着色细胞表达;与模型组相比,地塞米松组和三七总皂苷组棕褐色细胞显著减少;与正常对照组比较,模型组α-SMA蛋白表达水平升高(P<0.05);与模型组比较,地塞米松组和三七总皂苷组 α-SMA蛋白表达水平显著降低(P<0.05)。详见图1和表2。
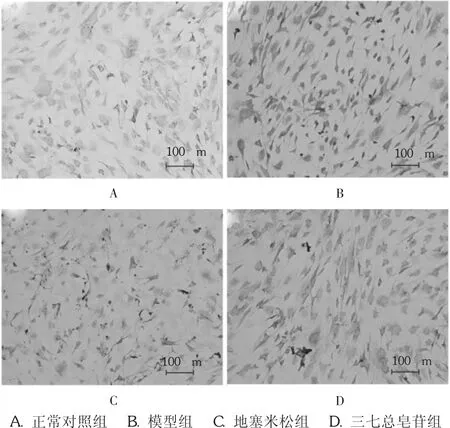
图1 三七总皂苷对MRC-5细胞 -SMA蛋白表达的影响(SP,× 200)
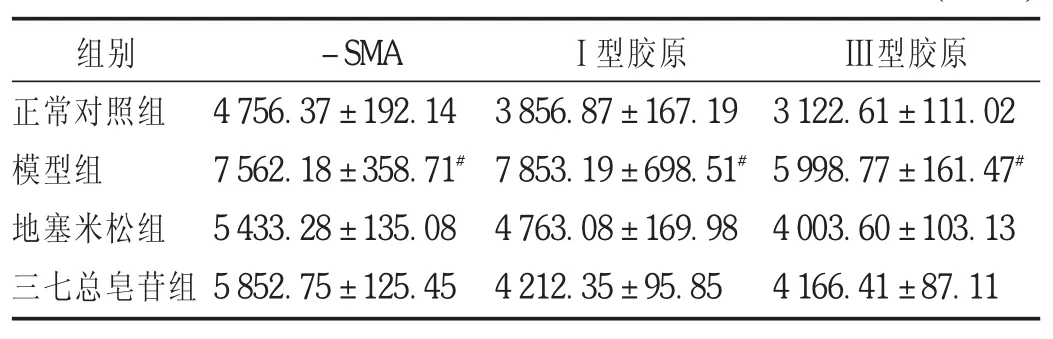
表2 三七总皂苷对肺成纤维细胞相关蛋白表达水平的影响(n=5)
2.3 对Ⅰ型及Ⅲ型胶原蛋白的影响
与正常对照组比较,模型组黄褐色细胞数量明显增多,显示细胞蛋白表达量较正常对照组显著增加;与模型组比较,地塞米松组和三七总皂苷组黄褐色细胞数量明显减少,显示其Ⅰ型、Ⅲ型胶原蛋白表达量较模型组显著降低,地塞米松组和三七总皂苷组比较无显著差异。详见图2、图3及表2。

图2 三七总皂苷对MRC-5细胞Ⅰ型胶原蛋白表达量的影响(SP,× 100)

图3 三七总皂苷对各组MRC-5细胞Ⅲ型胶原蛋白表达量的影响(SP,×100)
3 讨论
肺纤维化是以弥漫性肺间质改变为主要特征的肺疾病,其主要病理变化为成纤维细胞增殖分化和细胞外基质产生增多。肺成纤维细胞是产生细胞外基质的最主要细胞,其过度增殖分化是导致肺胶原蛋白合成增多和异常沉积的主要原因[7]。因此,通过抑制肺成纤维细胞增殖分化和细胞外基质的合成对于防治特发性肺间质纤维化有重要意义。本研究结果显示,三七总皂苷可抑制肺成纤维细胞的增殖分化,并减少其胶原蛋白的合成。
研究发现,肺成纤维细胞增殖分化为表达α-SMA的肌成纤维细胞是合成细胞外基质的主要细胞[8]。肌成纤维细胞由成纤维细胞分化而来,特征性表达α-SMA,具有更强的促肺纤维化作用。这种增殖分化受多种调控因子的影响,其中,TGF-β是最重要的促进因子,也是促肺纤维化的重要因子,可促进肺成纤维细胞的增殖,并促进其分化为肌成纤维细胞[9]。肌成纤维细胞可产生大量细胞外基质,如α-SMA,Ⅰ型、Ⅲ型胶原蛋白等,导致细胞重塑,进而促进TGF-β诱导肺成纤维细胞活化为肌成纤维细胞,从而放大纤维化的级联反应[10]。因此,抑制肺成纤维细胞的增殖分化对于肺纤维化的防治具有重要意义。
胶原蛋白是肺纤维化细胞外基质的主要成分,胶原蛋白的分解减少和合成增加是导致肺纤维化胶原蛋白异常沉积的重要原因[11]。而这种异常又以Ⅰ型、Ⅲ型胶原蛋白代谢异常为主。在肺纤维化的早期、晚期分别主要以Ⅰ型、Ⅲ型胶原蛋白增加为主[12]。因此,通过药物抑制此两种胶原蛋白的表达将有助于肺纤维化的治疗。
多项以肺纤维化模型大鼠为对象的研究发现,三七总皂苷具有抑制TGF-β合成与分泌的作用,对肺纤维化模型大鼠有显著抗纤维化作用[13]。此外,三七总皂苷对肝纤维化、肾纤维化及腹膜纤维化等均有抑制作用[14-16]。本研究结果显示,TGF-β可显著促进肺成纤维细胞的增殖,并使其α-SMA受体表达增强,表明TGF-β可促进肺纤维细胞向肌成纤维细胞转化,促进肺纤维化的发展。经过三七总皂苷干预后,细胞增殖受到抑制,同时α-SMA蛋白表达水平亦有下降趋势,表明三七总皂苷可显著抑制肺成纤维细胞的增殖和分化,可能是其治疗肺纤维化的机制之一。
通过对肺成纤维细胞Ⅰ型、Ⅲ 型胶原蛋白纤维表达的研究发现,TGF-β可显著增加胶原蛋白的表达量,三七总皂苷对肺纤维细胞的Ⅰ型、Ⅲ型胶原蛋白表达量有显著抑制作用,可降低细胞外基质沉积,从而防止肺纤维化产生。
综上所述,三七总皂苷能抑制肺成纤维细胞的增殖及向肌成纤维细胞的转化,抑制Ⅰ型、Ⅲ型胶原蛋白合成,这些作用可能是其防治肺间质纤维化的机制。

