C/EBPα 和 C/EBPβ抑制PHLPP的表达影响细胞增殖*
王亚棋,黎 隽,刘立科,刘东鸣,韩 溟,李剑利
1. 陕西省医疗器械质量监督检验院(西安 712046);2. 西北大学 化学与材料科学学院(西安 710127)
PHLPP是一类新型的Ser/Thr蛋白磷酸酶,在胃癌、结肠癌、胰腺癌和乳腺癌等组织中表达缺失,是一种肿瘤抑制剂[1-2],对细胞增殖和肿瘤发生具有抑制作用。细胞的蛋白激酶C(PKC) 水平受到磷酸酶PHLPP控制,多种磷酸化和去磷酸化步骤控制蛋白激酶C的生命周期,通过使AKT疏水基去磷酸化可终止其信号[3]。PHLPP与AKT的开关保护蛋白激酶C信号作用。AKT的一个“车闸”保护蛋白激酶C(PKC)信号由Ser/Thr特异的磷酸酶PHLPP提供[4]。在多种肿瘤中,也有其他蛋白调控PHLPP的表达[5]。
碱性亮氨酸拉链(basic leucine zipper,bZIP) 转录因子C/EBP对调控细胞分化、增殖和组织生长的胞外信号有作用[6],许多疾病中C/EBP发生了改变。肝炎中C/EBPα 和C/EBPβ发生了上调[7],缺氧气和葡萄糖时,星形胶质细胞的C/EBP同源蛋白(C/EBP homologous protein,CHOP)基因迅速大幅增加。研究[8]表明,C/EBPβ蛋白在甲状腺机能减退的小脑皮层中明显减少。
研究[1]表明,AKT、mst1、PHLPP呈互抑制三角关系。PHLPP通过去磷酸化激活Mst1,也可能通过Akt间接激活Mst1,导致Akt活性下降和Mst1活性增强。对多种种属的PHLPP中启动子序列分析发现,均含有C/EBP的结合位点,PHLPP与C/EBP的表达可能存在一定相关性。
1 材料与方法
1.1 构建质粒
采用Primer3软件设计引物(表1),PCR后克隆到pcDNA3.0-flag-HA载体中,得到CEBP的质粒。

表1 C/EBP质粒的引物序列
1.2 检测启动子活性
将各种不同的 PHLPP启动子片断克隆到pGL3-basic中,PCR的引物由Primer3软件设计(表2)。Xho1-PH-P+C/EBP-F是指同时含有PHLPP和C/EBP结构的序列; Xho1-PH-P-F是指只含有PHLPP结构的序列。准备好pGL3-basic和renila luciferase control vector后,用双荧光素酶报告法试剂盒试剂按说明进行实验。
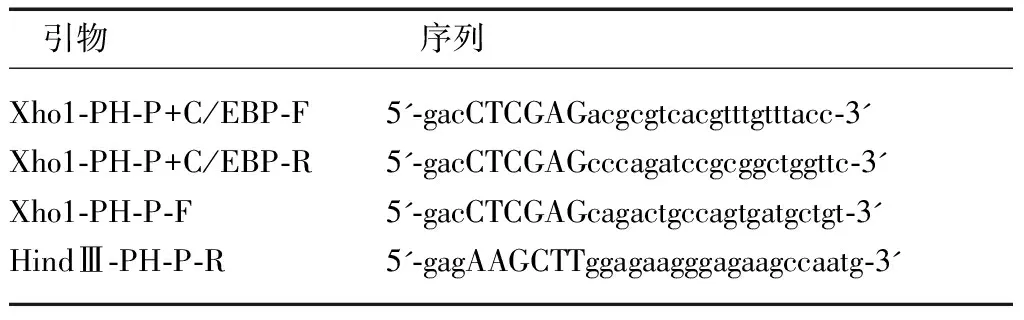
表2 含有PHLPP和C/EBP结构的引物序列
1.3 染色质免疫共沉淀实验
用10 cm 盘培养细胞。取长满的目标Hela细胞(1×107)3盘和293T 细胞5盘,通过交联、终止交联、收细胞、超声、检测超声效果、加结合C/EBP抗体的磁珠、洗磁珠、去交联、沉淀DNA 、Real-Time PCR等步骤完成染色质免疫共沉淀技术(chromatin immunoprecipitation assay,ChIP)。PHLPP启动子的引物由Primer3软件设计(表3)
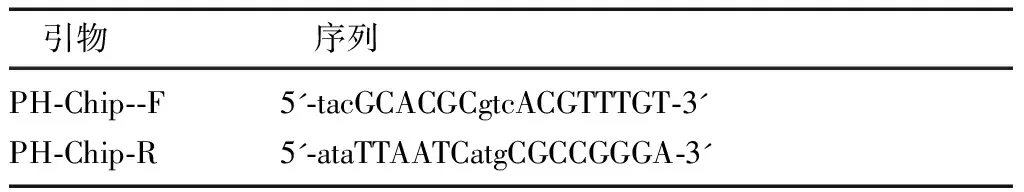
表3 用于real-time PCR 扩增的引物序列
1.4 免疫组织化学
免疫组织化学(IHC)用组织芯片购于美国 Biomax公司。经过56 ℃烤片过夜、梯度水化、热抗原修复、灭活内源性酶、抗原封闭、一抗(PHLPP1,1∶250, Cayman Chemical; C/EBPα和C/EBPβ,Cell Signaling Technology)、二抗(peroxidase-labeled secondary antibody,Vectastain Elite ABC Kit PK-7200)、DAB显色、封片等步骤完成。阴性对照不用一抗。
1.5 RT-PCR
各种样品用Trizol 试剂(Invitrogen, Grand Island, NY)抽取RNA后用iScript cDNA Synthesis Kit (Bio-Rad, Hercules, CA)反转录为cDNA,再根据反应试剂说明在25 μL SYBR green反应体系进行实验(伯乐iQ5型实时定量PCR仪)。实验结果用iQ5 system (Bio-Rad)分析。所用引物由Primer3软件设计(表4)。

表4 用于RT-PCR检测的引物序列
1.6 构建慢病毒抑制用质粒
用下面的引物合成不同的oligos,再克隆到PLKO.1的载体中,依据www.eddgene.com网上提供的Addgene's pLKO.1 protocol方法进行相关实验(表5)。

表5 用于慢病毒质粒构建的引物序列
1.7 蛋白免疫印迹实验
用冷的PBS洗细胞2遍后,用中性RIPA 缓冲液(150 mM NaCl,50 mM Tris-base (pH 7.4), 1% NP40, 1 mM EDTA,1 mM sodium orthovanadate,0.25% deoxycholate, 25 μg/mL leupeptin, 1 mM phenylmethysulfonyl fluoride裂解。热变性后的蛋白取50 μg进行SDS-PAGE电泳。转到PVDF膜上,用TBST缓冲液50 mM Tris-base (pH 7.4),0.1% Tween 20,150 mM NaCl 1 h封闭(含5%脱脂奶粉)后,4 ℃一抗孵育过夜,在含3%牛血清白蛋白的TBS中溶解一抗。用TBST缓冲液洗膜3次,带过氧化物酶的鼠抗或兔抗的二抗孵育。最后用购自奥地利Pierce 生物技术公司的化学发光试剂盒按说明在LAS 3000化学发光仪中检测免疫反应结果。
镇静组患者低血压和低血氧的发生率高,牵拉痛和牵拉引起的恶心、呕吐发生率低,差异有统计学意义(P均<0.05,表3)。
2 结果
2.1 PHLPP的启动子序列分析
运用 Transfac database分析猪、狗、人、猕猴、老鼠、黑猩猩等8种种属的PHLPP启动子序列,在这些启动子的核酸序列中均发现有C/EBPα、C/EBPβ及SP1的结合位点(图 1)。转录因子结合位点通过Transfac database数据库预测。这些PHLPP启动子上均包含C/EBPα、C/EBPβ及SP1 的结合位点。

图1 不同种属的PHLPP启动子序列比对
2.2 C/EBP对PHLPP活性的影响
结合CEBP和SP1的位点,根据图1中PHLPP的启动子序列,构建3种PHLPP启动子的质粒。分别是pGL3-basic-promoter-PH-C/EBP(不含有C/EBP,只有SP1结合位点), pGL3-basic-promoter-PH+C/EBP (只含有C/EBP和SP1结合位点) 和全长的pGL3-basic-promoter。将质粒pcDNA3.0-flag-HA-C/EBP与pGL3-基本启动子的PHLPP启动子质粒,以及PRL质粒和对照共同转入293T细胞,用双荧光素酶试剂盒按说明方法对各启动子的活性进行测量。结果显示,有C/EBPα和C/EBPβ转入的细胞,其启动子活性明显降低 (图2)。设计全长的pGL3基本启动子,是为了研究整个PHLPP启动子与所有C/EBP的结合作用情况。合成的pGL3-basic-promoter-PH+C/EBP这种质粒,其紧靠C/EBP 结合位点的起始点,排除了别的序列的影响(图1中的第1个紫色箭头)。不含有C/EBP,只有SP1结合位点pGL3-basic-promoter-PH-C/EBP质粒,排除了SP1的可能影响(图1中第2个紫色箭头)。
用293T细胞实验(图2),抑制效果由C/EBP和含有C/EBP结合位点的启动子共同形成。只要PHLPP 启动子上有C/EBP结合位点的,启动子的活性随pcDNA3.0-flag-HA-C/EBPα的转入均受到抑制。抑制效果随pcDNA3.0-flag-HA-C/EBPα质粒转入量的增加而增强。没有C/EBP结合位点的PHLPP启动子,共转入C/EBPα质粒,不管转入量多少,作用效果没有明显改变。24孔盘中每孔转入横坐标数值指的质粒质量的微克数。同时,每孔转入0.25 μg pGL3基本启动子、0.063 μg PRL质粒,和一定量的pcDNA3.0-flag-HA空质粒,使每孔转入的质粒总质量达到1 μg。纵坐标的比值代表启动子的活性,是用双荧光素酶法测得。Full promoter-PH是代表全长的PHLPP启动子序列;promoter-PH+C/EBP代表含有SP1和C/EBP结合位点的PHLPP启动子序列,去除了序列中C/EBPα和C/EBPβ结合位点前面的其他部分;promoter-PH-C/EBP代表只含有SP1结合位点,去除了序列中所有C/EBP结合位点部分。
2.3 SP1对PHLPP启动子活性的影响
虽然PHLPP启动子序列上含有SP1的结合位点, 可能会影响PHLPP的活性,但C/EBPα和C/EBPβ与PHLPP启动子的共转染实验表明, 随着SP1的转入,PHLPP启动子的活性没有明显改变(图2~3),是C/EBPα或C/EBPβ结合在PHLPP启动子上,而非SP1,抑制其转录活性。
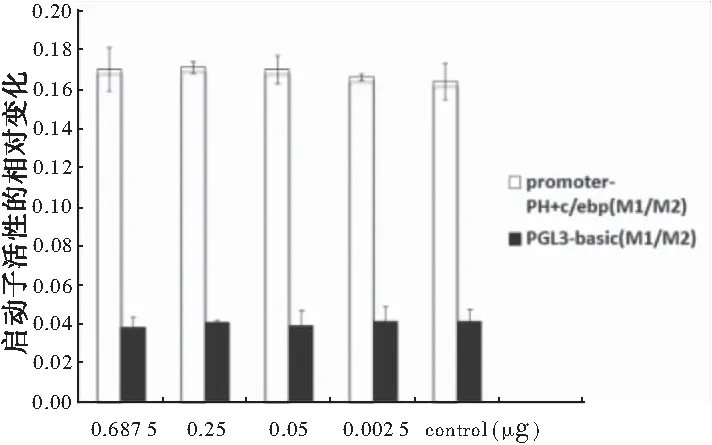
图3 转入SP1不影响PHLPP启动子的活性
2.4 C/EBP与PHLPP启动子在体内的结合
超声裂解集长满的肝癌细胞QSG-7701和QGY-7703(6盘10 cm2盘)。分别用200 μL裂解液提取其DNA基因组。测量浓度,使实验细胞都含有相同量的DNA基因组。并为RT-PCR留取足够的对照。再均分3份各含等量DNA的细胞液,用C/EBPα抗体(santa cruz sc-61)和C/EBPβ抗体(santa cruz sc-7962),还有protein A/G 琼脂糖磁珠对照(santa cruz sc-2003)做ChIP实验。RT-PCR检测结果,与对照比较C/EBPα或C/EBPβ抗体都结合了PHLPP启动子。不仅如此,肝癌细胞QSG-7701和肝癌细胞QGY-7703相比,PHLPP启动子与C/EBPα结合的量有所增加,在细胞内,PHLPP启动子与C/EBPα或C/EBPβ相互作用,随着肿瘤恶性程度的增加, 加强了C/EBPα与PHLPP启动子的结合,更多的抑制PHLPP表达,进一步增强细胞增殖(图 4 )。实验通过pcDNA3.0-SP1与PHLPP或者PGL3-basic vector空质粒载体共转染huh7 细胞获取。标准偏差取自5次独立实验的结果数据。蛋白质-染色质相互作用的CHIP实验用肝癌细胞QSG-7701 和 QGY-7703为载体。标准偏差取自5次独立实验的结果数据。
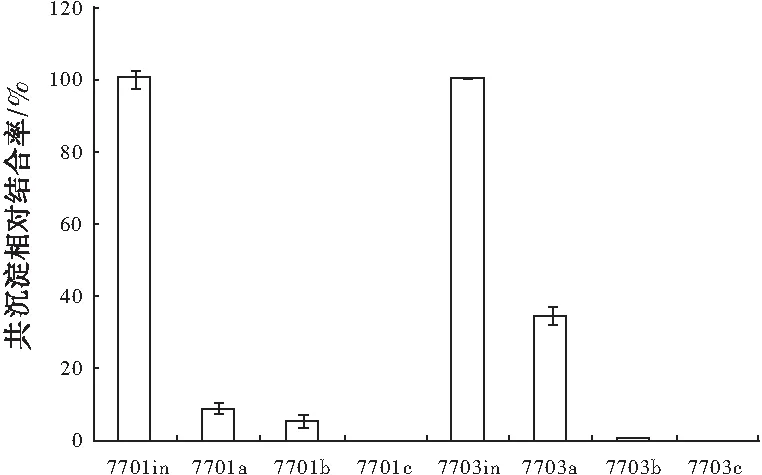
图4 C/EBPα 和 C/EBPβ 与 PHLPP的启动子有结合
2.5 PHLPP的mRNA表达水平与C/EBP的关系
取系列的肝癌、乳腺癌和胃癌细胞,将C/EBP转染到过表达后,用RT-PCR试剂盒检测PHLPP的 mRNA表达水平。随CEBP的转入,PHLPP在细胞中的表达水平有明显抑制,按肿瘤恶性程度比较,越偏正常的细胞,有越明显的抑制效果(图5)。标准偏差取自5次独立实验的结果数据。在恶性程度高的肿瘤细胞中,PHLPP的表达量会相对偏低,本身受抑制的空间有限,受CEBP的影响更小。肝癌细胞7701和胃癌细胞ges-1是恶性程度偏低的细胞,与其他恶性程度更高的细胞相比,PHLPP的表达量明显偏高。另一方面,在QSG-7701、huh7 和hepg2等肝癌细胞中,用慢病毒载体抑制C/EBP表达后,C/EBP的表达量下降, C/EBPα或C/EBPβ与PHLPP启动子结合机会减少,作用效果减弱。

图5 转入C/EBPα或 C/EBPβ抑制PHLPP表达的RNA水平
2.6 PHLPP的蛋白表达水平与C/EBP的关系
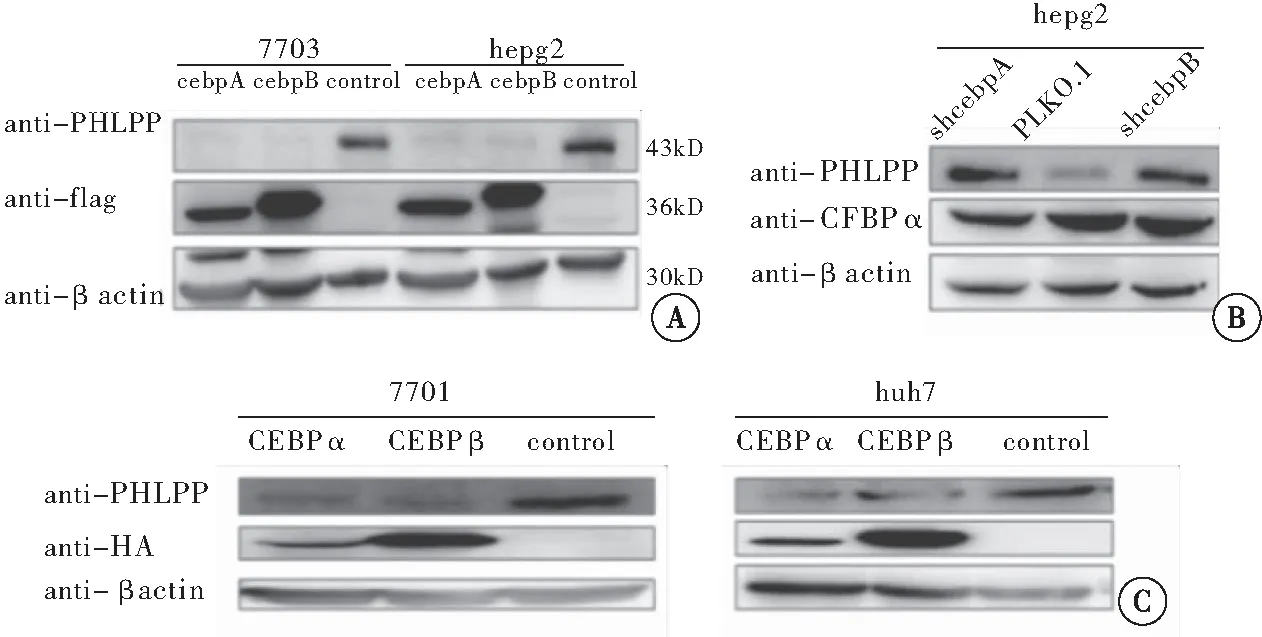
图6 CEBP抑制PHLPP 的表达注:A:实验在7703.hepg2细胞中开展;B:实验在hepg2细胞中开展;C:实验在7701和huh7细胞中开展
2.7 PHLPP在肿瘤中的表达与C/EBP的关系
检测C/EBP的表达情况表明,在偏正常的7701细胞中C/EBPα和C/EBPβ的表达低于恶性程度高的7703细胞(图 7A)。用4对胃癌组织芯片抽取cDNA,通过RT-PCR检测其中PHLPP与C/EBP的表达量。肿瘤组织里C/EBP的表达量高于对照,而PHLPP的表达量低于对照,呈反向变化(图7B~D),即PHLPP的表达相对较低时C/EBP表达就相对高。

图7 不同恶性程度细胞及肿瘤组织与癌旁组织中CEBP和PHLPP表达的比较
2.8 细胞生长速度与C/EBPα的关系
用慢病毒包装好4种shC/EBPα后,感染多种目标细胞,抑制这些细胞中的CEBP表达。筛选出抑制效果明显的细胞,另外进行生长实验研究。细胞的生长随着C/EBPα的抑制明显减缓(图 8)。抑制C/EBPα的表达,使PHLPP与CEBP的结合减少,导致PHLPP升高表达,抑制细胞生长。
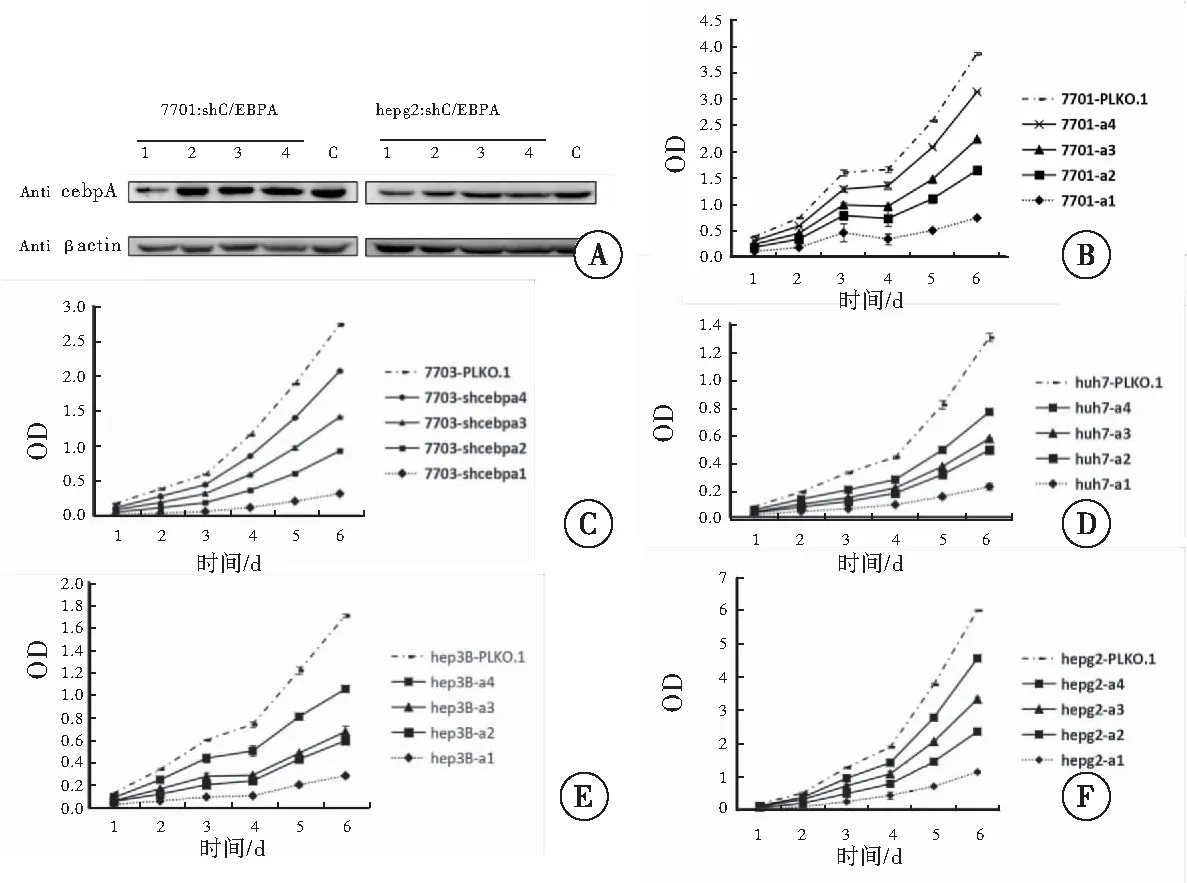
图8 敲除CEBPα后对细胞生长的抑制
2.9 PHLPP在胃癌组织芯片中的表达与C/EBP的关系
组织免疫化学染色实验:分别用C/EBPα、C/EBPβ和PHLPP的抗体对3对(胃癌组织和癌旁组织)芯片进行比对,肿瘤中C/EBPα和C/EBPβ的表达量普遍较高,PHLPP表达量普遍较低(图9)。PHLPP的表达受多种因素影响,C/EBPα、C/EBPβ与之相关。
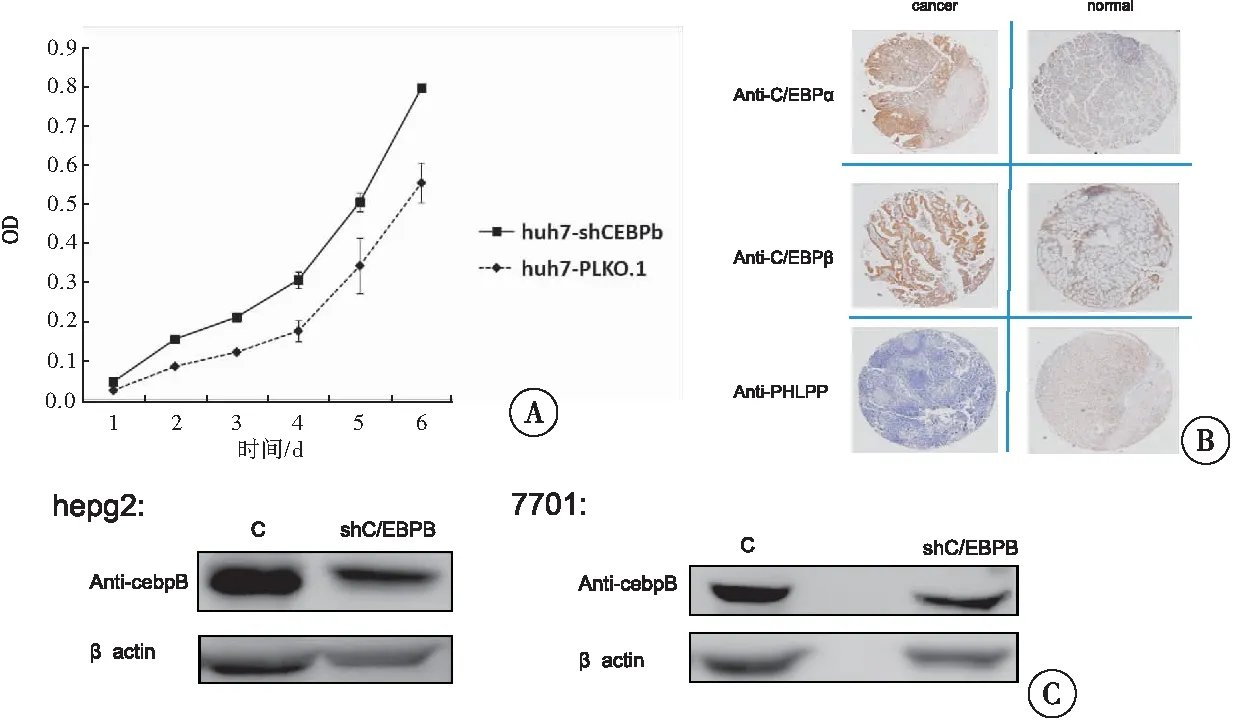
图9 敲除CEBPβ对细胞生长的影响注:A:细胞生长曲线;B:CEBPβ敲除效果;C:肿瘤组织芯片中CEBP与PHLPP表达比较(IHC)
3 讨论
磷酸酶PHLPP通过使AKT的疏水基 (Ser473 in Akt1)去磷酸化,负调控其活性。Akt是一种细胞生长的中枢调节器。C/EBP二聚体通过亮氨酸拉链结构域与DNA结合影响PHLPP的活性,进一步调控AKT的作用,同时,CEBP的活性又受到丝氨酸/苏氨酸激酶的调节[9-11,26]。PHLPP和Akt通过鹰架蛋白FKBP51,可以促进AKT的去磷酸化,在多种肿瘤细胞和胰腺癌组织样品中 FKBP51是下调的。FKBP51在癌细胞中表达的减少导致Akt高度磷酸化,导致在遗传毒性应急中细胞死亡的减少[12]。在人肿瘤中蛋白激酶AKT常常是活化的,易导致化学疗法效果不理想。PHLPP通过FKBP51负调控AKT,这种调控在癌细胞中表现为一种关键的化学敏感性因素[13]。有学者[14-15]认为C/EBP可以抑制胚胎肝脏生长,其对乳腺癌的生长可能也有抑制作用。实验显示,与FKBP51相比,C/EBPα和C/EBPβ很可能有着类似的效果。
C/EBP经常通过结合这些基因的启动子影响其表达。用研究体内蛋白核酸相互作用的ChIP技术,鉴定出 C/EBP是一种伴侣转录因子[16]。通过16 h的IL-1beta刺激,MMP-1 mRNA表达水平能达到最大值。与C/EBPβ (转录因子结合蛋白β)的表达一致(CCAAT 增强子)。IL-1β刺激A549细胞后,C/EBPβ的表达被shRNA敲除, MMP-1、MMP-3和 MMP-10也未表达。DNA亲和层析实验表明, LAP1、LAP2和 LIP 等C/EBPβ异构体结合在MMP-1启动子IL-1β-应答 C/EBPβ 的位点[17]。C/EBP对于转录的重要影响被多种研究报道,例如,启动子的活性必须要有NF-kappaB 和C/C/EBP 的结合位点[18];必须通过C/EBP核心启动子(The core promoter (-111/+29 bp) )才能与一反CCAAT盒的-82/-77 bp结合起作用[19]。不论是体内还是在体外, BPI 基因表达的调节都离不开C/EBPε[20]。C/EBP的表达对其他基因产生有促成作用[21]。C/EBPα或C/EBPβ和Neuro D基因在体外和体内均结合成复合物, C/EBPα 和 Neuro D 的共同作用激活 Fos 启动子[22]。研究[23]证实孕晚期C/EBPβ上调。C/EBP在马的气管炎中也起重要作用[24]。
在转录过程的起始和保持中,转录因子激励或抑制RNA 聚合酶的活性[25]。C/EBPα和C/EBPβ正是通过与PHLPP启动子的结合,抑制其转录,细胞中PHLPP的表达得以调控。在细胞内,多种因素协同作用伴随着细胞的生长,通过与PHLPP启动子的结合,C/EBPα抑制了细胞的生长。PHLPP在细胞中的表达与C/EBPα或C/EBPβ呈负相关。这说明,C/EBPα或C/EBPβ通过与PHLPP启动子的结合, PHLPP的表达得到了抑制,这可能引发细胞增殖。抑制C/EBPβ后并没有明显影响细胞的生长(图9A、B),结合前面的研究分析表明,C/EBP参与PHLPP、AKT和mst1存在相互抑制关系,引发细胞增殖[26]。
总之,通过分析PHLPP的基因序列,用核酸蛋白共沉淀等多种实验方法,发现不论是在肿瘤组织、细胞还是蛋白核酸层面,CEBP都与PHLPP相结合并抑制PHLPP的活性,最终调控细胞的增殖,影响肿瘤的发生发展。

